Powszechnie używana długa forma układu okresowego jest zaprojektowana tak, aby podkreślić konfiguracje elektronowe. Ponieważ to najbardziej zewnętrzne (walencyjne) elektrony są głównie zaangażowane w chemiczne interakcje między atomami, ostatni elektron dodany do atomu w procesie budowania jest o wiele bardziej interesujący dla chemika niż pierwszy. Ten ostatni elektron nazywany jest elektronem rozróżniającym, ponieważ odróżnia on atom od tego, który znajduje się bezpośrednio przed nim w układzie okresowym. Rodzaj podpowłoki (s, p, d, f), w której umieszczony jest elektron rozróżniający jest bardzo ściśle związany z chemicznym zachowaniem pierwiastka i daje podstawę do klasyfikacji pokazanej przez kolorowe kodowanie na układzie okresowym widocznym tutaj. Pierwiastki reprezentatywne to te, w których elektron wyróżniający wchodzi do podpowłoki ans lub p. Większość pierwiastków, których chemię i walencyjność omówiliśmy do tej pory, należy do tej kategorii. Wiele z właściwości chemicznych pierwiastków reprezentatywnych można wyjaśnić na podstawie diagramów Lewisa. Oznacza to, że wartościowość reprezentatywnych pierwiastków można przewidzieć na podstawie liczby elektronów walencyjnych, które posiadają, lub na podstawie liczby elektronów, które należałoby dodać, aby osiągnąć taką samą konfigurację elektronową jak atom gazu szlachetnego. Dla reprezentatywnych pierwiastków liczba elektronów walencyjnych jest taka sama jak numer grupy okresowej, a liczba potrzebna do dopasowania do następnej konfiguracji gazu szlachetnego wynosi 8 minus numer grupy. Zgadza się to z zasadami walencyjnymi wynikającymi z układu okresowego i daje wzory na chlorki pierwszych kilkunastu pierwiastków, które pokazują okresową zmienność walencyjną.
| Pierwiastek | Waga atomowa | Związki wodoru | Związki tlenu | Związki chloru |
|---|---|---|---|---|
| Wodór | 1.01 | H2 | H2O, H2O2 | HCl |
| Helium | 4.00 | Nie powstaje | Nie powstaje | Nie powstaje |
| Lit | 6.94 | LiH | Li2O, Li2O2 | LiCl |
| Beryl | 9.01 | BeH2 | BeO | BeCl2 |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 |
| Węgiel | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Tlen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Nie powstaje | Nie powstaje | Nie powstaje |
| Sód | 22.99 | NaH | Na2O, Na2O2 | NaCl |
| Magnez | 24.31 | MgH2 | MgO | MgCl2 |
Pierwsze trzy poziome wiersze lub okresy w nowoczesnym układzie okresowym składa się w całości z reprezentatywnych elementów. W pierwszym okresie wyróżniające elektrony dla H i He są w podpowłoce 1s. W całym drugim okresie Li i Be mają wyróżniające elektrony w podpowłoce 2s, a elektrony są dodawane do podpowłoki 2p w atomach od B do Ne. W trzecim okresie podpowłoka 3s wypełnia się dla Na i Mg, a więc także dla Al, Si, P, S, Cl i Ar. Z reguły, w przypadku pierwiastków reprezentatywnych, elektron wyróżniający będzie znajdował się w podpowłoce ns lub np. Wartość n, głównej liczby kwantowej dla elektronu różnicującego, może być szybko określona przez odliczanie od góry układu okresowego. Na przykład, jod jest pierwiastkiem reprezentatywnym w piątym okresie. Zatem elektron różnicujący musi zajmować albo podpowłokę 5s albo 5p. Ponieważ I jest po prawej stronie tabeli, 5p jest poprawnym wyborem.
Gdy główna liczba kwantowa wynosi trzy lub więcej, podpowłoki typu d są również możliwe. Pierwiastki przejściowe lub metale przejściowe to te pierwiastki, których wyróżniający elektron znajduje się na orbitalu d. Pierwsze przykłady metali przejściowych (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) znajdują się w czwartym okresie, mimo że elektron wyróżniający w każdym przypadku jest elektronem 3d i należy do trzeciej powłoki. To zawieszenie wynika, jak już widzieliśmy, z tego, że 4s ma niższą energię niż 3d. Orbital 4s zaczyna się więc zapełniać, rozpoczynając czwarty okres zanim którykolwiek z orbitali 3d może zostać zajęty.
Rysunek \(\PageIndex{1}) porównuje rozkłady prawdopodobieństwa elektronu 4s i 3d w atomie V. Chociaż chmura elektronów 4s leży średnio dalej od jądra niż chmura 3d, niewielka część gęstości elektronów 4s znajduje się bardzo blisko jądra, gdzie jest ledwo osłonięta przed całkowitym ładunkiem jądrowym +23. To bardzo silna siła przyciągania tej niewielkiej części całkowitej gęstości elektronów 4s obniża energię elektronu 4s poniżej energii 3d.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
Fakt, że chmura elektronowa 4s jest bardziej rozległa niż 3d ma istotny wpływ na chemię pierwiastków przejściowych. Kiedy atom taki jak V (Rysunek \) oddziałuje z innym atomem, to właśnie elektrony 4s wysunięte najdalej od jądra jako pierwsze stykają się z drugim atomem. Dlatego elektrony 4s s± często bardziej znacz±ce niż 3d w okre¶laniu walencji i wzorów zwi±zków chemicznych. Elektrony 3d są „zakopane” pod powierzchnią atomów metali przejściowych. Dodanie jednego elektronu 3d więcej ma znacznie mniejszy wpływ na ich właściwości chemiczne niż dodanie jednego elektronu 3s lub 3p więcej w przypadku pierwiastków reprezentatywnych. Dlatego też istnieje powolne, ale stałe przejście we właściwościach od jednego pierwiastka przejściowego do drugiego. Zauważmy, na przykład, że z wyjątkiem Sc, wszystkie metale przejściowe tworzą chlorki, MCl2, gdzie metal ma walencję 2; przykładami są TiCl2, VCl2, CrCl2, i tak dalej. Można to zobaczyć w tabeli znajdującej się na górze tej strony. Walencja 2 odpowiada dwóch elektronów walencyjnych 4s.
Każdy z metali przejściowych wykazuje również inne walencje, gdzie jeden lub więcej elektronów 3d są również zaangażowane. Na przykład, w niektórych związkach V (wanad) ma walencję 2 (VO, VCl2) w innych ma walencję 3 (V2O3, VCl3), w jeszcze innych ma walencję 4 (VO2, VCl4), a w co najmniej jednym przypadku (V2O5) ma walencję 5. Z powodu zmiennej wartościowości chemia metali przejściowych jest bardziej skomplikowana i możliwa jest większa różnorodność wzorów związków metali przejściowych. W niektórych przypadkach elektrony w podpowłokach d pełnią rolę elektronów walencyjnych, a w innych nie. Chociaż chmury elektronowe 3d nie s± bardziej oddalone od j±dra niż 3s i 3p (a więc nie tworz± kolejnej powłoki, jak to ma miejsce w przypadku elektronów 4s), s± one dokładnie osłonięte przed ładunkiem j±drowym i dlatego często działaj± jako elektrony walencyjne. To zachowanie Jekylla i Hyde’a elektronów 3d czyni życie bardziej skomplikowanym (i często o wiele bardziej interesującym) dla chemików badających pierwiastki przejściowe.
| Z | Pierwiastek | Konfiguracja | |
|---|---|---|---|
| 1 | H | 1s 1 | |
| 2 | He | 1s 2 | |
| 3 | Li | 2s 1 | |
| 4 | Be | 2s 2 | |
| 5 | B | 2s 2 2p1 | |
| 6 | C | 2s 2 2p2 | |
| 7 | N | 2s 2 2p3 | |
| 8 | 0 | 2s 2 2p4 | |
| 9 | F | 2s 2 2p5 | |
| 10 | Ne | 2s 2 2p6 | |
| 11 | Na | 3s 1 | |
| 12 | Mg | 3s 2 | |
| 13 | Al | 3s 2 3p1 | |
| 14 | Si | 3s 2 3p2 | |
| 15 | P | 3s 2 3p3 | |
| 16 | S | 3s 2 3p4 | |
| 17 | Cl | 3s 2 3p5 | |
| 18 | Ar | 3s 2 3p6 | |
| 19 | K | 4s 1 | |
| 20 | Ca | 4s 2 | |
| 21 | Sc | 3d 1 4s 2 | |
| 22 | Ti | 3d 2 4s 2 | |
| 23 | V | 3d 3 4s 2 | |
| 24 | Cr | . | 3d 5 4s 1 |
| 25 | Mn | 3d 5 4s 2 | |
| 26 | . Fe | 3d 6 4s 2 | |
| 27 | Co | 3d 7 4s 2 | |
| 28 | Ni | 3d 8 4s 2 | |
| 29 | Cu | 3d 10 4s 1 | |
| 30 | Zn | 3d 10 4s 2 | |
| 31 | Ga | 3d 10 4s 2 4p 1 | |
| 32 | Ge | 3d 10 4s 2 4p 2 | |
| 33 | As | 3d 10 4s 2 4p 3 | |
| 34 | Se | 3d 10 4s 2 4p 4 | |
| 35 | Br | 3d 10 4s 2 4p 5 | |
| 36 | Kr | 3d 10 4s 2 4p 6 | |
| 37 | Rb | . | 5s 1 |
| 38 | Sr | 5s 2 | |
| 39 | Y | 4d 1 5s 2 | |
| 40 | Zr | 4d 2 5s 2 | |
| 41 | Nb | 4d 4 5s 1 | |
| 42 | Mo | 4d 5 5s 1 | |
| 43 | Tc | 4d 5 5s 2 | |
| 44 | Ru | 4d 7 5s 1 | |
| 45 | Rh | 4d 8 5s 1 | |
| 46 | Pd | 4d 10 | |
| 47 | Ag | 4d 10 5s 1 | |
| 48 | Cd | . | 4d 10 5s 2 |
| 49 | In | 4d 10 5s 2 5p 1 | |
| 50 | Sn | 4d 10 5s 2 5p 2 | |
| 51 | Sb | 4d 10 5s 2 5p 3 | |
| 52 | Te | 4d 10 5s 2 5p 4 | |
| 53 | I | 4d 10 5s 2 5p 5 | |
| 54 | Xe | 4d 10 5s 2 5p 6 | |
| 55 | Cs | 6s 1 | |
| 56 | Ba | 6s 2 | |
| 57 | La | 5d 1 6s 2 | |
| 58 | Ce | 4f 1 5d 1 6s 2 | |
| 59 | Pr | 4f 3 6s 2 | |
| 60 | Nd | 4f 4 6s 2 | |
| 61 | Pm | . | 4f 5 6s 2 |
| 62 | Sm | 4f 6 6s 2 | |
| 63 | Eu | 4f 7 6s 2 | |
| 64 | Gd | 4f 7 5d 1 6s 2 | |
| 65 | Tb | 4f 9 6s 2 | |
| 66 | Dy | 4f 10 6s 2 | |
| 67 | Ho | 4f 11 6s 2 | |
| 68 | Er | 4f 12 6s 2 | 4f 12 6s 2 |
| 69 | Tm | 4f 13 6s 2 | |
| 70 | Yb | 4f 14 6s 2 | |
| 71 | Lu | 4f 14 5d 1 6s 2 | |
| 72 | Hf | 4f 14 5d 2 6s 2 | |
| 73 | Ta | 4f 14 5d 3 6s 2 | |
| 74 | W | 4f 14 5d 4 6s 2 | |
| 75 | . Re | 4f 14 5d 5 6s 2 | |
| 76 | 0s | 4f 14 5d 6 6s 2 | |
| 77 | Ir | 4f 14 5d 7 6s 2 | |
| 78 | Pt | 4f 14 5d 9 6s 1 | |
| 79 | Au | 4f 14 5d 10 6s 1 | |
| 80 | Hg | 4f 14 5d 10 6s 2 | |
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 | |
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 | |
| 83 | Bi | 4f 14 5d 10 6s 2 6p 3 | |
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 | |
| 85 | At | 4f 14 5d 10 6s 2 6p 5 | |
| 86 | Rn | . | 4f 14 5d 10 6s 2 6p 6 |
| 87 | . Fr | 7s 1 | |
| 88 | Ra | 7s 2 | |
| 89 | Ac | 6d 1 7s 2 | |
| 90 | Th | 6d 2 7s 2 | |
| 91 | Pa | 5f 2 6d 1 7s 2 | |
| 92 | U | 5f 3 6d 1 7s 2 | |
| 93 | Np | 5f 4 6d 1 7s 2 | |
| 94 | Pu | 5f 6 7s 2 | |
| 95 | Am | 5f 7 7s 2 | |
| 96 | Cm | 5f 7 6d 1 s 2 | |
| 97 | Bk | 5f 9 s 2 | |
| 98 | Cf | 5f 10 s 2 | |
| 99 | Es | 5f 11 s 2 | |
| 100 | Fm | 5f 12 s 2 | |
| 101 | Md | 5f 13 s 2 | |
| 102 | Nie | 5f 14 s 2 | |
| 103 | Lr | 5f 14 6d 1 s 2 | |
| 104 | Rf | 5f 14 6d 2 s 2 |
Trzecia główna kategoria pierwiastków powstaje, gdy elektron wyróżniający zajmuje podpowłokę f. Pierwszy przykład występuje w przypadku lantanowców (pierwiastki o liczbach atomowych od 57 do 71). Lantanowce mają ogólną konfigurację elektronową
4d104f i5s25p65d0 lub 16s2
gdzie i jest liczbą od 0 do 14. Tak więc w procesie budowania lantanowców elektrony są dodawane do podpowłoki (4f), której główna liczba kwantowa jest o dwa mniejsza niż liczba kwantowa najbardziej zewnętrznego orbitalu (6s). Dodanie kolejnego elektronu do wewnętrznej powłoki zakopanej tak głęboko jak 4f ma niewielki lub żaden wpływ na właściwości chemiczne tych pierwiastków. Wszystkie są dość podobne do lantanu (La) i mogłyby się zmieścić dokładnie w tym samym miejscu w układzie okresowym co La. Elementy lantanowców są tak podobne do siebie, że do ich rozdzielenia potrzebne są specjalne techniki. W rezultacie, nawet w przybliżeniu czyste próbki większości z nich nie zostały przygotowane aż do lat 70-tych XIX wieku. Po pierwiastku aktyn (Ac) następuje seria atomów, w których wypełnieniem jest podpowłoka 5f. Aktynowce są nieco mniej podobne do Ac niż lantanowce do La, ponieważ pewne odstępstwa od zwykłej kolejności wypełniania orbitali występują w przypadku Th, Pa i U (tabela ).
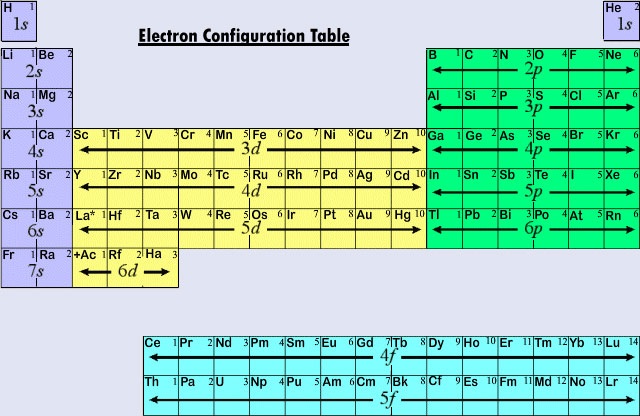
Ponieważ lantanoidy i większość aktynoidów zachowują się chemicznie tak, jakby powinny pasować do grupy IIIB układu okresowego (gdzie znajdują się Lu i Lr), obie grupy są oddzielone od reszty tabeli i umieszczone razem w bloku poniżej. Razem wzięte, lantanoidy i aktinoidy są nazywane pierwiastkami wewnętrznego przejścia, ponieważ wypełniane podpowłoki f leżą tak głęboko w pozostałej strukturze elektronowej ich atomów.
Rysunek ™(™PageIndex{2}}) podsumowuje typ podpowłoki, w której wyróżniający elektron ma być znaleziony dla atomów pierwiastków w różnych regionach układu okresowego. Ta informacja podsumowująca sprawia, że stosunkowo łatwo jest użyć układu okresowego do uzyskania konfiguracji elektronowych, jak pokazuje poniższy przykład.
Przykład \(\PageIndex{1}\): Konfiguracja elektronowa
Otrzymaj konfigurację elektronową dla (a) Nb; (b) Pr.
Rozwiązanie
a) Nb, pierwiastek o numerze 41, znajduje się w piątym okresie i w regionie układu okresowego, w którym wypełniona jest podpowłoka d (drugi szereg przejściowy). Przesuwając się wstecz (w kierunku niższych liczb atomowych) w układzie okresowym, najbliższym gazem szlachetnym jest Kr, a więc używamy jądra Kr:
Nb _____
Kolejnym pierwiastkiem po 36K jest 37Rb, w którym wypełniona jest podpowłoka 5s. Przesuwając się jeszcze o jedną przestrzeń w prawo dochodzimy do 38Sr, który ma parę 5s2. Jak dotąd mamy Nb _____ 5s2 dla konfiguracji Nb. Teraz przesuwamy się dalej w prawo do regionu 4d podpowłoki układu okresowego i liczymy przez trzy przestrzenie (Y, Zr, Nb), aby dotrzeć do Nb. Całkowita konfiguracja elektronowa jest więc Nb 4d35s2 (Zauważ, że główna liczba kwantowa podpowłoki d wynosi 4 – o jeden mniej niż liczba okresu. Ponadto, jeśli spojrzeć na tabelę konfiguracji elektronowych, należy zauważyć, że Nb jest wyjątkiem od typowych reguł wypełniania orbitali) b) Podobna procedura jest stosowana dla Pr, pierwiastka o numerze 59. Przesuwając się wstecz przez tabelę, najbliższym gazem szlachetnym jest Xe, a więc używamy jądra Xe. Licząc ponownie do przodu, Cs i Ba odpowiadają 6s2. Następnie La, Ce i Pr odpowiadają kolejnym trzem elektronom w podpowłoce 4f. Konfiguracja jest więc Pr…4f36s2
Należy podkreślić jeszcze jedną kwestię dotyczącą związku pomiędzy konfiguracją elektronową a układem okresowym. Atomy pierwiastków w tej samej kolumnie pionowej tabeli mają podobne konfiguracje elektronowe. Na przykład, rozważmy pierwiastki ziem alkalicznych (grupa IIA). Stosując nasze reguły wyprowadzania konfiguracji elektronowych (Przykład 1) mamy
| Pierwiastek | Konfiguracja elektronowa | Schemat Lewisa |
|---|---|---|
| Be | 2s2 | Be: |
| Mg | 3s2 | Mg: |
| Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr: |
| Ba | 6s2 | Ba: |
| Ra | 7s2 | Ra: |
Więc podobieństwa zachowania chemicznego i walencyjności zauważone wcześniej dla tych pierwiastków korelują z podobieństwami ich najbardziej zewnętrznych chmur elektronowych. Takie podobieństwa konto dla sukcesu Mendelejewa przewidywania właściwości nieodkrytych elements.
Contributors and Attributions
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
.
