Zależnie od właściwości kwasowo-zasadowych jonów składowych, sól może rozpuszczać się w wodzie, tworząc roztwór obojętny, zasadowy lub kwaśny.
Gdy sól taka jak NaCl rozpuszcza się w wodzie, wytwarza jony Na^+_{(aq)} i Cl^-_{(aq)}. Stosując metodę Lewisa, jon Na^+ może być postrzegany jako kwas, ponieważ jest akceptorem pary elektronowej, chociaż jego niski ładunek i stosunkowo duży promień sprawiają, że jest to bardzo słaby kwas. Jon Cl^- jest zasadą sprzężoną z mocnym kwasem HCl, więc w zasadzie nie ma charakteru zasadowego. W konsekwencji, rozpuszczenie NaCl w wodzie nie ma wpływu na pH roztworu i pozostaje on obojętny. Porównajmy to z zachowaniem wodnych roztworów cyjanku potasu i octanu sodu. Ponownie, kationy (K^+) i Na^+) nie mają zasadniczo charakteru kwasowego, ale aniony (CN^-) i CH_3CO_2^-) są słabymi zasadami, które mogą reagować z wodą, ponieważ są to zasady sprzężone ze słabymi kwasami, odpowiednio HCN i octowym.
Żadna z reakcji nie przebiega bardzo daleko w prawo, tak jak napisano, ponieważ faworyzowane jest tworzenie słabszej pary kwas-zasada. Zarówno kwas (HCN) jak i kwas octowy są silniejszymi kwasami niż woda, a wodorotlenek jest silniejszą zasadą niż octan lub cyjanek, więc w obu przypadkach równowaga leży po lewej stronie. Niemniej jednak, każda z tych reakcji generuje wystarczającą ilość jonów wodorotlenkowych, aby wytworzyć roztwór zasadowy. Na przykład, wartość pH 0,1 M roztworu octanu sodu lub cyjanku potasu w temperaturze 25°C wynosi odpowiednio 8,8 lub 11,1. Z tabeli i rysunku widzimy, że CN^- jest silniejszą zasadą (pK_b = 4,79) niż octan (pK_b = 9.24)), co jest zgodne z tym, że przy tym samym stężeniu \(KCN\) tworzy bardziej zasadowy roztwór niż octan sodu.
Z kolei sprzężony kwas słabej zasady powinien być słabym kwasem (równanie \(\)). Na przykład chlorek amonu i chlorek pirydyny to sole powstałe w wyniku reakcji amoniaku i pirydyny, odpowiednio, z \(HCl\). Jak już wiesz, jon chlorkowy jest tak słabą zasadą, że nie reaguje z wodą. Natomiast kationy tych dwóch soli są słabymi kwasami, które reagują z wodą w następujący sposób:
Z równania \(\{16.2}} wskazuje, że H_3O^+ jest silniejszym kwasem niż NH_4^+ lub C_5H_5NH^+ i odwrotnie, amoniak i pirydyna są silniejszymi zasadami niż woda. Dlatego w obu przypadkach równowaga będzie leżeć daleko po lewej stronie, faworyzując słabszą parę kwas-zasada. Stężenie H_3O^+ powstające w wyniku reakcji jest jednak wystarczająco duże, aby znacznie obniżyć pH roztworu: pH 0,10 M roztworu chlorku amonu lub chlorku pirydyny w temperaturze 25°C wynosi odpowiednio 5,13 lub 3,12. Jest to zgodne z informacjami przedstawionymi na rysunku 16.2, wskazującymi, że jon pirydynowy jest bardziej kwaśny niż jon amonowy.
Co dzieje się z wodnymi roztworami soli takich jak octan amonu, w których zarówno kation, jak i anion mogą reagować oddzielnie z wodą, tworząc odpowiednio kwas i zasadę? Zgodnie z rysunkiem 16.10, jon amonowy obniży pH, a jon octanowy podniesie pH, zgodnie z równaniem 16.3. Ten szczególny przypadek jest nietypowy, ponieważ kation jest tak samo silnym kwasem, jak anion zasadą (pKa ≈ pKb). W związku z tym oba efekty się znoszą, a roztwór pozostaje obojętny. W przypadku soli, w których kation jest mocniejszym kwasem niż anion zasadą, końcowy roztwór ma pH < 7,00. I odwrotnie, jeśli kation jest słabszym kwasem niż anion jest zasadą, roztwór końcowy ma \(pH \) > 7,00.
Roztwory prostych soli jonów metali mogą być również kwaśne, mimo że jon metalu nie może przekazać protonu bezpośrednio do wody, aby wytworzyć \(H_3O^+\). Zamiast tego, jon metalu może działać jak kwas Lewisa i oddziaływać z wodą, zasadą Lewisa, poprzez koordynację z samotną parą elektronów na atomie tlenu, tworząc uwodniony jon metalu (część (a) na rysunku). Cz±steczka wody skoordynowana z jonem metalu jest bardziej kwa¶na niż wolna cz±steczka wody z dwóch powodów. Po pierwsze, odpychające oddziaływania elektrostatyczne pomiędzy dodatnio naładowanym jonem metalu i częściowo dodatnio naładowanymi atomami wodoru skoordynowanej cząsteczki wody ułatwiają jej utratę protonu.
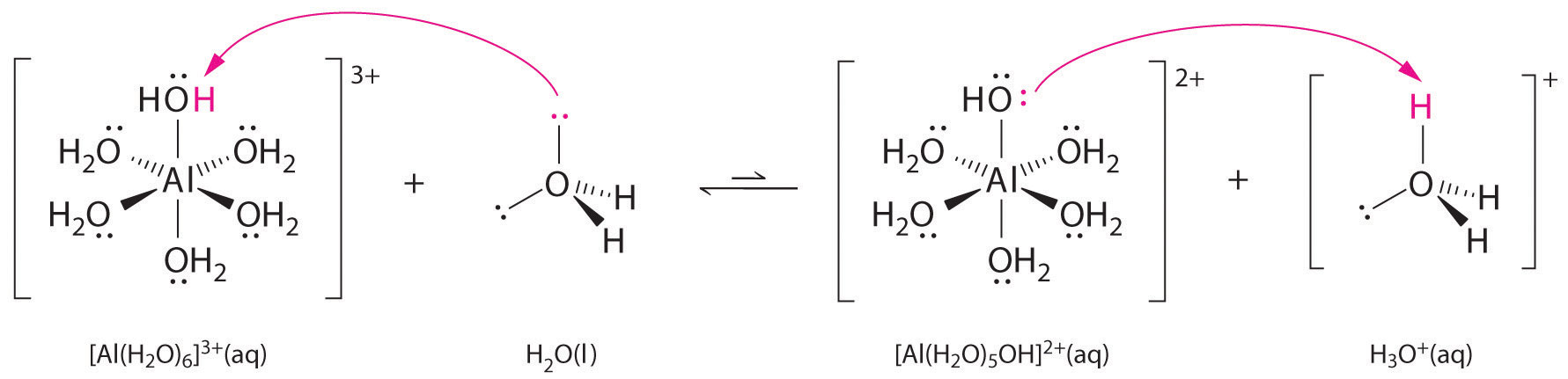
Po drugie, dodatni ładunek na jonie ^{3+}} przyciąga gęstość elektronów z atomów tlenu cząsteczek wody, co zmniejsza gęstość elektronów w wiązaniach ^{O-H}}, jak pokazano w części (b) na Rysunku ^{PageIndex{1}}. Przy mniejszej gęstości elektronów pomiędzy atomami O a atomami H, wiązania _CO-H są słabsze niż w wolnej cząsteczce H, co ułatwia utratę jonu H^+.
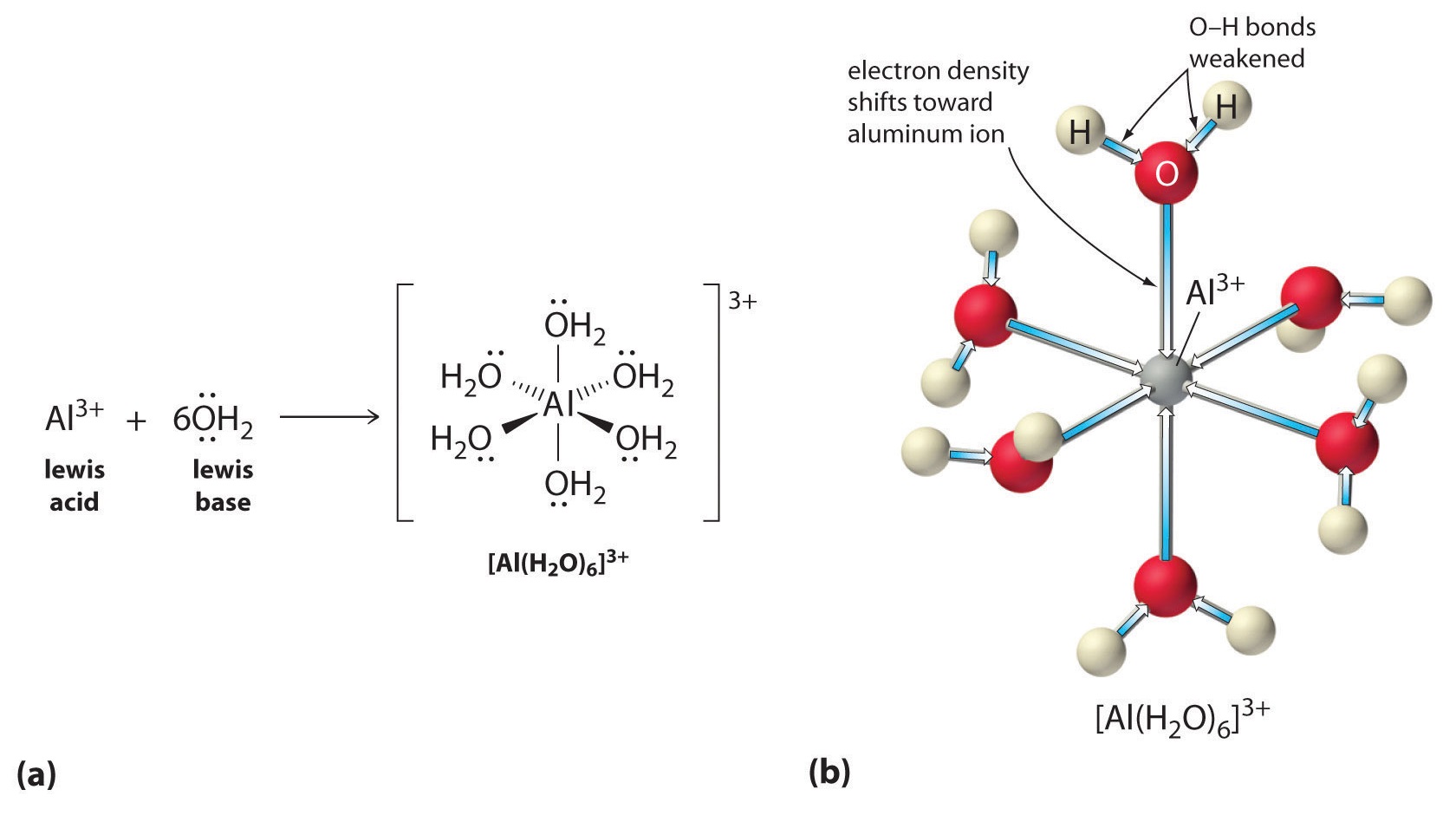
Rysunek \(\PageIndex{1}}): Wpływ jonu metalu na kwasowość wody (a) Reakcja jonu metalu (Al^{3+}) z wodą, w wyniku której powstaje uwodniony jon metalu, jest przykładem reakcji kwasowo-zasadowej Lewisa. (b) Dodatni ładunek na jonie glinu przyciąga gęstość elektronów z atomów tlenu, co powoduje przesunięcie gęstości elektronów od wiązań O-H. Zmniejszenie gęstości elektronowej osłabia wiązania O-H w cząsteczkach wody i ułatwia im utratę protonu.
Wielkość tego efektu zależy od następujących dwóch czynników (rysunek rzedu{2}):
- Ładunek na jonie metalu. Jon dwuwartościowy (M^{2+}}) ma około dwukrotnie silniejszy wpływ na gęstość elektronów w skoordynowanej cząsteczce wody niż jon jednowartościowy (M^+}) o tym samym promieniu.
- Promień jonu metalu. Dla jonów metali o tym samym ładunku, im mniejszy jon, tym krótsza odległość wewnątrzjądrowa do atomu tlenu cząsteczki wody i tym większy wpływ metalu na rozkład gęstości elektronowej w cząsteczce wody.
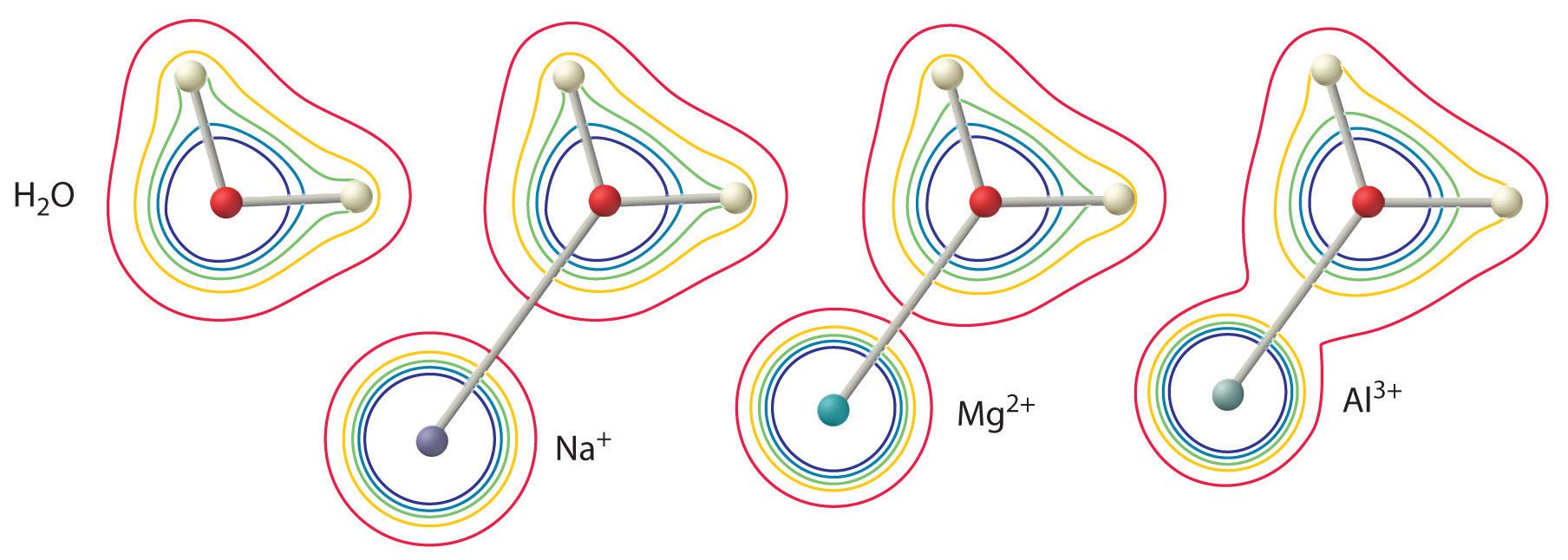
Ryc: Wpływ ładunku i promienia jonu metalu na kwasowość skoordynowanej cząsteczki wody. Kontury pokazują gęstość elektronów na atomach O i H zarówno w wolnej cząsteczce wody (po lewej) jak i w cząsteczkach wody skoordynowanych z jonami Na^+, Mg^{2+} i Al^{3+}. Te mapy konturowe pokazują, że najmniejszy, najbardziej naładowany jon metalu (Al^{3+}}) powoduje największy spadek gęstości elektronowej wiązań O-H cząsteczki wody. Ze względu na ten efekt kwasowość uwodnionych jonów metali wzrasta wraz ze wzrostem ładunku na jonie metalu i zmniejszaniem się jego promienia.
Tak więc wodne roztwory małych, silnie naładowanych jonów metali, takich jak ^{3+}} i ^{3+}}, są kwaśne:
^{3+}_{(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \^{16.36}}]
Jon ^{3+} ma ^{3+}_{(aq)} ^{2+}_{(aq)}+H^+_{(aq)}, co czyni go prawie tak silnym kwasem jak kwas octowy. Ze względu na dwa opisane wcześniej czynniki, najważniejszym parametrem pozwalającym przewidzieć wpływ jonu metalu na kwasowość skoordynowanych cząsteczek wody jest stosunek ładunku do promienia jonu metalu. Wiele par jonów metali, które leżą na ukośnej linii układu okresowego, takich jak jony Li^+ i Mg^{2+} lub jony Ca^{2+} i Y^{3+}, mają różne rozmiary i ładunki, ale podobny stosunek ładunku do promienia. W rezultacie, te pary jonów metali mają podobny wpływ na kwasowość skoordynowanych cząsteczek wody i często wykazują również inne znaczące podobieństwa w chemii.
Roztwory małych, silnie naładowanych jonów metali w wodzie są kwaśne.
Reakcje takie jak te omówione w tym rozdziale, w których sól reaguje z wodą dając roztwór kwaśny lub zasadowy, są często nazywane reakcjami hydrolizy. Używanie osobnej nazwy dla tego typu reakcji jest niefortunne, ponieważ sugeruje, że są one w jakiś sposób różne. W rzeczywistości reakcje hydrolizy są po prostu reakcjami kwasowo-zasadowymi, w których kwas jest kationem lub zasada jest anionem; są one zgodne z tymi samymi zasadami i regułami, co wszystkie inne reakcje kwasowo-zasadowe.
Reakcja hydrolizy jest reakcją kwasowo-zasadową.
Przykład
Przewidź, czy wodne roztwory tych związków są kwaśne, zasadowe, czy obojętne.
- (KNO_3)
- (CrBr_3 cdot H_2O)
- (Na_2SO_4)
Dane: związek
Pytanie o: kwasowość lub zasadowość roztworu wodnego
Strategia:
- Oceń właściwości kwasowo-zasadowe kationu i anionu. Jeśli kation jest słabym kwasem Lewisa, to nie będzie miał wpływu na pH roztworu. Jeżeli jednak kation jest sprzężonym kwasem słabej zasady lub stosunkowo silnie naładowanym kationem metalu, to będzie reagował z wodą, dając roztwór o odczynie kwaśnym.
- Jeżeli anion jest sprzężoną zasadą silnego kwasu, to nie będzie miał wpływu na \(pH\) roztworu. Jeśli jednak anion jest sprzężoną zasadą słabego kwasu, roztwór będzie zasadowy.
Roztwór:
a
- Kation ^+ ma mały ładunek dodatni (+1) i stosunkowo duży promień (ponieważ znajduje się w czwartym rzędzie układu okresowego), jest więc bardzo słabym kwasem Lewisa.
- Anion(NO_3-) jest sprzężoną zasadą mocnego kwasu, a więc w zasadzie nie ma charakteru zasadowego (Tabela 16.1). Stąd ani kation, ani anion nie będą reagować z wodą, tworząc ^+ lub ^ OH^-, a roztwór będzie obojętny.
b.
- Jon ^{3+}} jest stosunkowo silnie naładowanym kationem metalu, który powinien zachowywać się podobnie jak jon ^{3+}} i tworzyć kompleks ^{3+}}, który będzie zachowywał się jak słaby kwas: \^{3+}_{(aq)} \ce{ <=>>} Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_{(aq)}
- Anion ^(Br^-) jest bardzo słabą zasadą (jest zasadą sprzężoną z mocnym kwasem ^(HBr)), więc nie wpływa na ^(pH) roztworu. Stąd roztwór będzie kwaśny.
c.
- Jon \(Na^+\), podobnie jak \(K^+\), jest bardzo słabym kwasem, więc nie powinien wpływać na kwasowość roztworu.
- Natomiast \(SO_4^{2-}) jest zasadą sprzężoną z \(HSO_4^-\), który jest słabym kwasem. Stąd jon \(SO_4^{2-}) będzie reagował z wodą, jak pokazano na rysunku 16.6, dając roztwór lekko zasadowy.
Ćwiczenie \(\PageIndex{1}})
Przewidź, czy wodne roztwory następujących związków są kwaśne, zasadowe czy obojętne.
- (KI)
- (Mg(ClO_4)_2)
- (NaHS)
Odpowiedź:
- neutralny
- kwaśny
- zasadowy (w wyniku reakcji ^-(HS^-) z wodą tworząc ^(H_2S) i ^(OH^-))
Podsumowanie
Sól może rozpuszczać się w wodzie tworząc roztwór obojętny, zasadowy lub kwaśny roztwór, w zależności od tego, czy zawiera sprzężoną zasadę słabego kwasu jako anion (A^-), sprzężony kwas słabej zasady jako kation (BH^+), lub oba. Sole, które zawierają małe, silnie naładowane jony metali, tworzą w wodzie roztwory kwaśne. Reakcja soli z wodą, w wyniku której powstaje roztwór kwaśny lub zasadowy, nazywana jest reakcją hydrolizy.
.
