Cele nauczania
- Opisać składniki zaangażowane w skurcz mięśnia
- Wyjaśnić, jak mięśnie kurczą się i rozkurczają
- Opisać model filamentu ślizgowego skurczu mięśnia
Sekwencja zdarzeń, które skutkują skurczem pojedynczego włókna mięśniowego, rozpoczyna się od sygnału – neuroprzekaźnika, ACh – z neuronu ruchowego unerwiającego to włókno. Lokalna błona włókna depolaryzuje się, ponieważ dodatnio naładowane jony sodu (Na+) wchodzą do środka, wyzwalając potencjał czynnościowy, który rozprzestrzenia się na resztę błony depolaryzuje się, w tym na T-tubule. Wywołuje to uwolnienie jonów wapnia (Ca++) z magazynu w retikulum sarkoplazmatycznym (SR). Następnie Ca++ inicjuje skurcz, który jest podtrzymywany przez ATP (Rycina 1). Tak długo, jak jony Ca++ pozostają w sarkoplazmie, aby wiązać się z troponiną, która utrzymuje „nieosłonięte” miejsca wiązania aktyny, i tak długo, jak ATP jest dostępny do napędzania cykli mostków poprzecznych i ciągnięcia splotów aktyny przez miozynę, włókno mięśniowe będzie się nadal skracać do anatomicznej granicy.

Rysunek 1. Skurcz włókna mięśniowego. Pomiędzy aktyną a główkami miozyny tworzy się mostek poprzeczny, który wywołuje skurcz. Dopóki jony Ca++ pozostają w sarkoplazmie, wiążąc się z troponiną, i dopóki dostępny jest ATP, włókno mięśniowe będzie się skracać.
Skurcz mięśnia zwykle ustaje, gdy kończy się sygnalizacja z neuronu motorycznego, co powoduje repolaryzację sarkolemmy i T-tubul oraz zamknięcie kanałów wapniowych bramkowanych napięciem w SR. Jony Ca++ są następnie pompowane z powrotem do SR, co powoduje, że tropomiozyna ponownie osłania (lub ponownie pokrywa) miejsca wiązania na nitkach aktyny. Mięsień może również przestać się kurczyć, gdy zabraknie mu ATP i ulegnie zmęczeniu (rysunek 2).

Rysunek 2. Relaksacja włókna mięśniowego. Jony Ca++ są pompowane z powrotem do SR, co powoduje ponowne osłonięcie przez tropomiozynę miejsc wiązania na niciach aktyny. Mięsień może również przestać się kurczyć, gdy zabraknie mu ATP i ulegnie zmęczeniu.
Molekularne wydarzenia związane ze skracaniem włókien mięśniowych zachodzą w obrębie sarkomerów włókna (patrz Rycina 3). Skurcz włókna mięśniowego prążkowanego zachodzi, gdy mięsień, liniowo ułożony w miofibrylach, skraca się, gdy główki miozyny naciągają filamenty aktyny.
Region, w którym zachodzą na siebie grube i cienkie filamenty, ma gęsty wygląd, ponieważ między filamentami jest mało miejsca. Ta strefa, w której cienkie i grube filamenty zachodzą na siebie, jest bardzo ważna dla skurczu mięśnia, ponieważ jest to miejsce, w którym rozpoczyna się ruch filamentów. Cienkie filamenty, zakotwiczone na końcach przez dyski Z, nie rozciągają się całkowicie do centralnego obszaru, który zawiera tylko grube filamenty, zakotwiczone u swych podstaw w miejscu zwanym linią M. Miofibryla składa się z wielu mięsieńców biegnących wzdłuż jej długości; w ten sposób miofibryle i komórki mięśniowe kurczą się, gdy kurczą się mięsieńce.
Model skurczu włókien ślizgowych
Po sygnale od neuronu ruchowego, włókno mięśnia szkieletowego kurczy się, gdy cienkie włókna są ciągnięte, a następnie przesuwają się obok grubych włókien w obrębie mięsieńców włókna. Proces ten znany jest jako model ślizgania się filamentów w skurczu mięśnia (Rysunek 3). Przesuwanie może zachodzić tylko wtedy, gdy miejsca wiążące miozynę na filamentach aktynowych są odsłonięte w serii kroków, która rozpoczyna się od wprowadzenia Ca++ do sarkoplazmy.

Rysunek 3. Model skurczu mięśnia oparty na filamentach ślizgowych. Kiedy sarkomer kurczy się, linie Z przesuwają się bliżej siebie, a pasmo I staje się mniejsze. Pasmo A pozostaje tej samej szerokości. Przy pełnym skurczu cienkie i grube filamenty zachodzą na siebie.
Tropomiozyna jest białkiem, które owija się wokół łańcuchów filamentu aktynowego i pokrywa miejsca wiążące miozynę, aby zapobiec wiązaniu się aktyny z miozyną. Tropomiozyna wiąże się z troponiną, tworząc kompleks troponina-tropomiozyna. Kompleks troponina-tropomiozyna zapobiega wiązaniu się „główek” miozyny z miejscami aktywnymi na mikrofilamentach aktyny. Troponina posiada również miejsce wiążące jony Ca++.
Aby zainicjować skurcz mięśnia, tropomiozyna musi odsłonić miejsce wiążące miozynę na filamencie aktynowym, aby umożliwić utworzenie mostka krzyżowego między mikrofilamentami aktynowymi i miozynowymi. Pierwszym krokiem w procesie skurczu jest związanie Ca++ z troponiną, dzięki czemu tropomiozyna może odsunąć się od miejsc wiążących na włóknach aktyny. Pozwala to głowom miozyny związać się z tymi odsłoniętymi miejscami wiązania i utworzyć mostki poprzeczne. Cienkie filamenty są następnie ciągnięte przez główki miozyny, aby przesunąć się obok grubych filamentów w kierunku środka sarkomeru. Ale każda głowa może ciągnąć tylko na bardzo krótką odległość, zanim osiągnie swój limit i musi zostać „odciągnięta”, zanim będzie mogła ciągnąć ponownie, co wymaga ATP.
ATP i skurcz mięśnia
Aby cienkie filamenty mogły nadal przesuwać się obok grubych filamentów podczas skurczu mięśnia, głowice miozyny muszą ciągnąć aktynę w miejscach wiązania, odłączać się, odbijać, dołączać do kolejnych miejsc wiązania, ciągnąć, odłączać się, odbijać, odbijać itd. Ten powtarzający się ruch znany jest jako cykl mostków poprzecznych. Ten ruch główek miozyny jest podobny do ruchu wioseł, kiedy osoba wiosłuje łodzią: Wiosło wioseł (główki miozyny) ciągną, są podnoszone z wody (odrywają się), ponownie pozycjonowane (re-cocked), a następnie ponownie zanurzane, aby ciągnąć (rysunek 4). Każdy cykl wymaga energii, a działanie główek miozyny w sarkomerach powtarzalnie ciągnących na cienkich filamentach również wymaga energii, która jest dostarczana przez ATP.
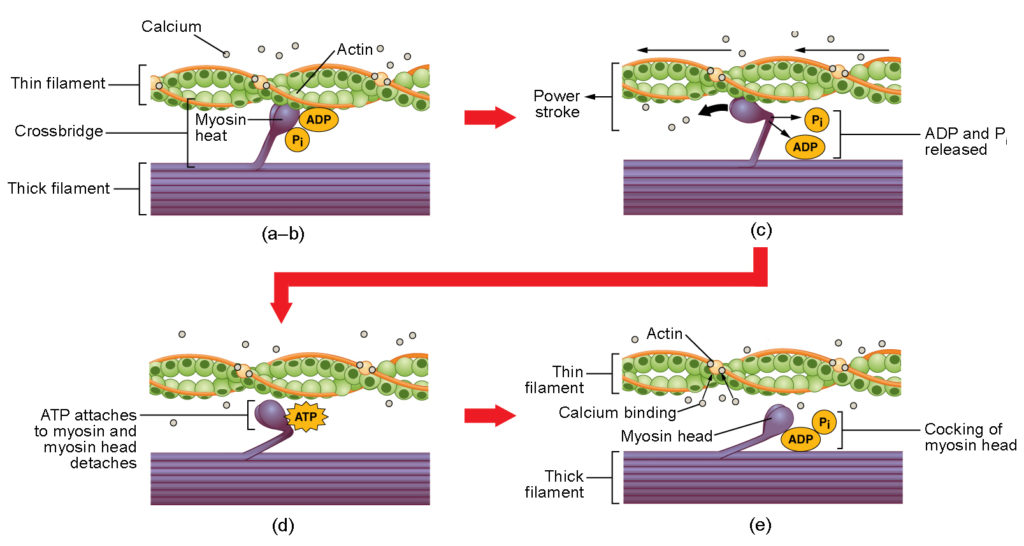
Rysunek 4. Skurcz mięśnia szkieletowego. (a) Miejsce aktywne na aktynie jest odsłonięte, gdy wapń wiąże się z troponiną. (b) Główka miozyny jest przyciągana do aktyny, a miozyna wiąże się z aktyną w miejscu wiązania aktyny, tworząc mostek poprzeczny. (c) Podczas skoku mocy uwalniany jest fosforan wytworzony w poprzednim cyklu skurczu. Powoduje to wychylenie główki miozyny w kierunku środka sarkomeru, po czym następuje uwolnienie przyłączonego ADP i grupy fosforanowej. (d) Nowa cząsteczka ATP przyłącza się do główki miozyny, powodując oderwanie mostka poprzecznego. (e) Główka miozyny hydrolizuje ATP do ADP i fosforanu, co powoduje powrót miozyny do pozycji koguciej.
Tworzenie mostka krzyżowego zachodzi, gdy główka miozyny przyłącza się do aktyny, podczas gdy adenozynodifosforan (ADP) i fosforan nieorganiczny (Pi) są nadal związane z miozyną (rysunek 4a,b). Pi jest następnie uwalniane, co powoduje, że miozyna tworzy silniejsze połączenie z aktyną, po czym główka miozyny przesuwa się w kierunku linii M, pociągając za sobą aktyny. W miarę jak aktyna jest ciągnięta, filamenty przesuwają się o około 10 nm w kierunku linii M. Ruch ten nazywany jest skokiem mocy. Ruch ten nazywany jest skokiem mocy, ponieważ na tym etapie następuje ruch cienkiego filamentu (Rysunek 4c). W przypadku braku ATP główka miozyny nie odłącza się od aktyny.
Jedna część główki miozyny przyczepia się do miejsca wiążącego na aktynie, ale główka ma inne miejsce wiążące dla ATP. Wiązanie ATP powoduje odłączenie się główki miozyny od aktyny (Rysunek 4d). Po tym wydarzeniu ATP jest przekształcany w ADP i Pi przez wewnętrzną aktywność ATPazy miozyny. Energia uwolniona podczas hydrolizy ATP powoduje zmianę kąta nachylenia główki miozyny do pozycji odwróconej (Rysunek 4e). Główka miozyny znajduje się teraz w pozycji umożliwiającej dalszy ruch.
Gdy główka miozyny jest skulona, miozyna znajduje się w konfiguracji wysokoenergetycznej. Ta energia jest zużywana, gdy głowa miozyny porusza się przez skok mocy, a na końcu skoku mocy, głowa miozyny jest w pozycji niskoenergetycznej. Po zakończeniu skoku mocy uwalniany jest ADP, jednak utworzony mostek poprzeczny pozostaje na swoim miejscu, a aktyna i miozyna są ze sobą związane. Tak długo, jak ATP jest dostępny, łatwo przyłącza się do miozyny, cykl mostków krzyżowych może się powtórzyć, a skurcz mięśnia może być kontynuowany.
Zauważ, że każde grube włókno składające się z około 300 cząsteczek miozyny ma wiele główek miozyny, a wiele mostków krzyżowych tworzy się i zrywa w sposób ciągły podczas skurczu mięśnia. Mnożąc to przez wszystkie sarkomery w jednej miofibryli, wszystkie miofibryle w jednym włóknie mięśniowym i wszystkie włókna mięśniowe w jednym mięśniu szkieletowym, można zrozumieć, dlaczego tak wiele energii (ATP) jest potrzebne do utrzymania pracy mięśni szkieletowych. W rzeczywistości, to właśnie utrata ATP powoduje rigor mortis obserwowany wkrótce po śmierci. Bez możliwości dalszej produkcji ATP, nie ma dostępnego ATP dla główek miozyny, aby odłączyć się od miejsc wiążących aktynę, więc mostki poprzeczne pozostają na miejscu, powodując sztywność mięśni szkieletowych.
Źródła ATP
ATP dostarcza energii do skurczu mięśni. Oprócz bezpośredniej roli w cyklu mostków krzyżowych, ATP dostarcza również energii dla pomp aktywnego transportu Ca++ w SR. Skurcz mięśnia nie może nastąpić bez wystarczającej ilości ATP. Ilość ATP zmagazynowanego w mięśniach jest bardzo mała, wystarczająca jedynie na kilka sekund skurczu. Ponieważ ATP ulega rozkładowi, musi być szybko regenerowany i zastępowany, aby umożliwić długotrwały skurcz. Istnieją trzy mechanizmy, za pomocą których ATP może być regenerowany: metabolizm fosforanu kreatyny, glikoliza beztlenowa, fermentacja i oddychanie tlenowe.
Fosforan kreatyny jest cząsteczką, która może przechowywać energię w swoich wiązaniach fosforanowych. W spoczynku mięśni, nadmiar ATP przenosi swoją energię do kreatyny, produkując ADP i fosforan kreatyny. Działa to jak rezerwa energii, która może być wykorzystana do szybkiego wytworzenia większej ilości ATP. Kiedy mięsień zaczyna się kurczyć i potrzebuje energii, fosforan kreatyny przenosi swój fosforan z powrotem na ADP, tworząc ATP i kreatynę. Reakcja ta jest katalizowana przez enzym kinazę kreatynową i zachodzi bardzo szybko, dzięki czemu ATP pochodzący z fosforanu kreatyny zasila pierwsze kilka sekund skurczu mięśnia. Jednak fosforan kreatyny może dostarczyć energii tylko przez około 15 sekund, po czym konieczne jest wykorzystanie innego źródła energii (Rysunek 5).

Rysunek 5. Metabolizm mięśniowy. Część ATP jest magazynowana w mięśniu w stanie spoczynku. Gdy rozpoczyna się skurcz, zostaje on zużyty w ciągu kilku sekund. Więcej ATP jest wytwarzane z fosforanu kreatyny przez około 15 sekund.
Jak ATP wytwarzany przez fosforan kreatyny zostaje wyczerpany, mięśnie zwracają się ku glikolizie jako źródłu ATP. Glikoliza jest procesem beztlenowym (nie zależnym od tlenu), który rozkłada glukozę (cukier) w celu wytworzenia ATP; jednakże glikoliza nie może wytwarzać ATP tak szybko jak fosforan kreatyny. W związku z tym przejście na glikolizę skutkuje wolniejszym tempem dostępności ATP dla mięśni. Cukier wykorzystywany w glikolizie może być dostarczany przez glukozę z krwi lub przez metabolizm glikogenu zmagazynowanego w mięśniach. W wyniku rozpadu jednej cząsteczki glukozy powstają dwa ATP i dwie cząsteczki kwasu pirogronowego, który może być wykorzystany w oddychaniu tlenowym lub, gdy poziom tlenu jest niski, przekształcony w kwas mlekowy (rysunek 6).

Rysunek 6. Glikoliza i oddychanie tlenowe. Każda cząsteczka glukozy wytwarza dwa ATP i dwie cząsteczki kwasu pirogronowego, który może być wykorzystany w oddychaniu tlenowym lub przekształcony w kwas mlekowy. Jeśli tlen nie jest dostępny, kwas pirogronowy przekształca się w kwas mlekowy, który może przyczynić się do zmęczenia mięśni. Występuje to podczas intensywnych ćwiczeń, gdy potrzebne są duże ilości energii, ale tlen nie może być wystarczająco dostarczony do mięśni.
Jeśli tlen jest dostępny, kwas pirogronowy jest używany w oddychaniu tlenowym. Jednakże, jeśli tlen nie jest dostępny, kwas pirogronowy jest przekształcany w kwas mlekowy, który może przyczynić się do zmęczenia mięśni. Przemiana ta umożliwia recykling enzymu NAD+ z NADH, który jest niezbędny do kontynuowania glikolizy. Dzieje się tak podczas intensywnych ćwiczeń, kiedy potrzebne są duże ilości energii, ale tlen nie może być wystarczająco dostarczony do mięśni. Sama glikoliza nie może być utrzymywana przez bardzo długi czas (około 1 minuty aktywności mięśni), ale jest przydatna w ułatwianiu krótkich zrywów o wysokiej intensywności. To dlatego, że glikoliza nie wykorzystuje glukozy bardzo skutecznie, produkując zysk netto z dwóch ATP na cząsteczkę glukozy, a produkt końcowy kwasu mlekowego, który może przyczynić się do zmęczenia mięśni, jak gromadzi.
Oddychanie tlenowe jest rozkład glukozy lub innych składników odżywczych w obecności tlenu (O2) do produkcji dwutlenku węgla, wody i ATP. Około 95 procent ATP wymaganego dla spoczynku lub umiarkowanie aktywnych mięśni jest dostarczane przez oddychanie tlenowe, które odbywa się w mitochondriach. Materiałami wejściowymi do oddychania tlenowego są glukoza krążąca w krwiobiegu, kwas pirogronowy i kwasy tłuszczowe. Oddychanie tlenowe jest o wiele bardziej wydajne niż beztlenowa glikoliza, ponieważ wytwarza około 36 ATP na cząsteczkę glukozy w porównaniu z czterema w przypadku glikolizy. Jednak oddychanie tlenowe nie może być podtrzymywane bez stałego dopływu O2 do mięśni szkieletowych i jest znacznie wolniejsze (rys. 7). Aby to skompensować, mięśnie magazynują niewielką ilość nadmiaru tlenu w białkach zwanych mioglobiną, co pozwala na bardziej wydajne skurcze mięśni i mniejsze zmęczenie. Trening aerobowy zwiększa również wydajność układu krążenia, dzięki czemu O2 może być dostarczany do mięśni przez dłuższe okresy czasu.

Rysunek 7. Oddychanie komórkowe. Oddychanie tlenowe to rozkład glukozy w obecności tlenu (O2) w celu wytworzenia dwutlenku węgla, wody i ATP. Około 95 procent ATP wymagane dla spoczynku lub umiarkowanie aktywnych mięśni jest dostarczany przez oddychanie tlenowe, które odbywa się w mitochondria.
Zmęczenie mięśni występuje, gdy mięsień nie może już skurcz w odpowiedzi na sygnały z układu nerwowego. Dokładne przyczyny zmęczenia mięśni nie są w pełni znane, chociaż pewne czynniki zostały skorelowane ze zmniejszonym skurczu mięśni, który występuje podczas zmęczenia. ATP jest potrzebne do normalnego skurczu mięśni, a ponieważ rezerwy ATP są zmniejszone, funkcja mięśni może się pogorszyć. Może to być bardziej istotne w przypadku krótkotrwałych, intensywnych wysiłków mięśniowych niż długotrwałych wysiłków o niższej intensywności. Nagromadzenie kwasu mlekowego może obniżyć wewnątrzkomórkowe pH, wpływając na aktywność enzymów i białek. Brak równowagi w poziomach Na+ i K+ w wyniku depolaryzacji błony może zakłócić przepływ Ca++ z SR. Długie okresy długotrwałego wysiłku fizycznego mogą uszkodzić SR i sarkolemmę, powodując upośledzenie regulacji Ca++.
Intensywna aktywność mięśniowa powoduje powstanie długu tlenowego, który jest ilością tlenu potrzebną do skompensowania ATP wytwarzanego bez udziału tlenu podczas skurczu mięśnia. Tlen jest potrzebny do przywrócenia poziomu ATP i fosforanu kreatyny, przekształcenia kwasu mlekowego w kwas pirogronowy, a w wątrobie do przekształcenia kwasu mlekowego w glukozę lub glikogen. Inne systemy wykorzystywane podczas ćwiczeń również wymagają tlenu, a wszystkie te połączone procesy powodują zwiększoną częstotliwość oddychania, która występuje po ćwiczeniach. Dopóki dług tlenowy nie zostanie zaspokojony, pobór tlenu jest podwyższony, nawet po zaprzestaniu ćwiczeń.
Relaksacja mięśnia szkieletowego
Relaksacja włókien mięśni szkieletowych, a ostatecznie mięśni szkieletowych, rozpoczyna się od neuronu ruchowego, który przestaje uwalniać swój sygnał chemiczny, ACh, do synapsy w NMJ. Włókno mięśniowe ulega repolaryzacji, co powoduje zamknięcie bramek w SR, przez które uwalniany był Ca++. Pompy napędzane ATP przemieszczają Ca++ z sarkoplazmy z powrotem do SR. Powoduje to „ponowne osłonięcie” miejsc wiążących aktynę na cienkich filamentach. Bez zdolności do tworzenia mostków krzyżowych między cienkimi i grubymi filamentami, włókno mięśniowe traci napięcie i rozluźnia się.
Siła mięśni
Liczba włókien mięśni szkieletowych w danym mięśniu jest uwarunkowana genetycznie i nie ulega zmianie. Siła mięśni jest bezpośrednio związana z ilością miofibryli i sarkomerów w każdym włóknie. Czynniki, takie jak hormony i stres (oraz sztuczne sterydy anaboliczne), działające na mięsień mogą zwiększyć produkcję sarkomerów i miofibryli w obrębie włókien mięśniowych, zmiana ta nazywana jest hipertrofią, co skutkuje zwiększeniem masy i objętości mięśnia szkieletowego. Podobnie, zmniejszone wykorzystanie mięśnia szkieletowego powoduje atrofię, w której zanika liczba sarkomerów i miofibryli (ale nie liczba włókien mięśniowych). Powszechne jest, że kończyna w gipsie wykazuje zanik mięśni po usunięciu gipsu, a niektóre choroby, takie jak polio, wykazują zanik mięśni.
Zaburzenia układu mięśniowego
Dystrofia mięśniowa Duchenne’a (DMD) jest postępującym osłabieniem mięśni szkieletowych. Jest to jedna z kilku chorób określanych zbiorczo jako „dystrofia mięśniowa”. DMD jest spowodowana brakiem białka dystrofiny, która pomaga cienkim włóknom miofibryli związać się z sarkolemmą. Bez wystarczającej ilości dystrofiny, skurcze mięśni powodują rozerwanie sarkolemy, co powoduje napływ Ca++, prowadząc do uszkodzenia komórek i degradacji włókien mięśniowych. Z czasem, gdy uszkodzenia mięśni się kumulują, następuje utrata masy mięśniowej i rozwijają się większe upośledzenia funkcjonalne.
DMD jest zaburzeniem dziedzicznym, spowodowanym przez nieprawidłowy chromosom X. Dotyka ono głównie mężczyzn i jest zwykle diagnozowane we wczesnym dzieciństwie. DMD zwykle najpierw pojawia się jako trudności z równowagą i ruchem, a następnie postępuje do niezdolności do chodzenia. Postępuje dalej w górę ciała od kończyn dolnych do górnych, gdzie wpływa na mięśnie odpowiedzialne za oddychanie i krążenie. Ostatecznie powoduje śmierć z powodu niewydolności oddechowej, a osoby dotknięte tą chorobą zazwyczaj nie żyją dłużej niż 20 lat.
Ponieważ DMD jest spowodowana mutacją w genie kodującym dystrofinę, uznano, że wprowadzenie zdrowych mioblastów do pacjentów może być skutecznym sposobem leczenia. Mioblasty są komórkami embrionalnymi odpowiedzialnymi za rozwój mięśni i w idealnej sytuacji byłyby nosicielami zdrowych genów, które mogłyby produkować dystrofinę potrzebną do prawidłowego skurczu mięśni. Podejście to okazało się w dużej mierze nieskuteczne u ludzi. Najnowsze podejście polega na próbie zwiększenia produkcji utrofiny w mięśniach, białka podobnego do dystrofiny, które może być w stanie przejąć rolę dystrofiny i zapobiec uszkodzeniu komórek.
Pytania sprawdzające
Przystąp do poniższego quizu, aby sprawdzić swoje rozumienie pojęcia „skurcz i rozkurcz włókien mięśniowych”
.
