A: AMINO ACIDS
BIOCHEMISTRY – DR. JAKUBOWSKI
Last Update: 02/27/16
Learning Goals/Objectives for Chapter 2A: Po zajęciach i tej lekturze studenci będą w stanie
- stwierdzić ładunek na łańcuchach bocznych aminokwasów za pomocą równania Hendersona Hasselbacha i przybliżonego ładunku przez inspekcję w każdym danym pH
- rysować mechanizmy i identyfikować produkty dla reakcji nukleofilowych łańcuchów bocznych Lys i Cys z powszechnymi chemicznymi czynnikami modyfikującymi i rozszerzyć to zrozumienie na reakcje His.
- narysować mechanizmy dla reakcji wymiany disulfidów dla sulfhydryli używając ich i liczb utleniania do wyjaśnienia reakcji redoks cysteiny/cystyny.
A7. Chemia cystyny
Dwa łańcuchy boczne cysteiny mogą kowalencyjnie oddziaływać w białku w celu wytworzenia disulfidu. Tak jak HOOH (nadtlenek wodoru) jest bardziej utleniony niż HOH (O w H2O2 ma liczbę utlenienia 1-, podczas gdy O w H2O ma liczbę utlenienia 2-), RSSR jest formą utlenioną (S liczba utlenienia 1-), a RSH jest formą zredukowaną (S liczba utlenienia 2-) tioli. Tam liczby utlenienia są analogiczne, ponieważ O i S są w grupie 6 układu okresowego i oba są bardziej elektroujemne niż C.
Szybki przegląd reakcji redoks i liczb utlenienia.
Figura: DISULFID – CYSTYNA – REAKCJE
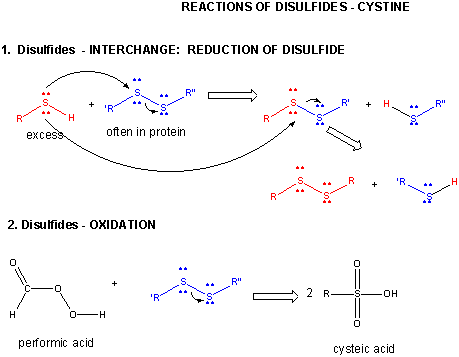
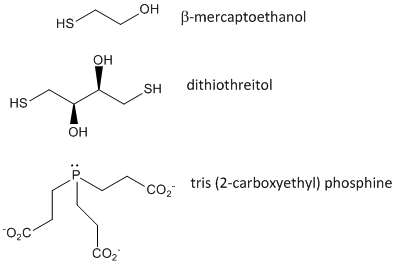
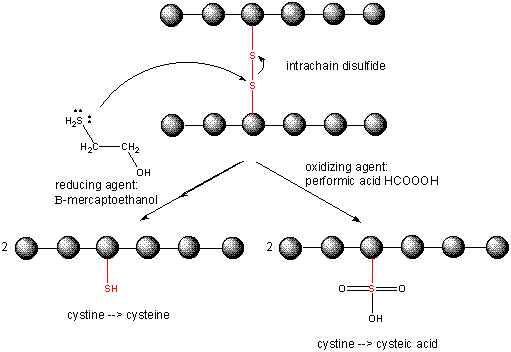
Gdy białko się fałduje, dwa łańcuchy boczne Cys mogą zbliżyć się do siebie i utworzyć wewnątrzłańcuchowe wiązanie disulfidowe. Podobnie, dwa łańcuchy boczne Cys na oddzielnych białkach mogą zbliżyć się do siebie i utworzyć disulfid międzyłańcuchowy. Takie disulfidy muszą zostać rozszczepione, a łańcuchy rozdzielone przed analizą sekwencji białka. Dwusiarczek w białku może być rozszczepiony przez czynniki redukujące, takie jak beta-merkaptoetanol, ditiothreitol, tris (2-karboksyetyl) fosfina (TCEP) lub czynniki utleniające, które dalej utleniają dwusiarczek do oddzielenia kwasów cysteinowych.
Figura: Czynniki utleniające disulfidy – b-merkaptoetanol, ditiothreitol i fosfiny
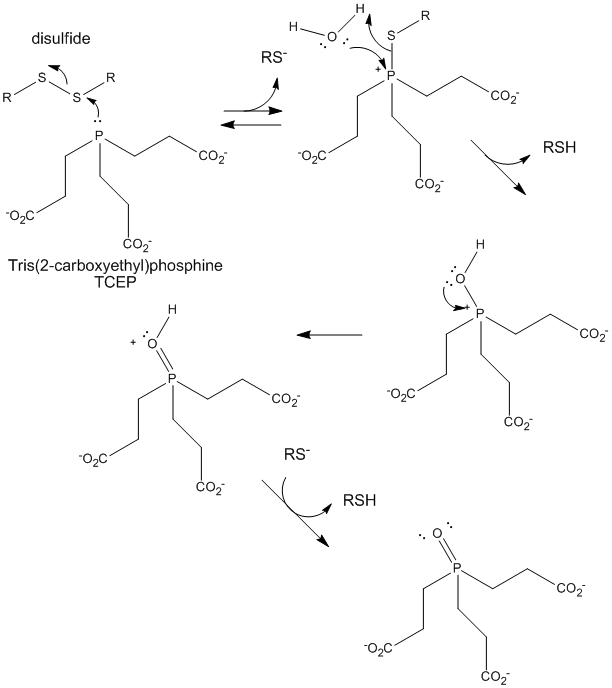
Rysunek: TCEP redukcja disulfidów
Wnętrze komórek jest utrzymywane w środowisku zredukowanym dzięki obecności wielu czynników „redukujących”, takich jak tripeptyd g-glu-cys-gly (glutation). Stąd wewnątrzkomórkowe białka zazwyczaj nie zawierają disulfidów, które są obfite w białkach zewnątrzkomórkowych (takich jak te znajdujące się we krwi) lub w niektórych organellach, takich jak retikulum endoplazmatyczne i mitochondrialnej przestrzeni międzybłonowej, gdzie disulfidesc może być introduced.
Figura:
Cleaving Disulfide Bonds in Proteins
Cysteine Redox Chemistry
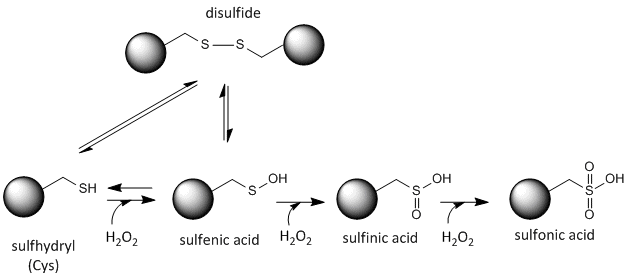
Siarka w cysteinie jest redoks-aktywna i stąd może istnieć w szerokiej gamie stanów, w zależności od lokalnego środowiska redoks i obecności czynników utleniających i redukujących. Silnym utleniaczem, który może być wytwarzany w komórkach jest nadtlenek wodoru, który może prowadzić do bardziej drastycznych i nieodwracalnych modyfikacji chemicznych łańcuchów bocznych Cys. Jeśli reaktywny Cys jest ważny dla funkcji białka, to funkcja białka może być modulowana (czasami odwracalnie, czasami nieodwracalnie) za pomocą różnych czynników utleniających, jak pokazano na rysunku poniżej.
Rycina:Stan redoks cysteiny
Nawigacja
Powrót doRozdziału 2A: Sekcje aminokwasów
Powrót doBiochemii Online Spis Treści
Zarchiwizowana wersja pełnegoRozdziału 2A: Aminokwasy
.
