CEle kształcenia
- Opisać energie wiązań kowalencyjnych i jonowych tworzenia i rozpadu
- Użyj średnich energii wiązań kowalencyjnych do oszacowania entalpii reakcji
Siła wiązania opisuje jak mocno każdy atom jest połączony z innym atomem, i dlatego ile energii jest wymagane do przerwania wiązania między dwoma atomami.
Należy pamiętać, że do zerwania wiązań chemicznych musi być dodana energia (proces endotermiczny), natomiast tworzenie wiązań chemicznych uwalnia energię (proces egzotermiczny). W przypadku ![]() , wiązanie kowalencyjne jest bardzo silne; duża ilość energii, 436 kJ, musi zostać dodana, aby rozerwać wiązania w jednym molu cząsteczek wodoru i spowodować rozdzielenie atomów:
, wiązanie kowalencyjne jest bardzo silne; duża ilość energii, 436 kJ, musi zostać dodana, aby rozerwać wiązania w jednym molu cząsteczek wodoru i spowodować rozdzielenie atomów:
![]()
Odwrotnie, taka sama ilość energii jest uwalniana, gdy jeden mol ![]() cząsteczek tworzy się z dwóch moli atomów H:
cząsteczek tworzy się z dwóch moli atomów H:
![]()
Wytrzymałość wiązań: Wiązania kowalencyjne
Stabilne cząsteczki istnieją, ponieważ wiązania kowalencyjne utrzymują atomy razem. Miarą siły wiązania kowalencyjnego jest energia potrzebna do jego zerwania, czyli energia potrzebna do rozdzielenia połączonych atomów. Rozdzielenie jakiejkolwiek pary połączonych atomów wymaga energii. Im silniejsze wiązanie, tym większa energia wymagana do jego zerwania.
Energia wymagana do zerwania określonego wiązania kowalencyjnego w jednym molu cząsteczek gazu nazywana jest energią wiązania lub energią dysocjacji wiązania. Energia wiązania dla cząsteczki dwuatomowej, ![]() , definiuje się jako standardową zmianę entalpii dla reakcji endotermicznej:
, definiuje się jako standardową zmianę entalpii dla reakcji endotermicznej:
![]()
Na przykład, energia wiązania czystego kowalencyjnego wiązania H-H, ![]() , wynosi 436 kJ na mol rozerwanego wiązania H-H:
, wynosi 436 kJ na mol rozerwanego wiązania H-H:
![]()
Cząsteczki z trzema lub więcej atomami mają dwa lub więcej wiązań. Suma wszystkich energii wiązań w takiej cząsteczce jest równa standardowej zmianie entalpii dla reakcji endotermicznej, która rozrywa wszystkie wiązania w cząsteczce. Na przykład, suma energii czterech wiązań C-H w ![]() , 1660 kJ, jest równa standardowej zmianie entalpii reakcji:
, 1660 kJ, jest równa standardowej zmianie entalpii reakcji:

Średnia energia wiązania C-H, ![]() , wynosi 1660/4 = 415 kJ/mol, ponieważ na mol reakcji przypadają cztery mole zerwanych wiązań C-H. Chociaż cztery wiązania C-H są równoważne w oryginalnej cząsteczce, nie wymagają one takiej samej energii do zerwania; po zerwaniu pierwszego wiązania (co wymaga 439 kJ/mol), pozostałe wiązania są łatwiejsze do zerwania. Wartość 415 kJ/mol jest średnia, a nie dokładna wartość wymagana do złamania każdego jednego bond.
, wynosi 1660/4 = 415 kJ/mol, ponieważ na mol reakcji przypadają cztery mole zerwanych wiązań C-H. Chociaż cztery wiązania C-H są równoważne w oryginalnej cząsteczce, nie wymagają one takiej samej energii do zerwania; po zerwaniu pierwszego wiązania (co wymaga 439 kJ/mol), pozostałe wiązania są łatwiejsze do zerwania. Wartość 415 kJ/mol jest średnia, a nie dokładna wartość wymagana do złamania każdego jednego bond.
Siła wiązania między dwoma atomami wzrasta wraz ze wzrostem liczby par elektronów w wiązaniu. Ogólnie rzecz biorąc, jak siła wiązania wzrasta, długość wiązania maleje. Tak więc, widzimy, że wiązania potrójne są silniejsze i krótsze niż wiązania podwójne pomiędzy tymi samymi dwoma atomami; podobnie, wiązania podwójne są silniejsze i krótsze niż wiązania pojedyncze pomiędzy tymi samymi dwoma atomami. Średnie energie wiązań dla niektórych popularnych wiązań znajdują się w tabeli poniżej, a porównanie długości wiązań i siły wiązań dla niektórych popularnych wiązań znajduje się w poniższej tabeli. Kiedy jeden atom wiąże się z różnymi atomami w grupie, siła wiązania zazwyczaj maleje, gdy poruszamy się w dół grupy. Na przykład, ![]() wynosi 439 kJ/mol,
wynosi 439 kJ/mol, ![]() wynosi 330 kJ/mol, a
wynosi 330 kJ/mol, a ![]() wynosi 275 kJ/mol.
wynosi 275 kJ/mol.
| Energie wiązań (kJ/mol) | |||||||
|---|---|---|---|---|---|---|---|
| Wiązania | Energie wiązań | Wiązanie | Energia wiązania | Wiązanie | Energia wiązania | ||
| 436 | 260 | 255 | |||||
| 415 | 330 | 235 | |||||
| 390 | 275 | 230 | |||||
| 464 | 240 | 215 | |||||
| 569 | 160 | 225 | |||||
| 395 | 418 | 359 | |||||
| 320 | 946 | 290 | |||||
| 340 | 200 | 215 | |||||
| 432 | 270 | 215 | |||||
| 370 | 210 | 230 | |||||
| 295 | 200 | 330 | |||||
| 345 | 245 | 270 | |||||
| 611 | 140 | 215 | |||||
| 837 | 498 | 215 | |||||
| 290 | 160 | 250 | |||||
| 615 | 370 | 215 | |||||
| 891 | 350 | 243 | |||||
| 350 | 205 | 220 | |||||
| 741 | 200 | 210 | |||||
| 1080 | 160 | 190 | |||||
| 439 | 540 | 180 | |||||
| 360 | 489 | 150 | |||||
| 265 | 285 | ||||||
| Średnie długości wiązań i energie wiązań dla niektórych Common Bonds | ||
|---|---|---|
| Wiązanie | Długość wiązania (Å) | Energia wiązania (kJ/mol) |
| 1,54 | 345 | |
| 1.34 | 611 | |
| 1,20 | 837 | |
| 1,43 | 290 | |
| 1,38 | 615 | |
| 1,16 | 891 | |
| 1,43 | 350 | |
| 1.23 | 741 | |
| 1,13 | 1080 | |
Energia wiązania jest różnicą między minimum energetycznym (które występuje w odległości wiązania) a energią dwóch rozdzielonych atomów. Jest to ilość energii uwolnionej podczas tworzenia wiązania. I odwrotnie, taka sama ilość energii jest potrzebna do zerwania wiązania. Dla cząsteczki ![]() pokazanej w powyższej tabeli, przy odległości wiązania 74 pm energia układu jest o 7,24 × 10-19 J niższa niż energia dwóch rozdzielonych atomów wodoru. Może się wydawać, że jest to niewielka liczba. Jednak, jak dowiemy się bardziej szczegółowo później, energie wiązań są często omawiane w oparciu o per-mol. Na przykład, aby rozerwać jedno wiązanie H-H potrzeba 7,24 × 10-19 J, ale aby rozerwać 1 mol wiązań H-H potrzeba 4,36 × 105 J. Porównanie niektórych długości wiązań i energii pokazane jest w tabelach powyżej. Wiele z tych wiązań możemy znaleźć w różnych cząsteczkach, a w tabeli podano wartości średnie. Na przykład, zerwanie pierwszego wiązania C-H w
pokazanej w powyższej tabeli, przy odległości wiązania 74 pm energia układu jest o 7,24 × 10-19 J niższa niż energia dwóch rozdzielonych atomów wodoru. Może się wydawać, że jest to niewielka liczba. Jednak, jak dowiemy się bardziej szczegółowo później, energie wiązań są często omawiane w oparciu o per-mol. Na przykład, aby rozerwać jedno wiązanie H-H potrzeba 7,24 × 10-19 J, ale aby rozerwać 1 mol wiązań H-H potrzeba 4,36 × 105 J. Porównanie niektórych długości wiązań i energii pokazane jest w tabelach powyżej. Wiele z tych wiązań możemy znaleźć w różnych cząsteczkach, a w tabeli podano wartości średnie. Na przykład, zerwanie pierwszego wiązania C-H w ![]() wymaga 439.3 kJ/mol, podczas gdy zerwanie pierwszego wiązania C-H w
wymaga 439.3 kJ/mol, podczas gdy zerwanie pierwszego wiązania C-H w ![]() (popularny rozcieńczalnik do farb) wymaga 375.5 kJ/mol.
(popularny rozcieńczalnik do farb) wymaga 375.5 kJ/mol.
Jak widać w powyższych tabelach, przeciętne wiązanie pojedyncze węgiel-węgiel wynosi 347 kJ/mol, natomiast w wiązaniu podwójnym węgiel-węgiel, wiązanie ![]() zwiększa siłę wiązania o 267 kJ/mol. Dodanie dodatkowego wiązania
zwiększa siłę wiązania o 267 kJ/mol. Dodanie dodatkowego wiązania ![]() powoduje dalszy wzrost siły wiązania o 225 kJ/mol. Podobną prawidłowość możemy zaobserwować, gdy porównamy inne wiązania \sigma i
powoduje dalszy wzrost siły wiązania o 225 kJ/mol. Podobną prawidłowość możemy zaobserwować, gdy porównamy inne wiązania \sigma i ![]() . Tak więc, każde pojedyncze wiązanie
. Tak więc, każde pojedyncze wiązanie ![]() jest na ogół słabsze niż odpowiadające mu wiązanie \i03900> pomiędzy tymi samymi dwoma atomami. W
jest na ogół słabsze niż odpowiadające mu wiązanie \i03900> pomiędzy tymi samymi dwoma atomami. W ![]() wiązania, istnieje większy stopień nakładania się orbitali niż w
wiązania, istnieje większy stopień nakładania się orbitali niż w ![]() wiązania.
wiązania.
Możemy użyć energii wiązań do obliczenia przybliżonych zmian entalpii dla reakcji, gdzie entalpie tworzenia nie są dostępne. Obliczenia tego typu powiedzą nam również, czy reakcja jest egzotermiczna czy endotermiczna. Reakcja egzotermiczna (ΔH ujemne, wytworzone ciepło) zachodzi, gdy wiązania w produktach są silniejsze niż wiązania w reagentach. Reakcja endotermiczna (ΔH dodatnia, ciepło pochłonięte) zachodzi, gdy wiązania w produktach są słabsze niż w reaktorach.
Zmiana entalpii, ΔH, dla reakcji chemicznej jest w przybliżeniu równa sumie energii wymaganej do zerwania wszystkich wiązań w reaktorach (energia „wejścia”, znak dodatni) plus energia uwolniona, gdy wszystkie wiązania są utworzone w produktach (energia „wyjścia”, znak ujemny). Można to wyrazić matematycznie w następujący sposób:
![]()
W tym wyrażeniu symbol ![]() oznacza „sumę”, a D oznacza energię wiązania w kilodżulach na mol, która jest zawsze liczbą dodatnią. Energię wiązania uzyskuje się z tabeli i zależy ona od tego, czy dane wiązanie jest wiązaniem pojedynczym, podwójnym czy potrójnym. Tak więc, przy obliczaniu entalpii w ten sposób, ważne jest, abyśmy wzięli pod uwagę wiązania we wszystkich reaktorach i produktach. Ponieważ wartości D są zazwyczaj średnimi dla jednego typu wiązania w wielu różnych cząsteczkach, to obliczenie dostarcza przybliżonego oszacowania, a nie dokładnej wartości, dla entalpii reakcji.
oznacza „sumę”, a D oznacza energię wiązania w kilodżulach na mol, która jest zawsze liczbą dodatnią. Energię wiązania uzyskuje się z tabeli i zależy ona od tego, czy dane wiązanie jest wiązaniem pojedynczym, podwójnym czy potrójnym. Tak więc, przy obliczaniu entalpii w ten sposób, ważne jest, abyśmy wzięli pod uwagę wiązania we wszystkich reaktorach i produktach. Ponieważ wartości D są zazwyczaj średnimi dla jednego typu wiązania w wielu różnych cząsteczkach, to obliczenie dostarcza przybliżonego oszacowania, a nie dokładnej wartości, dla entalpii reakcji.
Rozważmy następującą reakcję:
![]()
lub
![]()
Aby utworzyć dwa mole ![]() , musi zostać zerwany jeden mol wiązań H-H i jeden mol wiązań Cl-Cl. Energia potrzebna do rozerwania tych wiązań jest sumą energii wiązania H-H (436 kJ/mol) i wiązania Cl-Cl (243 kJ/mol). Podczas reakcji tworzą się dwa mole wiązań H-Cl (energia wiązania = 432 kJ/mol), uwalniając 2 × 432 kJ, czyli 864 kJ. Ponieważ wiązania w produktach są silniejsze niż te w reaktorach, reakcja uwalnia więcej energii niż zużywa:
, musi zostać zerwany jeden mol wiązań H-H i jeden mol wiązań Cl-Cl. Energia potrzebna do rozerwania tych wiązań jest sumą energii wiązania H-H (436 kJ/mol) i wiązania Cl-Cl (243 kJ/mol). Podczas reakcji tworzą się dwa mole wiązań H-Cl (energia wiązania = 432 kJ/mol), uwalniając 2 × 432 kJ, czyli 864 kJ. Ponieważ wiązania w produktach są silniejsze niż te w reaktorach, reakcja uwalnia więcej energii niż zużywa:
Ta nadwyżka energii jest uwalniana w postaci ciepła, więc reakcja jest egzotermiczna. W dodatku G podano wartość standardowej molowej entalpii tworzenia ![]() ,
, ![]() , wynoszącą -92,307 kJ/mol. Dwukrotność tej wartości wynosi -184,6 kJ, co zgadza się dobrze z odpowiedzią uzyskaną wcześniej dla tworzenia się dwóch moli HCl.
, wynoszącą -92,307 kJ/mol. Dwukrotność tej wartości wynosi -184,6 kJ, co zgadza się dobrze z odpowiedzią uzyskaną wcześniej dla tworzenia się dwóch moli HCl.
EXAMPLE
Using Bond Energies to Calculate Approximate Enthalpy Changes
Metanol, ![]() , może być doskonałym paliwem alternatywnym. W wyniku wysokotemperaturowej reakcji pary wodnej i węgla powstaje mieszanina gazów: tlenku węgla, i wodoru, , i wodoru,
, może być doskonałym paliwem alternatywnym. W wyniku wysokotemperaturowej reakcji pary wodnej i węgla powstaje mieszanina gazów: tlenku węgla, i wodoru, , i wodoru, ![]() , z której można wytworzyć metanol. Korzystając z energii wiązań podanych w powyższych tabelach, oblicz przybliżoną zmianę entalpii, ΔH, dla zachodzącej tu reakcji:
, z której można wytworzyć metanol. Korzystając z energii wiązań podanych w powyższych tabelach, oblicz przybliżoną zmianę entalpii, ΔH, dla zachodzącej tu reakcji:
![]()
Rozwiązanie
Najpierw musimy napisać struktury Lewisa reaktantów i produktów:

Z tego wynika, że ΔH dla tej reakcji obejmuje energię potrzebną do zerwania potrójnego wiązania C-O i dwóch pojedynczych wiązań H-H, jak również energię wytworzoną przez utworzenie trzech pojedynczych wiązań C-H, pojedynczego wiązania C-O i pojedynczego wiązania O-H. Możemy to wyrazić w następujący sposób:
Stosując wartości energii wiązań z tabeli, otrzymujemy:
Możemy porównać tę wartość z wartością obliczoną na podstawie ![]() danych z Dodatku G:
danych z Dodatku G:
Zauważ, że istnieje dość znaczna różnica między wartościami obliczonymi za pomocą dwóch różnych metod. Dzieje się tak, ponieważ wartości D są średnią różnych sił wiązań; dlatego często dają tylko przybliżoną zgodność z innymi danymi.
Check Your Learning
Alkohol etylowy, ![]() , był jednym z pierwszych organicznych związków chemicznych celowo syntetyzowanych przez człowieka. Ma wiele zastosowań w przemyśle i jest alkoholem zawartym w napojach alkoholowych. Może być otrzymywany w wyniku fermentacji cukru lub syntetyzowany przez uwodnienie etylenu w następującej reakcji:
, był jednym z pierwszych organicznych związków chemicznych celowo syntetyzowanych przez człowieka. Ma wiele zastosowań w przemyśle i jest alkoholem zawartym w napojach alkoholowych. Może być otrzymywany w wyniku fermentacji cukru lub syntetyzowany przez uwodnienie etylenu w następującej reakcji:

Korzystając z energii wiązań w tabeli, oblicz przybliżoną zmianę entalpii, ΔH, dla tej reakcji.
-35 kJ
Siła wiązań jonowych i energia sieci
Związek jonowy jest stabilny dzięki elektrostatycznemu przyciąganiu pomiędzy jonami dodatnimi i ujemnymi. Energia sieciowa związku jest miarą siły tego przyciągania. Energia sieciowa (ΔHlattice) związku jonowego jest definiowana jako energia wymagana do rozdzielenia jednego mola ciała stałego na jego składowe jony gazowe. Dla ciała stałego jonowego MX, energia sieciowa jest zmianą entalpii procesu:
![]()
Zauważ, że używamy konwencji, w której ciało stałe jonowe jest rozdzielane na jony, więc nasze energie sieciowe będą endotermiczne (wartości dodatnie). Niektóre teksty używają równoważnej, ale przeciwnej konwencji, definiując energię sieci jako energię uwolnioną, gdy oddzielne jony łączą się w sieć i podając wartości ujemne (egzotermiczne). Tak więc, jeśli szukasz energii sieci w innym źródle, upewnij się, która definicja jest używana. W obu przypadkach, większa wartość dla energii sieci wskazuje na bardziej stabilny związek jonowy. Dla chlorku sodu, ![]() . Zatem potrzeba 769 kJ, aby rozdzielić jeden mol ciała stałego
. Zatem potrzeba 769 kJ, aby rozdzielić jeden mol ciała stałego ![]() na gazowe jony \tekst{Na}^+ i jony \tekst{Cl}^- . Gdy po jednym molu gazowych jonów \Na}^+ i \Na}^- tworzą ciało stałe
na gazowe jony \tekst{Na}^+ i jony \tekst{Cl}^- . Gdy po jednym molu gazowych jonów \Na}^+ i \Na}^- tworzą ciało stałe ![]() , wydziela się 769 kJ ciepła.
, wydziela się 769 kJ ciepła.
Energia sieci ![]() kryształu jonowego może być wyrażona następującym równaniem (wyprowadzonym z prawa Coulomba, rządzącego siłami między ładunkami elektrycznymi):
kryształu jonowego może być wyrażona następującym równaniem (wyprowadzonym z prawa Coulomba, rządzącego siłami między ładunkami elektrycznymi):
![]()
w którym C jest stałą zależną od rodzaju struktury kryształu; Z+ i Z- to ładunki na jonach; a Ro to odległość międzyjonowa (suma promieni jonów dodatnich i ujemnych). Tak więc energia sieciowa kryształu jonowego wzrasta gwałtownie wraz ze wzrostem ładunków jonów i zmniejszeniem ich rozmiarów. Gdy wszystkie inne parametry są stałe, podwojenie ładunku kationu i anionu powoduje czterokrotne zwiększenie energii sieci. Na przykład, energia sieci ![]() (Z+ i Z- = 1) wynosi 1023 kJ/mol, podczas gdy energia
(Z+ i Z- = 1) wynosi 1023 kJ/mol, podczas gdy energia ![]() (Z+ i Z- = 2) wynosi 3900 kJ/mol (Ro jest prawie taka sama-około 200 pm dla obu związków).
(Z+ i Z- = 2) wynosi 3900 kJ/mol (Ro jest prawie taka sama-około 200 pm dla obu związków).
Różne odległości międzyatomowe wytwarzają różne energie sieciowe. Na przykład, możemy porównać energię sieci ![]() (2957 kJ/mol) do
(2957 kJ/mol) do ![]() (2327 kJ/mol), aby zaobserwować wpływ na energię sieci mniejszego rozmiaru jonowego F- w porównaniu do I-.
(2327 kJ/mol), aby zaobserwować wpływ na energię sieci mniejszego rozmiaru jonowego F- w porównaniu do I-.
PRZYKŁAD
Porównania energii sieciowej
Drogocenny klejnot rubin jest tlenkiem glinu, ![]() , zawierającym śladowe ilości
, zawierającym śladowe ilości ![]() . Związek
. Związek ![]() jest stosowany w produkcji niektórych przyrządów półprzewodnikowych. Który ma większą energię sieciową,
jest stosowany w produkcji niektórych przyrządów półprzewodnikowych. Który ma większą energię sieciową, ![]() czy
czy ![]() ?
?
Rozwiązanie
W tych dwóch związkach jonowych ładunki Z+ i Z- są takie same, więc różnica w energii sieciowej będzie zależała od Ro. Jon ![]() jest mniejszy od jonu
jest mniejszy od jonu ![]() jonu. Zatem
jonu. Zatem ![]() miałby krótszą odległość międzyjonową niż
miałby krótszą odległość międzyjonową niż ![]() , a
, a ![]() miałby większą energię sieciową.
miałby większą energię sieciową.
Check Your Learning
Tlenek cynku, \tekst{ZnO} , jest bardzo skutecznym filtrem przeciwsłonecznym. W jaki sposób energia sieci \tekst{ZnO} byłaby porównywalna z energią sieci \tekst{ZnO} w porównaniu z energią ![]() ?
?
\\NZnO} miałby większą energię sieciową, ponieważ wartości Z zarówno kationu, jak i anionu w ertekście{ZnO} są większe, a odległość międzyjonowa \tekst{ZnO} jest mniejsza niż w przypadku
KEY TAKEAWAYS
Siłę wiązania kowalencyjnego mierzy się jego energią dysocjacji wiązania, czyli ilością energii potrzebnej do rozerwania tego konkretnego wiązania w molu cząsteczek. Wiązania wielokrotne są silniejsze niż wiązania pojedyncze pomiędzy tymi samymi atomami. Entalpia reakcji może być oszacowana na podstawie energii wymaganej do rozerwania wiązań oraz energii uwolnionej podczas tworzenia nowych wiązań. W przypadku wiązań jonowych, energia sieci jest energią wymaganą do rozdzielenia jednego mola związku na jego jony w fazie gazowej. Energia sieciowa wzrasta dla jonów o większych ładunkach i mniejszych odległościach między jonami.
- Energia wiązania dla cząsteczki dwuatomowej:
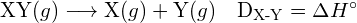
- Zmiana entalpii:

- Energia sieciowa dla ciała stałego MX:
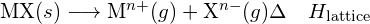
- Energia sieci dla kryształu jonowego:
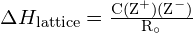
KONIEC ROZDZIAŁU ĆWICZENIA
- Które wiązanie w każdej z poniższych par wiązań jest najsilniejsze? (a)
 lub
lub 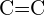 (b)
(b) 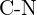 lub
lub 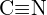 (c)
(c) 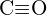 lub
lub 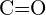 (d)
(d) 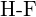 lub
lub 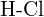 (e)
(e) 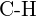 lub
lub 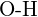 (f)
(f) 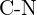 lub
lub 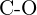
- Korzystając z energii wiązań w tabeli, określ przybliżoną zmianę entalpii dla każdej z poniższych reakcji: (a)
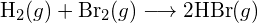 b)
b) 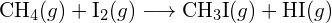 (c)
(c) 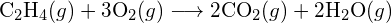 (a) -114 kJ; (b) 30 kJ; (c) -1055 kJ
(a) -114 kJ; (b) 30 kJ; (c) -1055 kJ - Korzystając z energii wiązań w tabeli, określ przybliżoną zmianę entalpii dla każdej z poniższych reakcji: (a)
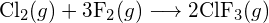 (b)
(b) 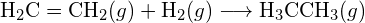 (c)
(c) 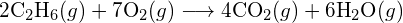
- Narysuj krzywą opisującą energię układu, w którym atomy H i Cl znajdują się w różnych odległościach. Następnie znajdź minimum energetyczne tej krzywej na dwa sposoby.(a) Wykorzystaj energię wiązań znalezioną w tabelach do obliczenia energii dla jednego
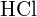 wiązania (Wskazówka: Ile wiązań jest w molu?)(b) Użyj entalpii reakcji oraz energii wiązań dla H2 i Cl2 do rozwiązania problemu energii jednego mola
wiązania (Wskazówka: Ile wiązań jest w molu?)(b) Użyj entalpii reakcji oraz energii wiązań dla H2 i Cl2 do rozwiązania problemu energii jednego mola 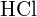 wiązań.
wiązań.
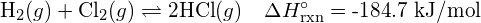
Wyjaśnij, dlaczego wiązania występują w określonych średnich odległościach od wiązania zamiast atomów zbliżających się do siebie nieskończenie blisko.
Określona średnia odległość od wiązania to odległość o najniższej energii. W odległości mniejszej niż odległość wiązania, dodatnie ładunki na dwóch jądrach odpychają się nawzajem, a ogólna energia wzrasta. - Gdy cząsteczka może tworzyć dwie różne struktury, struktura z silniejszymi wiązaniami jest zwykle bardziej stabilna forma. Użyj energii wiązań, aby przewidzieć prawidłową strukturę cząsteczki hydroksyloaminy:
 Większa energia wiązań jest na rysunku po lewej stronie. Jest to forma bardziej stabilna.
Większa energia wiązań jest na rysunku po lewej stronie. Jest to forma bardziej stabilna. - Jak zmienia się energia wiązania
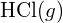 różni się od standardowej entalpii tworzenia
różni się od standardowej entalpii tworzenia 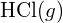 ?
? - Używając danych dotyczących standardowej entalpii tworzenia w dodatku G, pokaż, w jaki sposób standardowa entalpia tworzenia
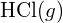 może być użyta do wyznaczenia energii wiązania.
może być użyta do wyznaczenia energii wiązania.
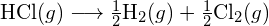
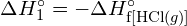
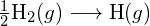
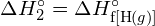
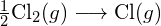
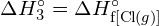
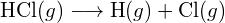
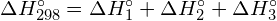
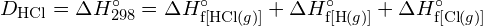
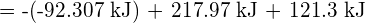
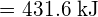
- Korzystając z danych dotyczących standardowej entalpii tworzenia w Dodatku G, oblicz energię wiązania podwójnego węgiel-siarka w
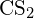 .
. - Używając danych o standardowej entalpii tworzenia w Dodatku G, określ, które wiązanie jest silniejsze: wiązanie S-F w
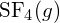 czy w
czy w 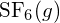 ?
Wiązanie S-F w
?
Wiązanie S-F w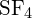 jest silniejsze.
jest silniejsze. - Używając standardowych danych entalpii tworzenia w Dodatku G, określ, które wiązanie jest silniejsze: wiązanie P-Cl w
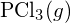 czy w
czy w 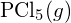 ?
? - Uzupełnij następującą strukturę Lewisa, dodając wiązania (nie atomy), a następnie wskaż najdłuższe wiązanie:

 Pojedyncze wiązania C-C są najdłuższe.
Pojedyncze wiązania C-C są najdłuższe. - Użyj energii wiązań do obliczenia przybliżonej wartości ΔH dla następującej reakcji. Która postać jest bardziej stabilna
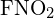 ?
?
- Użyj zasad struktury atomowej, aby odpowiedzieć na każde z poniższych pytań:1 (a) Promień atomu Ca wynosi 197 pm; promień jonu
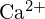 wynosi 99 pm. Wyjaśnij tę różnicę. (b) Energia sieciowa
wynosi 99 pm. Wyjaśnij tę różnicę. (b) Energia sieciowa 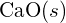 wynosi -3460 kJ/mol; energia sieciowa jonu ^{K}_2}^{O} wynosi -2240 kJ/mol. Wyjaśnij tę różnicę. (c) Biorąc pod uwagę te wartości jonizacji, wyjaśnij różnicę między Ca i K w odniesieniu do ich pierwszej i drugiej energii jonizacji.
wynosi -3460 kJ/mol; energia sieciowa jonu ^{K}_2}^{O} wynosi -2240 kJ/mol. Wyjaśnij tę różnicę. (c) Biorąc pod uwagę te wartości jonizacji, wyjaśnij różnicę między Ca i K w odniesieniu do ich pierwszej i drugiej energii jonizacji.
Pierwiastek Pierwsza energia jonizacji (kJ/mol) Druga energia jonizacji (kJ/mol) K 419 .
3050 Ca 590 1140 (d) Energia pierwszej jonizacji Mg wynosi 738 kJ/mol, a Al – 578 kJ/mol. Wyjaśnij tę różnicę.
(a) Gdy dwa elektrony są usunięte z powłoki walencyjnej, promień Ca traci najbardziej zewnętrzny poziom energetyczny i powraca do niższego poziomu n = 3, który ma znacznie mniejszy promień.(b) Ładunek +2 na wapniu przyciąga tlen znacznie bliżej w porównaniu z K, zwiększając tym samym energię sieciową w stosunku do mniej naładowanego jonu.
(c) Usunięcie elektronu 4s w Ca wymaga więcej energii niż usunięcie elektronu 4s w K z powodu silniejszego przyciągania jądra i dodatkowej energii potrzebnej do przerwania parowania elektronów. Druga energia jonizacji dla K wymaga usunięcia elektronu z niższego poziomu energetycznego, gdzie przyciąganie od jądra dla elektronu jest znacznie silniejsze. Dodatkowo, energia jest wymagana do rozłączenia dwóch elektronów na pełnym orbitalu. Dla Ca, drugi potencjał jonizacji wymaga usunięcia tylko samotnego elektronu w odsłoniętym zewnętrznym poziomie energetycznym.
(d) W Al, usunięty elektron jest stosunkowo niechroniony i niesparowany w orbitalu p. Wyższa energia dla Mg odzwierciedla głównie niesparowanie elektronu 2s.
- Dla której z poniższych substancji jest najmniejsza energia potrzebna do przekształcenia jednego mola ciała stałego w oddzielne jony? (a)
 (b)
(b) 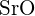 (c)
(c) 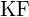 (d)
(d) 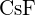 (e)
(e) 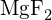 (d)
(d) - Reakcja metalu,
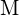 , z halogenem,
, z halogenem, 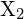 , przebiega w reakcji egzotermicznej, jak wskazuje to równanie:
, przebiega w reakcji egzotermicznej, jak wskazuje to równanie: 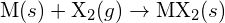 . Dla każdej z poniższych reakcji wskaż, która opcja spowoduje, że reakcja będzie bardziej egzotermiczna. Wyjaśnij swoje odpowiedzi. (a) duży promień vs. mały promień dla
. Dla każdej z poniższych reakcji wskaż, która opcja spowoduje, że reakcja będzie bardziej egzotermiczna. Wyjaśnij swoje odpowiedzi. (a) duży promień vs. mały promień dla 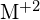 (b) wysoka energia jonizacji vs. niska energia jonizacji dla
(b) wysoka energia jonizacji vs. niska energia jonizacji dla 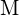 (c) rosnąca energia wiązania dla halogenu (d) malejące powinowactwo elektronowe dla halogenu (e) rosnący rozmiar anionu utworzonego przez halogen
(c) rosnąca energia wiązania dla halogenu (d) malejące powinowactwo elektronowe dla halogenu (e) rosnący rozmiar anionu utworzonego przez halogen - Energia sieci
 wynosi 1023 kJ/mol, a odległość Li-F wynosi 201 pm.
wynosi 1023 kJ/mol, a odległość Li-F wynosi 201 pm.  krystalizuje w takiej samej strukturze jak
krystalizuje w takiej samej strukturze jak  , ale z odległością Mg-O wynoszącą 205 pm. Która z poniższych wartości najbardziej przybliża energię sieci
, ale z odległością Mg-O wynoszącą 205 pm. Która z poniższych wartości najbardziej przybliża energię sieci  : 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol, czy 4008 kJ/mol? Wyjaśnij swój wybór.
4008 kJ/mol; oba jony w
: 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol, czy 4008 kJ/mol? Wyjaśnij swój wybór.
4008 kJ/mol; oba jony w mają dwa razy większy ładunek niż jony w
mają dwa razy większy ładunek niż jony w  ; długość wiązań jest bardzo podobna i oba mają taką samą strukturę; oczekuje się czterokrotnego zwiększenia energii na podstawie równania na energię sieci
; długość wiązań jest bardzo podobna i oba mają taką samą strukturę; oczekuje się czterokrotnego zwiększenia energii na podstawie równania na energię sieci - Który związek w każdej z poniższych par ma większą energię sieci? Uwaga:
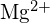 i
i 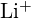 mają podobne promienie;
mają podobne promienie; 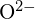 i
i 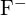 mają podobne promienie. Wyjaśnij swój wybór. (a)
mają podobne promienie. Wyjaśnij swój wybór. (a)  lub
lub 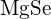 (b)
(b)  lub
lub  (c)
(c) 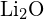 lub
lub 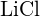 (d)
(d) 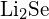 lub
lub 
- Który związek w każdej z poniższych par ma większą energię sieciową? Uwaga:
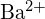 i
i 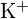 mają podobne promienie;
mają podobne promienie; 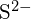 i \tekst{Cl}^- mają podobne promienie. Wyjaśnij swój wybór. (a) \tekst{K}_2\tekst{O} lub
i \tekst{Cl}^- mają podobne promienie. Wyjaśnij swój wybór. (a) \tekst{K}_2\tekst{O} lub 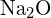 (b)
(b) 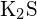 lub
lub  (c)
(c) 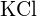 lub
lub  (d)
(d)  lub
lub 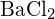 (a)
(a)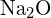 ; \\Na}^+ ma mniejszy promień niż
; \\Na}^+ ma mniejszy promień niż 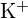 ; b)
; b)  ;
; 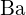 ma większy ładunek niż
ma większy ładunek niż 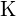 ; c)
; c)  ;
; 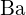 i
i 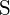 mają większe ładunki; d)
mają większe ładunki; d)  ;
; 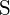 ma większy ładunek
ma większy ładunek - Który z poniższych związków wymaga najwięcej energii do przekształcenia jednego mola ciała stałego w oddzielne jony? (a)
 (b)
(b) 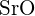 (c)
(c) 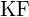 (d)
(d) 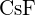 (e)
(e) 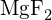
- Który z poniższych związków wymaga najwięcej energii do przekształcenia jednego mola ciała stałego w oddzielne jony? (a)
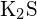 (b) \tekst{K}_2\O} (c)
(b) \tekst{K}_2\O} (c) 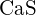 (d)
(d) 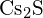 (e)
(e) 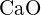 (e)
(e)
Przypisy
- 1 To pytanie pochodzi z Chemistry Advanced Placement Examination i zostało wykorzystane za zgodą Educational Testing Service.
Glossary
energia wiązania (także, energia dysocjacji wiązania) energia potrzebna do zerwania wiązania kowalencyjnego w substancji gazowej energia sieci (ΔHlattice) energia potrzebna do rozdzielenia jednego mola ciała stałego jonowego na jego składniki jony gazowe
energia potrzebna do rozdzielenia jednego mola ciała stałego jonowego na jego składniki jony gazowe
I
.
