Wprowadzenie
Choroba uchyłkowa okrężnicy jest najczęstszą chorobą dotykającą jelito grube w świecie zachodnim. Częstość występowania choroby uchyłkowej wzrosła w ciągu ostatniego stulecia na całym świecie, prawdopodobnie z powodu zmian w stylu życia, takich jak palenie tytoniu, nadwaga, a przede wszystkim brak aktywności fizycznej i dieta o niskiej zawartości błonnika. Częstość występowania wzrasta wraz z wiekiem, od około 5% u osób poniżej 40 roku życia do 50-70% u osób powyżej 80 roku życia; 80% pacjentów z zapaleniem uchyłków to osoby w wieku 50 lat lub starsze. Uchyłki mogą występować w liczbie od pojedynczych do setek, ich średnica wynosi zwykle 5-10 mm, ale może przekraczać 2 cm. Uchyłkowatość występuje głównie w esicy i okrężnicy zstępującej u ponad 90% pacjentów, ale może występować w różnym stopniu w pozostałej części okrężnicy.1
W niniejszym opracowaniu użyto kilku terminów związanych z uchyłkami. Obecność uchyłków w okrężnicy przy braku jawnego stanu zapalnego nazywana jest uchyłkowatością lub niepowikłaną chorobą uchyłkową (uncomplicated diverticular disease – UDD). Może być ona objawowa lub bezobjawowa. Termin „ostre zapalenie uchyłków jelita grubego” (ACD) jest używany do opisania zapalenia uchyłków, które może, ale nie musi, przejść w powikłania (powikłane ACD). Wyróżnia się również przewlekłe zapalenie uchyłków, spowodowane nawracającym zapaleniem uchyłków lub rozwojem odcinkowego zapalenia okrężnicy związanego z uchyłkami. Podsumowując, spektrum kliniczne choroby uchyłkowej jest szerokie.
Badania nad historią naturalną choroby wskazują, że znaczna większość pacjentów z uchyłkami (około 80%) pozostaje bezobjawowa przez całe życie. Spośród 15-20%, u których wystąpią objawy, u około 1/4 wystąpi ostatecznie epizod objawowej, bolesnej choroby uchyłkowej bez zapalenia, a u 10-25% epizod ACD. Około 1-2% będzie wymagało hospitalizacji, a 0,5% zabiegu operacyjnego. Uchyłki są odpowiedzialne za większość (24-42%) epizodów krwawienia z dolnego odcinka przewodu pokarmowego.2-4
Fizjopatologia i rozwój objawów
Uchyłek jelita grubego jest przepukliną błony śluzowej i podśluzowej, odpowiadającą słabemu punktowi, w którym vasa recti penetrują do tunica muscularis. Mechanizmy patogenetyczne choroby uchyłkowej są nadal słabo poznane, jednak powszechnie uważa się, że są one prawdopodobnie związane ze złożonymi interakcjami pomiędzy dietą, mikrobiotą jelita grubego, czynnikami genetycznymi, motoryką i strukturą jelita grubego, które prowadzą do powstawania uchyłków jelita grubego w miarę upływu czasu.5 Patrz ryc. 1. W 1971 roku Painter i Burkitt opublikowali swoją słynną hipotezę, że choroba uchyłkowa jest spowodowana nadmiernym ciśnieniem w okrężnicy z powodu segmentacji spowodowanej niedostatecznym spożyciem błonnika pokarmowego. W odpowiedzi na zwiększone ciśnienie wewnątrzjelitowe mogą powstawać wyrostki i wysuwać się w miejscach potencjalnego osłabienia.6 Zastój lub niedrożność w uchyłku o wąskiej szyi może prowadzić do przerostu bakteryjnego i miejscowego niedokrwienia tkanek, co ostatecznie prowadzi do perforacji.7 Od tego czasu w licznych badaniach obserwacyjnych próbowano wykazać możliwy wpływ błonnika na zapobieganie chorobie uchyłkowej. W większości z nich stwierdzono, że ryzyko wystąpienia UDD jest odwrotnie związane ze spożyciem błonnika pokarmowego.8-10 Na podstawie tych dowodów w większości aktualnych wytycznych i opracowań zaleca się stosowanie diety wysokobłonnikowej w celu zapobiegania chorobie uchyłkowej.11-15 Hipoteza ta została jednak ostatnio zakwestionowana, ponieważ: (1) w niektórych najnowszych badaniach epidemiologicznych16,17 zakwestionowano odwrotny związek między spożyciem błonnika a uchyłkowatością i (2) pojawiają się nowe hipotezy patogenetyczne, takie jak hipoteza neuropatyczna i miopatyczna.18-22 Inne czynniki związane ze zwiększonym ryzykiem wystąpienia choroby uchyłkowej to brak aktywności fizycznej, zaparcia, otyłość i palenie tytoniu.23-27
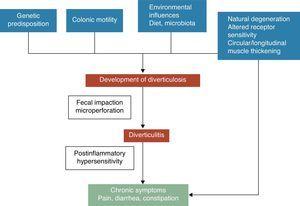
Symptoms development in diverticular disease is probably related to complex interactions among genetic features, colon structure, intestinal motility low grade inflammation and postinflammatory hypersensitivity.
Związek między niepowikłaną chorobą uchyłkową (UDD) a objawami jest niepewny. Istnieją pewne dowody sugerujące, że bolesna choroba uchyłkowa może być stanem związanym ze stanem zapalnym i jego wpływem na funkcje nerwowo-mięśniowe w jelicie grubym.22-28 Obecność przewlekłego zapalenia jelit o niewielkim nasileniu może wywoływać dysfunkcję czuciowo-ruchową, prowadzącą do rozwoju i/lub utrzymywania się objawów. Zmiany w mikroflorze jelitowej mogą być jednym z prawdopodobnych mechanizmów odpowiedzialnych za zapalenie o niskim stopniu nasilenia. Przerost bakterii wspomagany przez zastój kału w uchyłkach może przyczyniać się do przewlekłego zapalenia o niskim stopniu nasilenia, które uwrażliwia zarówno wewnętrzne neurony pierwotnie eferentne, jak i zewnętrzne neurony pierwotnie aferentne. Zmiany te mogą prowadzić do przerostu mięśni gładkich i zwiększonej wrażliwości na rozciąganie jamy brzusznej, a w końcu do rozwoju objawów.3,22 Patrz ryc. 1.
Jak wspomnieliśmy powyżej, większość osób z uchyłkowatością jelita grubego pozostaje bezobjawowa, ale ostatecznie może dojść do rozwoju powikłań w postaci ACD lub krwawienia z uchyłków. W tym artykule skupimy się na ACD. Kliniczna manifestacja tego zdarzenia będzie zależeć od wielu czynników, w tym wielkości perforacji, stopnia zanieczyszczenia pozakolonowego oraz zdolności organizmu do zatrzymania tego zanieczyszczenia.29,30
Zarządzanie chorobą uchyłkowąZarządzanie niepowikłaną chorobą uchyłkową (UDD)
W przypadku pacjentów z bezobjawową UDD,2 może być zalecana dieta wysokobłonnikowa ze względu na jej możliwe korzyści profilaktyczne w zapobieganiu objawowej UDD i powikłaniom. Nie ma dowodów na przydatność innych leków u tych pacjentów.
Jest więcej dowodów na korzyści z leczenia w objawowym UDD. Najczęstszym objawem jest ból brzucha, który może nasilać się podczas jedzenia i ustępować po defekacji lub oddaniu stolca. Inne objawy to nudności, biegunka, zaparcia i wzdęcia. U ponad 61% pacjentów z objawowym UDD, którzy nie podejmują żadnych działań terapeutycznych w celu zapobiegania nawrotom objawów, w ciągu 1 roku wystąpią objawy, a u około 4% rozwiną się powikłania.31
Do leczenia zaproponowano pięć leków (patrz ryc. 2):

Leczenie niepowikłanej choroby uchyłkowej. Mechanisms of action.
A) Dieta wysokobłonnikowa lub środki wypełniające
Several randomized controlled trials (RCT) and other interventional studies evaluate the effect of fibre in symptomatic UDD, but with inconsistent results.32-37 W każdym razie błonnik jest zalecany w zapobieganiu i leczeniu objawowego UDD, jak również w zapobieganiu ACD przez większość aktualnych wytycznych i dokumentów określających stanowisko.11-15
B) Antybiotykoterapia
Zasadność stosowania antybiotyków w objawowym UDD nie jest jednoznacznie ustalona. Ostatnie badania sugerują, że zmiany w mikrobiocie jelitowej (przerost bakterii jelitowych) mogą przyczyniać się do rozwoju objawów z powodu nadmiernej produkcji gazów jelitowych w wyniku fermentacji węglowodanów. W celu uniknięcia działań systemowych, najwłaściwszymi antybiotykami wydają się być słabo wchłaniane środki przeciwdrobnoustrojowe, które działają przeciwko patogenom jelitowym, ale mają minimalne ryzyko toksyczności systemowej lub działań niepożądanych. Rifaksymina została zaproponowana.
Rifaksymina
Rifaksymina jest niesystematycznym analogiem rifamycyny o szerokim spektrum działania in vitro. Rifaksymina może zmniejszać aktywność metaboliczną flory jelitowej, zwiększając masę kału, a także może likwidować przerost bakterii. Antybiotyk ten charakteryzuje się wysokim profilem bezpieczeństwa i tolerancji.33,38 Poziom rifaksyminy w osoczu jest minimalny, dlatego patogeny nieenteryjne nie są narażone na presję selekcyjną, a ryzyko oporności bakterii jest małe.39 W trzech otwartych i dwóch podwójnie ślepych RCT40-44 badano skuteczność cyklicznego podawania rifaksyminy i błonnika w zmniejszaniu objawów w porównaniu z samym błonnikiem. W przeglądzie systematycznym i dwóch metaanalizach przeanalizowano te badania.44-46 Stwierdzono w nich, że leczenie skojarzone jest skuteczne w uzyskaniu złagodzenia objawów po 1 roku u pacjentów z UDD. 35% pacjentów leczonych samym błonnikiem było bezobjawowych w porównaniu z 64% w grupach leczenia skojarzonego. Liczba koniecznych do leczenia wynosiła trzy dla rifaksyminy vs placebo dla złagodzenia objawów i dziewięć dla uniknięcia powikłań. Podsumowując, najlepsze wyniki uzyskano stosując połączenie rozpuszczalnego błonnika, takiego jak glukomannan, i rifaksyminy 1 tydzień co miesiąc.
C) Probiotyki
Probiotyki to żywe mikroorganizmy, które mogą przywrócić komensalną florę jelitową, która mogła zostać zmieniona w chorobie uchyłkowej z powodu zastoju i skrócenia czasu pasażu jelita grubego.47 Niestety, dostępnych jest niewiele danych na temat ich stosowania w objawowym UDD, a większość badań jest mała i niekontrolowana. W większości z nich wykazano poprawę objawów.48-50
Probiotyki badano również w połączeniu z 5-aminosalicylanem (5-ASA). Tursi i współpracownicy przeprowadzili trzy RCT porównujące sam 5-ASA, sam probiotyk lub terapię skojarzoną.51-53 Zarówno 5-ASA, jak i probiotyki okazały się skuteczne w zapobieganiu objawowemu UDD, ale ich połączenie było lepsze. W niedawno opublikowanym przez tę samą grupę naukową badaniu RCT z podwójnie ślepą próbą stwierdzono, że zarówno cykliczna mesalazyna, jak i Lactobacillus casei subsp DG, szczególnie w połączeniu, wydają się być lepsze niż placebo w utrzymaniu remisji objawowego UDD.54 Podsumowując jednak, słabe projekty badań i ich niewielki rozmiar nie pozwalają na wyciągnięcie ostatecznych wniosków.
D) 5-ASA: mesalazyna
Mesalazyna ma działanie przeciwzapalne i antyoksydacyjne. W 2010 r. Gatta i wsp.,55 opublikowali przegląd systematyczny Cochrane, w którym oceniali rolę 5-ASA u pacjentów z chorobą uchyłkową. Autorzy doszli do wniosku, że 5-ASA może być skuteczna w leczeniu tej choroby, a codzienne podawanie mesalazyny było lepsze niż podawanie cykliczne w celu zapobiegania nawrotom. W celu potwierdzenia ich obserwacji konieczne jest przeprowadzenie wysokiej jakości, dobrze zaprojektowanych badań RCT. W pierwszym kontrolowanym placebo badaniu z podwójnie ślepą próbą wykazano skuteczność mesalazyny w łagodzeniu bólu u pacjentów z ostrym UDD.56 Istnieją również dwa interesujące RCT, które wykazały korzyść z podawania mesalazyny w porównaniu z rifaksyminą w zakresie zapobiegania nawrotom objawowym oraz podobny sukces w utrzymaniu długotrwałej remisji w porównaniu z podawaniem probiotyku Lactobacillus casei.53,57
W wielu kontrolowanych badaniach wykazano, że NLPZ są czynnikiem ryzyka rozwoju objawów, ACD, perforacji i krwawienia.7,58-60 Osoby stosujące NLPZ są bardziej narażone na rozwój objawowej choroby uchyłkowej niż osoby niestosujące tych leków (RR: 1,5, CI 95%: 1,1-2,1).58 U pacjentów z powikłaną chorobą uchyłkową obserwowano większe stosowanie NLPZ w porównaniu z grupą kontrolną bez choroby. Postulowano, że to zwiększone ryzyko wynika z uszkodzenia błony śluzowej, co skutkuje upośledzeniem funkcji barierowej błony śluzowej jelita grubego i umożliwia translokację bakterii, które prowokują stan zapalny.
G) Poziom witaminy D
Wydaje się, że częstość występowania ACD jest związana ze zmiennością geograficzną i sezonową. W związku z tym Maguire i wsp. przeprowadzili dwa interesujące badania obserwacyjne, które wykazały, że niższy poziom witaminy D i niska ekspozycja na promieniowanie UV (ekspozycja na promieniowanie UV określa status witaminy D) są związane z istotnie wyższym ryzykiem ACD. Przed sformułowaniem rekomendacji konieczne jest przeprowadzenie większej liczby wysokiej jakości badań.61,62
Leczenie ostrego zapalenia uchyłków jelita grubego (ACD)
Chociaż większość osób z uchyłkowatością pozostaje bezobjawowa, szacuje się, że u około 10-25% z nich rozwinie się epizod lewostronnego ACD.63 Na ogół diagnostyka kliniczna nie jest wystarczająco dokładna i wskazane jest zastosowanie technik radiologicznych. U pacjentów z łagodnymi objawami (większość) i bez objawów powikłanego ACD, połączenie bólu w lewym podżebrzu, braku wymiotów i białka C-reaktywnego >50mg/l może być wystarczające do postawienia rozpoznania.64,65 Jeśli badania obrazowe są wskazane, prawdopodobnie najskuteczniejszym podejściem jest strategia warunkowa, z ultrasonografią jako techniką pierwszego rzutu, a następnie tomografią komputerową (CT), jeśli USG jest niejednoznaczne lub wątpliwe. Liczba badań TK może być zredukowana o 50%. W 1978 roku Hinchey i wsp. zaproponowali klasyfikację ACD, która została później zmodyfikowana.66,67 Wyróżnia ona pięć stopni ACD; stopień 0, klinicznie łagodne zapalenie uchyłków, stopień I (a: zapalenie okołobłoniaste i b: ropień
cm w pobliżu pierwotnego zapalenia), stopień II, ropień wewnątrzbrzuszny, miedniczny lub zaotrzewnowy lub ropień odległy od pierwotnego zapalenia, stopień III, uogólnione ropne zapalenie otrzewnej i stopień IV, kałowe zapalenie otrzewnej. Patrz ryc. 3.

Algorytm postępowania w ostrym zapaleniu uchyłków jelita grubego.
Leczenie niepowikłanego ACD (stadium 0 lub Ia wg Hincheya)
Większość niepowikłanego ACD może być bezpiecznie leczona zachowawczo z odsetkiem powodzenia wynoszącym od 70% do 100%.14 Leczenie ambulatoryjne może przynieść istotne oszczędności dla systemów opieki zdrowotnej. W przypadku niepowikłanej ACD, kryteriami do leczenia szpitalnego są: znaczny stan zapalny (w tym obecność gorączki lub zapalenie otrzewnej), nietolerancja płynów doustnych, wiek powyżej 80-85 lat, immunosupresja lub poważne choroby współistniejące. W większości przypadków wystarczający będzie krótki pobyt w szpitalu. Nie ma dowodów na to, że ograniczenia dietetyczne wpływają na wyniki leczenia, chociaż większość lekarzy zazwyczaj zaleca stosowanie klarownej płynnej diety.
Jedną z największych ostatnich zmian w postępowaniu w niepowikłanym ACD jest zmniejszające się stosowanie antybiotyków. W niedawnym przeglądzie Cochrane, w którym zastosowano jedynie podejście jakościowe (bez metaanalizy), stwierdzono, że najlepsze dostępne dane nie potwierdzają rutynowego stosowania antybiotyków.68 Antybiotyki nie przyspieszają powrotu do zdrowia ani nie zapobiegają powikłaniom czy nawrotom choroby. Dlatego stosowanie antybiotyków w tym przypadku jest wątpliwe. Prawdopodobnie byłyby one wskazane u chorych z objawami uogólnionej infekcji, objawami posocznicy lub bakteriemii oraz u chorych z obniżoną odpornością. Zalecane schematy postępowania oparte są na konsensusie klinicznym. Można stosować różne antybiotyki, od ampicyliny do cefalosporyn trzeciej generacji, o ile są one skuteczne wobec bakterii gram dodatnich, gram ujemnych i beztlenowych. Połączenie ciprofloksacyny i metronidazolu jest prawdopodobnie najczęściej przepisywanym lekiem doustnym. Jeśli ta kombinacja jest źle tolerowana, dobrym wyborem może być ampicylina-sulfabaktam. Z drugiej strony, ostatnie dane wskazują na brak przewagi antybiotyków podawanych dożylnie nad doustnymi oraz przewagi leczenia dożylnego trwającego 4 dni nad leczeniem 7-dniowym.69-71 Zazwyczaj poprawę kliniczną obserwuje się w ciągu 3-4 dni leczenia. Ostatecznie przyjęcie do szpitala z antybiotykiem podawanym dożylnie jest zalecane, gdy pacjent nie jest w stanie przyjmować pokarmów doustnie, jest obciążony poważnymi chorobami współistniejącymi lub nie uzyskuje poprawy po leczeniu ambulatoryjnym.
Postępowanie w przypadku powikłanej ACD (stadium Hincheya Ib do IV)ACD Hinchey Ib lub II: ropień
Około 15% pacjentów z ACD rozwinie ropień.67 Nie ma wysokiej jakości dowodów dotyczących najbardziej optymalnego postępowania w przypadku ACD z tworzeniem się ropnia. Hospitalizacja jest wskazana. Wielkość ropnia jest ważnym czynnikiem warunkującym powodzenie leczenia. W mniejszych ropniach (
cm) zalecane jest leczenie zachowawcze antybiotykami o szerokim spektrum działania. Jest ono skuteczne nawet w 70%.72 W przypadku niepowodzenia leczenia zachowawczego lub w większych ropniach należy wykonać drenaż przezskórny. Jest on skuteczny nawet w 80%.73 Chirurgia będzie leczeniem ratunkowym, gdy wcześniej wymienione sposoby leczenia zawiodą.ACD Hinchey III lub IV: ropne lub kałowe zapalenie otrzewnej
Zapalenie otrzewnej jest najpoważniejszym powikłaniem, ze śmiertelnością 14%. Mimo braku dowodów, wczesna operacja jest uważana za standardową terapię u tych pacjentów. Wybór sposobu operacji zależy od stanu pacjenta, wyników badania operacyjnego i doświadczenia chirurga. U krytycznie chorych pacjentów z niestabilnością hemodynamiczną zalecane jest wykonanie zabiegu Hartmanna. Jednak u pacjentów stabilnych hemodynamicznie za lepszy wybór należy uznać pierwotne zespolenie z lub bez proksymalnego odprowadzenia stolca.14,74
Tradycyjnie międzynarodowe wytyczne zalecają stosowanie endoskopii po epizodzie ACD w celu wykluczenia raka jelita grubego. Zalecenie to jest oparte jedynie na opiniach ekspertów. Ostatnie badania retrospektywne oraz przegląd systematyczny75-80 wykazały, że częstość występowania raka u tych pacjentów jest raczej niska. W oparciu o te ostatnie dowody najskuteczniejszą strategią może być kierowanie na kolonoskopię tylko tych pacjentów, u których utrzymują się objawy lub u których stwierdza się podejrzane wyniki tomografii komputerowej. Jednak do sformułowania zdecydowanych zaleceń konieczne jest przeprowadzenie większej liczby badań.
Postępowanie po epizodzie ACD
Po jednym epizodzie ACD u około jednej trzeciej pacjentów wystąpi drugi epizod ACD, a po drugim epizodzie u kolejnej jednej trzeciej pacjentów wystąpi kolejny atak.73,74 Jednak dowody na określenie optymalnego leczenia po epizodzie ACD w celu zapobieżenia nowemu epizodowi są skąpe.
A) Dieta wysokobłonnikowa
Po ustąpieniu ostrego epizodu powszechnie zaleca się stosowanie diety wysokobłonnikowej w celu zmniejszenia liczby nawrotów. Jednak wyniki badań RCT nad dietą wysokobłonnikową u pacjentów z ACD są niespójne. W niedawno opublikowanym przeglądzie systematycznym dotyczącym diety wysokobłonnikowej nie znaleziono żadnego badania, które badałoby rolę błonnika w zapobieganiu nawrotom ACD.26,81 Niektórych pokarmów (nasion, popcornu i orzechów) klasycznie się unika, ponieważ teoretycznie mogą one wchodzić, blokować lub podrażniać uchyłki. Jednak Strate i wsp. w swoim dużym, prospektywnym badaniu nie stwierdzili związku ze zwiększonym ryzykiem wystąpienia ACD. Dlatego wykluczenie z diety tych pokarmów nie powinno być zalecane.82 Również zmniejszenie masy ciała i zaprzestanie palenia tytoniu może mieć korzystny wpływ na zapobieganie ACD.9,83
B) Antybiotyki
W trzech ostatnich przeglądach systematycznych oceniano rolę cyklicznej rifaksyminy w zapobieganiu nawrotom ACD, ale nie wykazano wyraźnych korzyści.46,84,85 Z patofizjologicznego punktu widzenia, prawdopodobnym wyjaśnieniem nieskuteczności rifaksyminy w zapobieganiu nawrotom może być fakt, że cykliczne leczenie może nie kontrolować populacji bakterii w okrężnicy przez cały miesiąc, ponieważ populacja bakterii w okrężnicy odnawia się w ciągu 7-14 dni po zakończeniu stosowania rifaksyminy. W niedawno przeprowadzonym otwartym RCT w Hiszpanii wykazano jednak, że cykliczna rifaksymina może poprawić objawy i utrzymać okresy remisji po ACD.86 Nawroty wystąpiły u 10,4% pacjentów, którym podawano rifaksyminę plus błonnik w porównaniu z 19,3% pacjentów, którym podawano sam błonnik. Ponadto pacjenci, u których po raz pierwszy rozpoznano chorobę od ≥1 roku, mieli większe ryzyko zaostrzenia (OR 3,34, 95% CI: 0,01-12,18). Konieczne są jednak dalsze badania, ponieważ w chwili obecnej nie można sformułować żadnych zaleceń. Nie ma dowodów na poparcie stosowania innych antybiotyków w tym przypadku.
C) Probiotyki
W niektórych badaniach otwartych badano rolę probiotyków w zapobieganiu nawrotom ACD. Giaccari i wsp., ponad 20 lat temu, oceniali rolę Lactobacillus sp. po rifaksyminie u 79 pacjentów ze zwężeniem jelita grubego po zapaleniu uchyłków. 88% pacjentów pozostało bezobjawowych przez okres 12 miesięcy.87 To badanie obserwacyjne było pierwszym, które sugerowało możliwą rolę probiotyków w tej sytuacji. W nowszym badaniu oceniano leczenie skojarzone; balsalazyd i VSL#3 (mieszanka probiotyków składająca się z ośmiu gatunków). Po 12 miesiącach 73% osób poddanych terapii skojarzonej było bezobjawowych w porównaniu z 53% poddanych monoterapii probiotykami (p>0,05).52 Podsumowując, probiotyki wydają się być skuteczne w zapobieganiu nawrotom ACD, ale brakuje dobrze zaprojektowanych badań.
D) 5-ASA
Wiele podwójnie ślepych i otwartych RCT oceniało rolę mesalazyny w zapobieganiu nawrotom ACD. Niestety większość z nich nie wykazała przewagi mesalazyny nad placebo w zapobieganiu nawrotom.88-90 Raskin i wsp. opublikowali ostatnio dwa interesujące i identyczne badania fazy 3 z podwójnie ślepą próbą i placebo (PREVENT1 i PREVENT2), które również wykazały, że mesalazyna nie jest lepsza od placebo w zapobieganiu nawrotom ACD.91 W kilku badaniach oceniano również leczenie skojarzone, 5-ASA plus rifaksymina. Trivedi i Das dokonali przeglądu danych z pięciu RCT i jednego badania otwartego, obejmujących łącznie ponad 600 pacjentów, i doszli do wniosku, że leczenie skojarzone wydaje się być lepsze od samej ryfaksyminy w zapobieganiu nawrotom ACD.92
E) Chirurgia
Jeszcze kilka lat temu zalecano wykonanie zabiegu chirurgicznego po dwóch atakach niepowikłanego ACD lub jednym ataku powikłanego ACD w celu zmniejszenia zachorowalności i śmiertelności z powodu nawrotów. Z tego powodu ważne jest, aby zważyć zachorowalność i śmiertelność związaną z zabiegiem operacyjnym z ryzykiem powikłanych nawrotów i nasileniem objawów.
Ostatnie dane wskazują, że naturalna historia ACD jest znacznie bardziej łagodna niż sądzono w przeszłości.73,94 Długoterminowe ryzyko nawrotu jest niższe niż wcześniej sądzono, a długoterminowe ryzyko kolejnych operacji w trybie pilnym (3-7%), zgonu (95) wykazało, że 16% przypadków z pierwszym epizodem ACD było operowanych w trybie pilnym w porównaniu z zaledwie 6% w przypadkach nawracających, a 30-dniowa śmiertelność w przypadku pierwszego epizodu była również wyższa w porównaniu z nawrotami (3% vs 0%). W rzeczywistości większość chorych z powikłanym ACD nie ma wywiadu w kierunku tej choroby.96 Postuluje się również, że nawracające ACD może chronić przed perforacją, być może z powodu tworzenia się zrostów spowodowanych stanem zapalnym.95 Dlatego też polityka planowej operacji po ACD nie zmniejsza prawdopodobieństwa kolejnych operacji (do 3%) i nie chroni w pełni przed nawrotami. Z drugiej strony, poprawa diagnostyki i metod leczenia zmniejszyła śmiertelność w powikłanych ACD. Ze względu na te nowe dane American Society of Colon and Rectum Surgeons w swoich najnowszych wytycznych zaleca, aby planowa resekcja esicy po wyleczeniu z ACD była wykonywana w każdym przypadku indywidualnie14 i uważa, że liczba poprzednich epizodów nie jest dobrym wskaźnikiem wyboru kandydatów do planowej operacji. Lekarze powinni brać pod uwagę stan zdrowia i wiek pacjenta, częstość i nasilenie ataku(ów) oraz obecność utrzymujących się objawów po ostrym epizodzie.14
Bardzo trudno jest przewidzieć, które przypadki ACD będą nawracać. Oceniana w TK ciężkość pierwszego epizodu ACD wydaje się być predyktorem niekorzystnej historii naturalnej. Lewostronne ACD, >5 cm zajętej okrężnicy i ropień zaotrzewnowy były czynnikami predykcyjnymi nawrotu i muszą być brane pod uwagę.97 Nie ma zgodności co do tego, czy młody wiek (82 Według aktualnych danych wiek nie powinien być brany pod uwagę jako wskazanie do planowej operacji, ponieważ nie wydaje się być związany z ciężkim przebiegiem choroby po ACD leczonym farmakologicznie. Biorąc jednak pod uwagę fakt zwiększonej częstości występowania ACD u młodszych pacjentów, konieczne są dalsze badania w celu wyjaśnienia tej specyficznej kwestii.
Szczególnymi przypadkami są osoby z obniżoną odpornością. Badania kohortowe wskazują, że u tych chorych występuje wysokie ryzyko powikłanego, nawracającego ACD (5-krotnie większe ryzyko perforacji) oraz wysokie ryzyko operacji w trybie nagłym.98 Dlatego obniżenie progu dla operacji planowej może być dla nich korzystne.14 Jednak Biondo i wsp. w swoim najnowszym badaniu wykazali, że pacjenci z upośledzoną odpornością mieli istotnie wyższy wskaźnik śmiertelności, ale tylko w pierwszym epizodzie. W związku z tym istnieją kontrowersje.99
Leczenie następstwA) Przetoka
Przetoka powstaje, gdy flegma uchyłkowa lub ropień pęknie do sąsiedniego narządu. Przetoka pojawia się u mniej niż 5% pacjentów z ACD. Najczęstsze z nich to przetoki okrężniczo-szyjne i okrężniczo-pochwowe. Przypuszczalnie u większości chorych można wykonać jednoetapową resekcję operacyjną z zamknięciem przetoki i pierwotnym zespoleniem. Inne przetoki, takie jak okrężniczo-jelitowa lub okrężniczo-szyjna są rzadkie.100,101
B) Niedrożność
Powtarzające się epizody ACD, które mogą być subkliniczne, mogą powodować przewlekłe zwężenie okrężnicy bez toczącego się zapalenia. Może wystąpić niedrożność dużego stopnia lub całkowita. W pierwszej kolejności leczenia niedrożności konieczne jest wykluczenie etiologii złośliwej. Kiedy nowotwór jest wystarczająco wykluczony i nie ma ACD, endoskopowe poszerzenie lub czasowe odbarczenie za pomocą metalowego stentu może być opcją terapeutyczną.102 Później może być wykonana jednoetapowa resekcja bez zmiany kierunku.
Postępowanie w odcinkowym zapaleniu jelita grubego związanym z uchyłkowatością
Jest ono definiowane jako przewlekłe zapalenie błony śluzowej międzyprzegrodowego odcinka okrężnicy. Odbytnica i okrężnica prawa są oszczędzane. Stało się ono odrębnym zaburzeniem klinicznym i patologicznym, często przebiegającym z krwawymi stolcami. Patogeneza nie jest znana. Spektrum zmian histologicznych waha się od łagodnego nieswoistego zapalenia do zmian przypominających nieswoiste zapalenie jelit. Z tego powodu diagnostyka różnicowa jest często trudna. Większość pacjentów zdrowieje całkowicie w ciągu kilku tygodni lub miesięcy. Niektórzy z nich są początkowo leczeni doustnie 5-ASA, ale prawdopodobnie leki te nie są konieczne, ponieważ większość przypadków ustępuje samoistnie.103
Wnioski
W objawowym UDD celem leczenia jest zapobieganie powikłaniom i zmniejszenie objawów. Zgodnie z aktualnymi dowodami, błonnik plus cykliczna rifaksymina lub mesalazyna plus probiotyki wydają się być najskuteczniejszymi terapiami. W ACD antybiotyki wydają się pozostawać podstawą leczenia, a postępowanie ambulatoryjne jest uważane za optymalne u zdecydowanej większości pacjentów z niepowikłanym ACD. Natomiast w powikłanych ACD konieczne jest leczenie szpitalne i dożylne podawanie antybiotyków. Obecnie zmienia się rola chirurgii ratunkowej. Większość ropni związanych z zapaleniem uchyłków może być leczona antybiotykami dożylnymi i/lub drenażem przezskórnym, a operacja w trybie nagłym będzie uważana za standardowe leczenie tylko u pacjentów z zapaleniem otrzewnej. Wreszcie, planowa operacja po wyzdrowieniu z ACD powinna być przeprowadzana w każdym przypadku indywidualnie.
Wkład autorów
Gargallo CJ, Sopeña F i Lanas A w równym stopniu przyczynili się do zaprojektowania, zredagowania i zrecenzowania tej pracy.
Konflikt interesów
Dr Carla J. Gargallo i dr Federico Sopeña nie zgłaszają konfliktu interesów. Dr Angel Lanas był doradcą firmy AlfaWasserman.
.
