Home  FAQ FAQ  Kwasy i zasady Kwasy i zasady |
Print | Comment |
| Previous Question | Następne pytanie |
| Słownictwo | |
azo compound diazonium salt  diazotization  indicator  pH strong kwas  miareczkowanie  słaba zasada  |
Pomarańcz metylowy jest intensywnie zabarwionym związkiem stosowanym w barwieniu i drukowaniu tkanin. Jest również znany jako C.I. Acid Orange 52, C.I. 13025, helianthine B, Orange III, Gold orange i Tropaeolin D .
Chemicy używają oranżu metylowego jako wskaźnika w miareczkowaniu słabych zasad z mocnymi kwasami. Zmienia kolor z czerwonego (przy pH 3.1) na pomarańczowo-żółty (przy pH 4.4):
![]()
![]()
zmiana koloru związana z pH wynika ze zmian w sposobie, w jaki elektrony są ograniczone w cząsteczce, gdy jony wodorowe są przyłączane lub odłączane.Oto struktura oranżu metylowego w kwaśnym roztworze:

Pomarańcz metylowa w kwaśnym roztworze.
Kliknij obrazek, aby zobaczyć strukturę 3D Chime.
Cząsteczka absorbuje niebiesko-zielone światło, przez co jej roztwór wydaje się czerwony. Zauważ, że azot obdarzony ładunkiem dodatnim jest zaangażowany w wiązanie podwójne.
W podstawowej formie oranżu metylowego jon wodorowy jest tracony z mostka -NN- między pierścieniami, a elektrony wcześniej używane do wiązania wodoru neutralizują ładunek dodatni na terminalnym azocie, tak że nie jest on już zdolny do wiązania pi-bond.Roztwory oranżu metylowego wydają się żółte w roztworze alkalicznym .
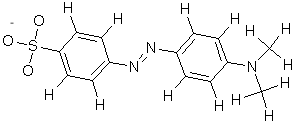
Pomarańcza metylowa w roztworze zasadowym.
Kliknij obrazek, aby uzyskać strukturę 3D Chime.
Jak powstaje oranż metylowy?
Pomarańcza metylowa jest syntetyzowana w reakcji kwasu sulfanilowego, azotynu sodu i dimetyloaniliny.Po pierwsze, kwas sulfanilowy rozpuszcza się w rozcieńczonym kwasie wodnym. Dodaje się azotyn sodu w celu wytworzenia soli diazoniowej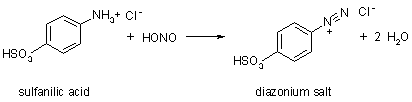
Reakcja ta nazywana jest diazotyzacją i jest niezwykle przydatna w syntezie organicznej. Kwas azotowy dostarcza NO+, który zastępuje wodór na grupie -NH3+, wytwarzając -NH2NO+ i wodę; druga woda jest eliminowana, aby wytworzyć grupę -N2+.
Sól diazoniowa jest następnie sprzęgana z dimetyloaniliną. Sprzęganie odbywa się w pozycji przeciwnej („para”) od grupy -N(CH3)2: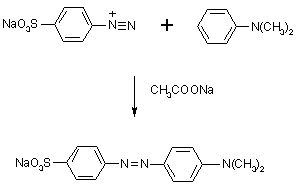
Octan sodu czyni roztwór słabo zasadowym; jon octanowy przyjmuje wodór wyparty z pierścienia dimetyloaniliny.
Przypisy i uwagi
.
