 Open Access Article
Open Access Article This Open Access Article is licensed under a
This Open Access Article is licensed under a
Creative Commons Attribution 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc and Lei Tao *a
*a
aKey Laboratory of Bioorganic Phosphorus Chemistry & Chemical Biology (Ministry of Education), Department of Chemistry, Tsinghua University, Beijing 100084, P. R. China. E-mail: [email protected]
bThe State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, P. R. China
cCollege of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. China
dCancer Institute & Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
Pierwsza publikacja 27 marca 2017
Pochodne glikolu polietylenowego (PEG) były szeroko stosowane w badaniach związanych z biologią. Jednak oligomery PEG (o różnych masach cząsteczkowych) lub monomery na bazie PEG (z różnymi grupami końcowymi łańcucha) w rzeczywistości mają różne właściwości chemiczne i fizyczne, co może prowadzić do potencjalnej toksyczności. W niniejszej pracy dokonano pomiarów cytotoksyczności serii pochodnych PEG (oligomerów i monomerów) z wykorzystaniem ludzkich komórek raka szyjki macicy (HeLa) oraz linii komórkowej fibroblastów pochodzących od myszy (L929) jako komórek modelowych. Większość oligomerów PEG jest bezpieczna dla obu typów komórek, z wyjątkiem glikolu trietylenowego (TEG), który w wysokich stężeniach jest toksyczny dla komórek L929. Z drugiej strony, monomery na bazie PEG, w tym akrylan eteru metylowego glikolu poli(etylenowego) (mPEGA) i metakrylan eteru metylowego glikolu poli(etylenowego) (mPEGMA) wykazują oczywistą cytotoksyczność. Następnie, te toksyczne pochodne PEG były badane w celu ujawnienia różnych mechanizmów ich toksyczności. Obecne badania oceniały cytotoksyczność pochodnych PEG i wskazywały na potencjalne zagrożenie „bezpiecznych” biomateriałów, które mogą stanowić użyteczne odniesienie dla osób wykorzystujących pochodne PEG w przyszłych badaniach biomedycznych.
Wprowadzenie
Glikol polietylenowy (PEG) był szeroko stosowany w różnych dziedzinach medycyny ze względu na jego wyjątkowe właściwości, takie jak zadowalające bezpieczeństwo, biokompatybilność, hydrofilowość itp. Na przykład, PEG został wykorzystany w niektórych środkach przeczyszczających zatwierdzonych przez Food and Drug Administration z powodu jego doskonałej zdolności do zatrzymywania wilgoci i smarowania.1-3 W innym przykładzie, modyfikowanie leków/białek za pomocą PEG (PEGylacja) może skutecznie poprawić ich rozpuszczalność w wodzie i okres półtrwania w obiegu leków,4,5 co skutkuje zwiększonym bezpieczeństwem i efektami terapii. PEGylacja staje się jedną z najbardziej atrakcyjnych biotechnologii i osiąga ogromne sukcesy w badaniach podstawowych i na rynku.6-11 Do tej pory wiele pochodnych PEG zostało wykorzystanych jako doskonałe materiały wyjściowe do syntezy szeregu nowych materiałów polimerowych do bioaplikacji.12 Na przykład liniowy PEG został zmodyfikowany jako difunkcjonalizowany PEG (DF-PEG), który może być użyty do szybkiego wygenerowania interesującego samoregenerującego się hydrożelu.13,14 Niektóre oligomery PEG zostały wykorzystane do modyfikacji powierzchni nanocząstek nieorganicznych w celu poprawy rozpuszczalności w wodzie i zmniejszenia toksyczności tych materiałów nieorganicznych.15-Niektóre komercyjne monomery na bazie PEG, takie jak akrylan eteru metylowego poli(glikolu etylenowego) (mPEGA) i metakrylan eteru metylowego poli(glikolu etylenowego) (mPEGMA) zostały wykorzystane do przygotowania rozgałęzionych polimerów do późniejszego sprzęgania z białkami, samoorganizacji, dostarczania leków itp.18-27
Chociaż PEG jest zwykle uważany za prawie nietoksyczny, niektóre niebezpieczne problemy związane z PEG o niskiej masie cząsteczkowej zostały zauważone przez badaczy. Smyth i wsp. wykazali przewlekłą toksyczność doustną oligomeru PEG (Mn ∼ 200) u szczurów,28,29 niekorzystne wyniki zaobserwowano również u małp,30 sugerując potencjalne problemy bezpieczeństwa tych „bezpiecznych” materiałów. Dlatego, biorąc pod uwagę szerokie zastosowanie pochodnych PEG w obszarach badawczych, systematyczne badanie cytotoksyczności tych oligomerów PEG i monomerów na bazie PEG jest konieczne i ważne dla ich dalszego zastosowania w dziedzinach biologicznie związanych (Schemat 1).
W obecnej pracy oceniano cytotoksyczność niektórych oligomerów PEG (o różnych ciężarach cząsteczkowych) oraz komercyjnych monomerów na bazie PEG (o różnych grupach końcowych łańcucha) w stosunku do ludzkich komórek raka szyjki macicy (HeLa) oraz linii komórkowej fibroblastów pochodzących od myszy (L929). Zaobserwowano zależną od ciężaru cząsteczkowego cytotoksyczność oligomerów PEG, a także po raz pierwszy ujawniono różne mechanizmy cytotoksyczności oligomerów PEG i monomerów na bazie PEG. Te informacje o cytotoksyczności pochodnych PEG mogą stanowić cenne referencje dla osób wybierających PEG jako materiały wyjściowe i projektujących drogi oczyszczania w celu przygotowania biokompatybilnych materiałów na bazie PEG do dalszych zastosowań biomedycznych.
Materiały i metody
2.1 Substancje chemiczne
Glikol trietylenowy (TEG, 97%, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), akrylan eteru metylowego poli(glikolu etylenowego) 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), metakrylan eteru metylowego glikolu poli(etylenowego) 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) i metakrylan eteru metylowego glikolu poli(etylenowego) 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) stosowano bezpośrednio bez dalszego oczyszczania.
Ludzkie komórki raka szyjki macicy (HeLa) i linię komórkową fibroblastów pochodzących od myszy (L929) pozyskano z American type culture collection (ATCC). Dulbecco’s modified eagle medium (DMEM, Corning-Cellgro), Phosphate Buffered Saline (PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), fetal bovine serum (FBS, Gibco), Roswell Park Memorial Institute 1640 culture medium (RPMI 1640 culture medium, Gibco), penicillin-streptomycin solution (Gibco), trypsin-EDTA (Gibco, 0.25%), 4-(3-(2-metoksy-4-nitrofenylo)-2-(4-nitrofenylo)-2H-tetrazol-3-ium-5-ylo)benzeno-1,3-disulfonian (CCK-8, Beyotime), dioctan 2,7-dichlorodihydrofluoresceiny (DCFH-DA, Beyotime), utleniony glutation (GSSG, Beyotime), fosforan dinukleotydu nikotynamido-adeninowego (NADPH, Beyotime), 5,5′-ditiobis-(kwas 2-nitrobenzoesowy) (DTNB, Beyotime), dioctan fluoresceiny (FDA, Sigma) i jodek propidium (PI, 94%, Sigma) zostały użyte tak jak je zakupiono.
2.2 Hodowla komórek
Hodowla komórek była utrzymywana w inkubatorze o temperaturze 37 °C z 5% CO2, pożywka hodowlana była zmieniana co jeden lub dwa dni w celu utrzymania wykładniczego wzrostu komórek. Komórki HeLa pochodziły z komórek raka szyjki macicy i były hodowane w pożywce DMEM uzupełnionej 10% płodową surowicą bydlęcą (FBS) oraz 1% penicyliną i streptomycyną. Komórki L929 pochodziły od myszy i były hodowane w podłożu RPMI 1640 uzupełnionym 10% płodową surowicą bydlęcą (FBS) i 1% penicyliną i streptomycyną.
2.3 Analiza cytotoksyczności
Wyniki zostały przedstawione jako średnia ± odchylenie standardowe (SD), a wartości pół maksymalnego stężenia hamującego 50% (IC50) pochodnych PEG zostały obliczone przez SPSS 15.0.
Zgodnie z naszą wcześniejszą pracą,32,33 diacetat fluoresceiny (FDA) i jodek propidium (PI) mogą być stosowane jako szybka i wygodna metoda podwójnego barwienia do obserwacji żywotności komórek. Komórki L929 posiano na płytce 24-dołkowej w gęstości ∼5 × 104 komórek na mL. Po przyłączeniu, komórki przemywano PBS i hodowano z różnymi stężeniami pochodnych PEG w podłożu hodowlanym przez 24 h. Następnie usuwano podłoże, a komórki przemywano PBS. Następnie dodawano roztwór mieszany PBS-FDA-PI (FDA: 3 μg mL-1; PI: 3 μg mL-1) i inkubowano płytkę 24-dołkową w temp. 37 °C przez 15 min. Do obserwacji żywych i martwych komórek użyto mikroskopu fluorescencyjnego (Leica Germany) pod 450-490 nm i 515-560 nm pasmowo-przepustowymi filtrami wzbudzającymi (I3 i N2.1), odpowiednio (lampa rtęciowa 100 W).
Skrótowo, komórki L929 zostały posiane na płytce 24-dołkowej i inkubowane w 0,5 mL podłoża hodowlanego z różnymi stężeniami TEG (A, A′) przez 1 h (Fig. 1), studzienki A1-A6 były używane do pomiaru całkowitej ilości glutationu (GSH + GSSG), podczas gdy studzienki A′1-A′6 były używane do pomiaru ilości utlenionego glutationu (GSSG) w obecności TEG. Po 1 h, komórki zbierano przez trawienie trypsyną i wirowanie (1000 rpm, 5 min). Następnie dodawano potrójną objętość roztworu usuwającego białka (50 mg mL-1) w celu usunięcia szumiących białek. Po trzykrotnym szybkim zamrożeniu i rozmrożeniu w ciekłym azocie i w łaźni wodnej w temp. 37°C zawiesinę umieszczano w lodówce (4°C) na 5 min, a próbki supernatantu komórkowego uzyskiwano po odwirowaniu (10 000 rpm, 10 min). Próbki z dołków A1-A6 zostały użyte do pomiaru całkowitego poziomu glutationu (GSH + GSSG). Dodawano roztwór NADPH (0,5 mg mL-1) w celu zredukowania całego glutationu do GSH, następnie stosowano 5,5′-ditiobis-(kwas 2-nitrobenzoesowy) (DTNB) w celu utlenienia GSH, a zmienioną absorbancję przy 405 nm rejestrowano za pomocą czytnika mikropłytek (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Próbki z dołków A′1-A′6 wykorzystano do pomiaru poziomu utlenionego glutationu (GSSG). Dzięki zastosowaniu roztworu usuwającego GSH, w roztworze próbki pozostawiono tylko GSSG. Próbki były analizowane tą samą metodą co powyżej w celu zmierzenia poziomu GSSG. Całkowita ilość glutationu i ilość utlenionego glutationu zostały zebrane w celu obliczenia poziomu zredukowanego glutationu, podczas gdy poziom GSH komórek w czystej pożywce został użyty jako kontrola. Wyniki przedstawiono jako średnie ± SD.
000 rpm, 10 min). Próbki z dołków A1-A6 zostały użyte do pomiaru całkowitego poziomu glutationu (GSH + GSSG). Dodawano roztwór NADPH (0,5 mg mL-1) w celu zredukowania całego glutationu do GSH, następnie stosowano 5,5′-ditiobis-(kwas 2-nitrobenzoesowy) (DTNB) w celu utlenienia GSH, a zmienioną absorbancję przy 405 nm rejestrowano za pomocą czytnika mikropłytek (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Próbki z dołków A′1-A′6 wykorzystano do pomiaru poziomu utlenionego glutationu (GSSG). Dzięki zastosowaniu roztworu usuwającego GSH, w roztworze próbki pozostawiono tylko GSSG. Próbki były analizowane tą samą metodą co powyżej w celu zmierzenia poziomu GSSG. Całkowita ilość glutationu i ilość utlenionego glutationu zostały zebrane w celu obliczenia poziomu zredukowanego glutationu, podczas gdy poziom GSH komórek w czystej pożywce został użyty jako kontrola. Wyniki przedstawiono jako średnie ± SD.
Komórki w linii B i B′ były używane do badania całkowitej ilości GSH i GSSG w obecności mPEGA-480, odpowiednio, poprzez tę samą procedurę.
Wyniki i dyskusja
3.1 Badanie żywotności komórek
Gdy użyto komórki HeLa (model komórek nowotworowych) (Rys. 2A), cytotoksyczność wszystkich oligomerów PEG w niskich stężeniach (≤5 mg mL-1) można było pominąć. Wraz ze wzrostem stężenia (≥10 mg mL-1) obserwowano zależną od masy cząsteczkowej cytotoksyczność próbek PEG. Glikol trietylenowy (TEG) wykazywał oczywistą cytotoksyczność powyżej 10 mg mL-1 (p < 0,05; kontrast z każdym innym oligomerem, gdy stężenie wynosi ponad 5 mg mL-1), a wartość IC50 TEG dla komórek HeLa obliczono na 19,8 mg mL-1. Tymczasem inne oligomery PEG (Mn ∼ 400-4000) również wykazywały niewielką cytotoksyczność.
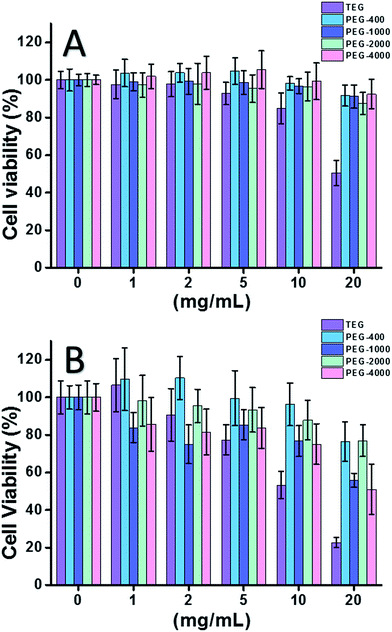
Oceniono również cytotoksyczność oligomerów PEG w stosunku do komórek L929 (model komórek prawidłowych) (ryc. 2B). Zgodnie z oczekiwaniami, żywotność komórek malała wraz ze wzrostem stężenia PEG. Oprócz TEG, niektóre oligomery PEG (PEG-1000, PEG-4000), które są bezpieczne dla komórek HeLa również wykazały wykrywalną cytotoksyczność, wartości IC50 TEG, PEG-1000 i PEG-4000 zostały obliczone jako 12,4, 22,5 i 20,0 mg mL-1 do komórek L929, odpowiednio, również wskazując na zależną od masy cząsteczkowej cytotoksyczność oligomerów PEG.
Powyższe wyniki sugerowały, że komórki HeLa mają lepszą tolerancję na oligomery PEG niż komórki L929 z powodu nieustępliwej żywotności komórek nowotworowych, a TEG ma znacznie wyższą cytotoksyczność niż inne oligomery PEG o wyższych masach cząsteczkowych (p < 0,05; kontrast z każdym innym oligomerem, gdy stężenie jest ponad 5 mg mL-1). Zauważono, że obecne badania wykazały umiarkowaną cytotoksyczność PEG-1000 i PEG-4000 dla komórek L929 oraz prawie niecytotoksyczność PEG-400 i PEG-2000, co różni się od powszechnego wrażenia, że PEG o dużej masie cząsteczkowej powinny być bardziej biokompatybilne niż ich odpowiedniki o małej masie cząsteczkowej. Chociaż powód cytotoksyczności PEG nadal nie jest jasny, PEG-400 i PEG-2000 wydają się być lepszym wyborem dla ludzi do syntezy materiałów biokompatybilnych.
Gdy badano mPEGMA-500, żywotność komórek zarówno HeLa jak i L929 malała wraz ze wzrostem stężenia mPEGMA-500 (Rys. 3A), przy czym nie zaobserwowano wyraźnej różnicy pomiędzy dwoma typami komórek. Wartości IC50 mPEGMA-500 wynoszą 4,7 mg mL-1 dla komórek HeLa i 5,3 mg mL-1 dla komórek L929 po 24 h hodowli, co wskazuje na większą cytotoksyczność mPEGMA-500 niż wyżej wymienionych oligomerów PEG i sugeruje, że grupy końcowe łańcucha pochodnych PEG są kluczowe dla ich toksyczności. Gdy mPEGMA-950, inny metakrylan na bazie PEG z tą samą grupą końcową łańcucha, ale o większej masie cząsteczkowej, badano za pomocą tej samej procedury (rys. 3B), zaobserwowano znacznie niższą cytotoksyczność mPEGMA-950 w stosunku do komórek HeLa lub L929 (p < 0,05; gdy stężenie wynosi ponad 2 mg mL-1), wartości IC50 mPEGMA-950 wynoszą 20,8 mg mL-1 do komórek HeLa i 21.7 mg mL-1 do komórek L929 po 24 h hodowli, również wykazując zależną od masy cząsteczkowej cytotoksyczność metakrylanu na bazie PEG.
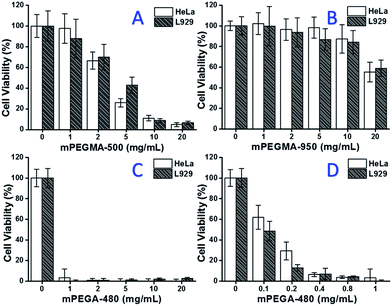
Ponadto badano również akrylan mPEGA-480 na bazie PEG. Chociaż różnica między mPEGA-480 a mPEGMA-500 polega jedynie na obecności grupy metylowej na końcu łańcucha, mPEGA-480 wykazywał ostrą cytotoksyczność (Rys. 3C). Ponad 95% komórek traciło żywotność nawet przy zawartości 1 mg mL-1 mPEGA-480 w medium hodowlanym. W związku z tym, aby określić jego cytotoksyczność, należy przeprowadzić dodatkowe doświadczenia z niższymi stężeniami (ryc. 3D), a wartości IC50 mPEGA-480 zostały obliczone jako 0,2 mg mL-1 do komórek HeLa i 0,1 mg mL-1 do komórek L929 po 24-godzinnej hodowli.
Doświadczenia dotyczące żywotności komórek potwierdziły, że zarówno grupy końcowe łańcucha, jak i masa cząsteczkowa są ważnymi elementami wpływającymi na cytotoksyczność pochodnych PEG, a monomery oparte na PEG wykazywały znacznie bardziej zauważalną cytotoksyczność w porównaniu z oligomerami PEG.
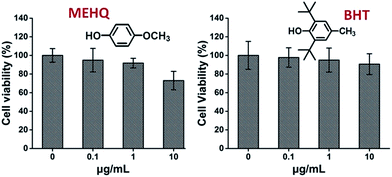
W międzyczasie oceniono również cytotoksyczność inhibitorów w monomerach na bazie PEG, eteru metylowego hydrochinonu (MEHQ, 100 ppm w mPEGA) i butylowanego hydroksytoluenu (BHT, 300 ppm w mPEGMA) (Rys. 4), a komórki L929 zachowały wysoką żywotność (≥90%) przy niskich stężeniach inhibitorów (≤1 μg mL-1). W 1 mg mL-1 mPEGA-480 znajduje się 0,1 μg mL-1 MEHQ, a w 10 mg mL-1 mPEGA-500 – 3 μg mL-1 BHT, przy czym mPEG-480 i mPEGMA-500 wykazują oczywistą cytotoksyczność w tych stężeniach. Tak więc, śladowe ilości inhibitorów w monomerach na bazie PEG wydają się mieć pomijalny wpływ na cytotoksyczność monomerów.
3.2 Obserwacja morfologii komórek
Do bezpośredniej oceny cytotoksyczności pochodnych PEG w stosunku do komórek L929 zastosowano obserwację za pomocą mikroskopu optycznego. Obrazy optyczne komórek L929 eksponowanych na 20 mg mL-1 TEG i 0,1 mg mL-1 mPEGA przez 24 h przedstawiono odpowiednio na Rys. 5A i B.
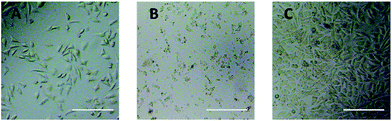
Po inkubacji z 20 mg mL-1 TEG przez 24 h, komórki zachowywały podobną morfologię (Rys. 5A) z grupą kontrolną (Rys. 5C, komórki w czystym medium hodowlanym), ale liczba komórek dramatycznie spadła, wskazując na cytotoksyczność TEG w wysokim stężeniu, co prowadziło do śmierci i następowało oderwanie komórek od dna mikropłytki. Rys. 5B pokazał morfologię komórek L929 po inkubacji z 0,1 mg mL-1 mPEGA-480. Prawie wszystkie komórki straciły normalną morfologię, co sugeruje ostrą cytotoksyczność mPEGA-480 nawet w tak niskim stężeniu.
Dodatkowo komórki były również barwione przy użyciu fluoresceiny. Podwójne barwienie FDA/PI jest szybką, prostą i jednoczesną procedurą umożliwiającą obserwację żywych i martwych komórek.43 FDA może wnikać do wnętrza całych komórek i gromadzić się w nich, dlatego konieczna jest pełna błona komórkowa, aby zapobiec wyciekowi fluoresceiny z komórki. Z kolei PI nie może przejść przez nienaruszoną błonę komórkową, ale może wybarwić jądro martwych komórek, przechodząc przez uszkodzoną błonę komórkową. Jak pokazano na Rys. 6, komórki L929 inkubowane z 20 mg mL-1 TEG mają mniej żywotnych komórek po barwieniu FDA (Rys. 6b) w porównaniu z kontrolą (Rys. 6a), a więcej martwych komórek można zaobserwować po barwieniu PI (Rys. Ostra cytotoksyczność mPEGA-480 była również obserwowana po procedurze podwójnego barwienia FDA/PI, nie można było zidentyfikować zielonego sygnału po inkubacji komórek z 0,1 mgL-1 mPEG-480 przez 24 h (Rys. 6c i c′′).
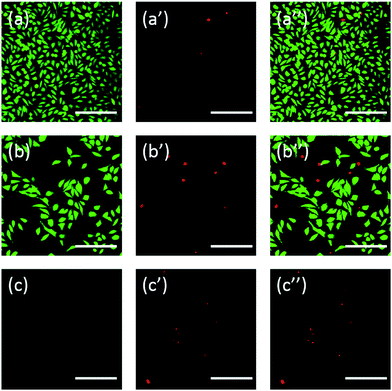
Zarówno obrazy optyczne, jak i fluorescencyjne intuicyjnie wykazały cytotoksyczność tych pochodnych PEG, dodatkowo wspierając wnioski uzyskane poprzez badania CCK-8. Zauważono, że mPEGA-480 wydawał się bardziej toksyczny w teście podwójnego barwienia FDA/PI, co przypisuje się podwójnemu barwieniu FDA/PI, które rozróżnia kompletność żywej/umarłej błony komórkowej, podczas gdy test CCK-8 wykrywa aktywność dehydrogenazy w mitochondriach, sugerując barwienie FDA/PI jako doskonałe uzupełnienie testu CCK-8, aby zaoferować więcej szczegółów statusu komórki.
3.3 Badanie mechanizmu
Zgodnie z eksperymentami żywotności komórek, wartości IC50 oligomerów PEG i monomerów na bazie PEG dla komórek HeLa i L929 po 24 h hodowli zostały obliczone i podsumowane (Tabela 1), sugerując, że monomery na bazie PEG są znacznie bardziej toksyczne dla komórek niż oligomery PEG, a mPEGA ma najwyższą cytotoksyczność. Generowanie ROS i spadek GSH w komórkach, dwa główne mechanizmy cytotoksyczności, były zatem analizowane w celu zbadania możliwej przyczyny cytotoksyczności.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| Komórki HeLa | 19.8 | 32,5 | 36,2 | 38,2 | 29,6 | 4,7 | 20,8 | 0,2 |
| Komórki L929 | 12,4 | 24.7 | 22.5 | 28.7 | 20.0 | 5.3 | 21.7 | 0.1 |
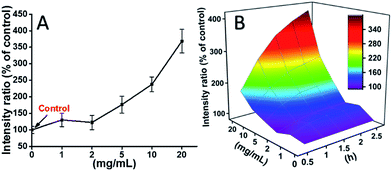
Komórki L929 były inkubowane z TEG, a poziomy ROS w różnych punktach czasowych (0, 0,5, 1,0, 1,5, 2 h) zostały wykryte zgodnie z naszymi poprzednimi raportami i pokazane na Rys. 7. Jako przykład, poziomy ROS po inkubacji z różnym stężeniem TEG przez 2 h zostały pokazane na Rys. 7A. Wyraźnie widać, że poziom ROS utrzymywał się na stałym poziomie przy niskim stężeniu TEG (≤2 mg mL-1), ale znacznie wzrastał, gdy stężenie TEG było wyższe niż 2 mg mL-1, zgodnie z wynikiem eksperymentu żywotności komórek na Rys. 2B. Podobnie, rysunki poziomu ROS vs. stężenie TEG w różnych punktach czasowych zostały narysowane i połączone w celu uzyskania mapy 3D (Rys. 7B). Maksymalny poziom ROS stwierdzono po 2 h z 20 mg mL-1 TEG, wykryto około 400% wzrost poziomu ROS w stosunku do kontroli (poziom ROS = 100), co skutkowało najjaśniejszą intensywnością fluorescencji. Wyniki te sugerują, że generowanie ROS jest możliwym mechanizmem cytotoksyczności TEG, a wysoki poziom ROS indukowany przez TEG może być główną przyczyną apoptozy komórek.
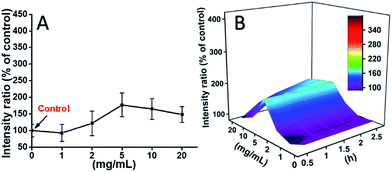
Badano również poziomy ROS indukowane przez mPEGA-480 po 2 h (Rys. 8A). W odróżnieniu od TEG, mPEGA nie powodowała szybkiego wzrostu ROS w komórkach, dopiero ∼170% wzrost ROS w stosunku do kontroli był obserwowany jako maksymalny. Poziom ROS 3D vs. czas mPEGA & (Fig. 8B) pokazał poziom ROS indukowany przez mPEGA-480 jako falę, a grzbiet pojawił się przy umiarkowanym stężeniu mPEGA (5 mg mL-1), nie można zaobserwować znaczącego generowania ROS, co sugeruje, że generowanie ROS może tylko częściowo przyczyniać się do cytotoksyczności mPEGA-480.
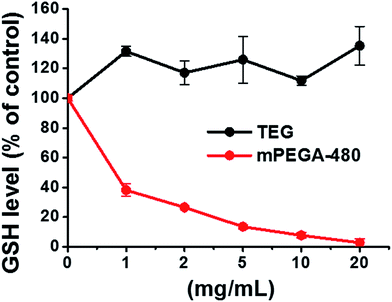
Redukująca grupa tiolowa w GSH jest ważnym źródłem antyoksydacyjnym w organizmach. Możliwy mechanizm cytotoksyczności mPEGA-480 przypisuje się reakcji addycji Michaela pomiędzy grupą tiolową a wiązaniem winylowym, co prowadzi do naruszenia wewnątrzkomórkowej równowagi redoks i apoptozy komórek. Wcześniejsze badania sugerowały, że reakcja addycji Michaela między tiolem i akrylanem jest znacznie szybsza niż między tiolem i metakrylanem,52 co może być uzasadnioną przyczyną różnej ostrej cytotoksyczności między mPEGA-480 i mPEGMA-500.
Wnioski
Po raz pierwszy oceniono cytotoksyczność oligomerów PEG i monomerów na bazie PEG w stosunku do komórek HeLa i L929. Potwierdzono zależną od stężenia cytotoksyczność oligomerów PEG i monomerów na bazie PEG, którą przedstawiono jako wartości IC50 w stosunku do komórek HeLa i L929. PEG-400, PEG-2000 w obecnych badaniach wydają się prawie niecytotoksyczne. PEG-1000, PEG-4000 i mPEGMA-950 wykazywały umiarkowaną cytotoksyczność, zwłaszcza w wysokich stężeniach. TEG i mPEGMA-500 wykazały znaczną cytotoksyczność, a mPEGA-480 – ostrą cytotoksyczność. Ponadto, typy komórek również wpływają na wyniki badań cytotoksyczności, komórki HeLa są bardziej odporne na tolerancję pochodnych PEG niż komórki L929. Te wyniki dotyczące cytotoksyczności pochodnych PEG są wstępne, ale fundamentalne dla ich przyszłego zastosowania biomedycznego, więcej informacji na temat odpowiedzi komórek i zachowania wobec innych pochodnych PEG będzie dalej badane.
Podziękowania
Badania te były wspierane przez National Science Foundation of China (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein i G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan i J. L. Herrera, Am. J. Gastroenterol., 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper and M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang and D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun and H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris and R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese i G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley i J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill and W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner and W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann and A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li and Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao and Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng and Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad and S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan and D. Dixon, Gold Bull, 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li and Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao and Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo i H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka and H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya and C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander and P. Caliceti, Bioconjugate Chem., 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang and K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao and K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh and E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu and W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter i C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter and C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice and S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki and M. Watanabe, Anal. Commun., 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei and X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li and Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang i J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller and C. A. Thorne, Anal. Biochem., 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode and S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown and A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta and S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han and W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel and H. D. Maynard, Chem. Commun., 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake and L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang and P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones and J. A. Senft, J. Histochem. Cytochem., 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim and I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Węgierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Męczyńska-Wielgosz, M. Wojewodzka and M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu and H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li i J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim and M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate and H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch and W. J. Stark, Toxicol. Lett., 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser i P. Wick, Toxicol. Lett., 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer and D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
.
