Opis
Ciało owocnika: o średnicy 8-30 cm, mięsiste, początkowo białe, z wiekiem jasnobrązowe lub żółtawe, kilka głównych odgałęzień wyrastających z wąskiej podstawy, z każdego głównego odgałęzienia wyrastają liczne mniejsze odgałęzienia, na których w rzędach zwisają gęste i stłoczone kolce.
Kręgi: cylindryczne, zaostrzone na wierzchołku, 0,5-1,5 cm długości.
Zarodniki: białe.
Odór: niewyraźny.
Jadalność: jadalny.
Związki bioaktywne
Wczesne badania nad polisacharydami wyizolowanymi z tego grzyba ujawniły, że jest to liniowa cząsteczka zawierająca tylko wiązania α-1,4 glukozydowe. Ponadto polisacharyd różni się od polisacharydów roślin wyższych tym, że składa się wyłącznie z krótkołańcuchowych cząsteczek amylozy (o długości od 32 do 45 jednostek glukozy), podczas gdy u roślin polisacharydy mogą mieć łańcuchy o długości sięgającej tysięcy, w zależności od gatunku (McCracken i Dodd, 1971).
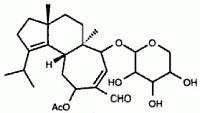
Doświadczenia z użyciem radioznakowanej glukozy sugerują, że D-ksylozyd herical, wyizolowany z kultur H. coralloides, jest uważany za prekursora w syntezie cząsteczek szkieletu cyathane, w tym erinacyny E, omówionej poniżej. Herical jest znany z hamowania szerokiego spektrum grzybów i bakterii oraz wykazuje właściwości cytotoksyczne i hemolityczne (Anke et al., 2002).
Właściwości lecznicze
Aktywność nematyczna
Z kultur H. coralloides otrzymano mieszaninę kwasów tłuszczowych o działaniu nematycznym. Mieszanina ta, zawierająca głównie kwasy linolowy, oleinowy i palmitynowy, wykazała działanie toksyczne wobec Caenorhabditis elegans (Stadler et al., 1994).
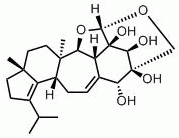
W 1998 roku grupa badawcza Pfizer wyizolowała erinacynę E (patrz struktura poniżej) z bulionu fermentacyjnego H. coralloides (Saito et al., 1998). Erinacyna E jest wysoce selektywnym agonistą receptora opiodowego κ (IC50 0,8 µM w porównaniu z wiązaniem z receptorem opiodowym µ, IC50 >200 mM). Cząsteczka ta została wcześniej wyizolowana z owocników H. erinaceum, gdzie wykazano, że jest silnym stymulatorem syntezy czynnika wzrostu nerwów (Kawagishi i in., 1996). Stymulatory syntezy czynnika wzrostu nerwów są badane jako potencjalne leki w degeneracyjnych zaburzeniach neuronalnych, takich jak choroba Alzheimera oraz w regeneracji nerwów obwodowych (Yamada i in., 1997). Ostatnio opisano całkowitą syntezę erinacyny E (Watanabe i Nakada, 2008).
Linki
Mushroom Expert
Fungi of Poland
Fungi on Wood
Anke T, Rabe U, Schu P, Eizenhofer T, Schrage M, Steglich W.
Studies on the biosynthesis of striatal-type diterpenoids and the biological activity of herical.
Z Naturforsch C. 2002 57(3-4):263-71.
Ginns J.
Hericium coralloides N. amer auct (Hericium americanum sp nov) and the European Hericium alpestre and Hericium coralloides.
Mycotaxon. 1984 20(1):39-43.
Hallenberg N.
Hericium coralloides i Hericium coralloides (basidiomycetes) w Europie.
Mycotaxon. 1983 18(1):181-9.
Kawagishi H, Shimada A, Hosokawa S, Mori H, Sakamoto H, Ishiguro Y, Sakemi S, Bordner J, Kojima N, Furukawa S.
Erinacines E, F, and G, stimulators of nerve growth factor (NGF)-synthesis, from the mycelia of Hericium erinaceum.
Tetra Lett. 1996 37(41):7399-402.
McCracken DA, Dodd JL.
Struktura molekularna polisacharydów typu skrobiowego z Hericium ramosum i Hericium coralloides.
Science. 1971 174(7):419.
Pubmed
Saito T, Aoki F, Hirai H, Inagaki T, Matsunaga Y, Sakakibara T, Sakemi S, Suzuki Y, Watanabe S, Suga O, Sujaku T, Smogowicz AA, Truesdell SJ, Wong JW, Nagahisa A, Kojima Y, Kojima N.
Erinacine E as a kappa opioid receptor agonist and its new analogs from a basidiomycete, Hericium ramosum.
J Antibiot. 1998 51(11):983-90.
Pubmed
Stadler M, Mayer A, Anke H, Sterner O.
Kwasy tłuszczowe i inne związki o aktywności nematobójczej z kultur Basidiomycetes.
Planta Med. 1994 60(2):128-32.
Pubmed
Watanabe H, Nakada M.
Biomimetyczna całkowita synteza (-)-Erinacine E
J Am Chem Soc. 2008 130(4):1150-1.
Yamada K, Nitta A, Hasegawa T, Fuji K, Hiramatsu M, Kameyama T, Furukawa Y, Hayashi K, Nabeshima T.
Orally active NGF synthesis stimulators: potential therapeutic agents in Alzheimer’s disease.
Behav Brain Res. 1997 83(1-2):117-22.
Pubmed
.
