- Metodologia
- Rycina1:Ścieżka obrazowania
- Podejście diagnostyczne i wstępne badania
- Cytologia moczu
- Wstępne badania obrazowe u pacjentów z niskim ryzykiem
- Rycina2:Transitional cell carcinoma of the bladder (US)
- Rycina 3:Renal transitional cell carcinoma (US and RPUG)
- Wstępne badania obrazowe u pacjentów wysokiego ryzyka
- Rycina4:Pęcherzowo-nerkowy TCC (CTU)
- Rycina5:TCC pęcherza moczowego (MRI)
- Rycina6:Ureteric TCC (CTU)
- Rycina7:Guz pęcherza moczowego (cystoskopia)
- Inne badania obrazowe
- Kliniczna kontynuacja
- Tabela2: Wskazania do skierowania
Metodologia
W wyniku elektronicznego przeszukiwania od sierpnia do września 2015 r. bazy MEDLINE poprzez PubMed oraz Cochrane Database of Systematic reviews zidentyfikowano odpowiednie artykuły oryginalne, przeglądy systematyczne i wytyczne oparte na dowodach z okresu 2008-wrzesień 2015 r., które zostały włączone do badania. Następujące terminy zostały użyte w połączeniu podczas przeglądu literatury, aby stworzyć listę artykułów poddanych przeglądowi: „painless”, „macroscopic”, „visible” AND „haematuria”, „kidneys”, „ureters”, „urinary bladder”, „bladder cancer”, „urinary tract”, „cytology”, „diagnostic imaging”, „radiography”, „ultrasonography”, „ultrasound”, „pyelography”, „tomografia, rentgenowska” ORAZ „urografia”, „rezonans magnetyczny” ORAZ „urografia”, „dożylna” LUB „wydalnicza” ORAZ „urografia”, „urologia” LUB „nefrologia” ORAZ „skierowanie” LUB „konsultacja”, „cystoskopia”, „wytyczne”.
Na potrzeby przeglądu przeprowadzono również wyszukiwanie ręczne w celu identyfikacji innych istotnych publikacji z wyszukanych badań. Łącznie wyselekcjonowano 84 pełnotekstowe artykuły, które poddano ocenie pod kątem kwalifikowalności. Uwzględniono prace opisujące badania oryginalne, wytyczne oparte na dowodach lub przeglądy systematyczne, natomiast wykluczono badania pediatryczne i badania na zwierzętach. Wykluczono również artykuły, które nie były w języku angielskim lub zawierały ograniczony tekst. Ostatecznie uwzględniono 59 artykułów i oceniono je zgodnie z Oxford Centre for Evidence-Based Medicine Levels of Evidence . Ścieżki oparte na dowodach zostały opracowane i zweryfikowane przez ekspertów panelu redakcyjnego Diagnostic Imaging Pathways (DIP) zgodnie z typowymi procesami DIP (http://www.imagingpathways.health.wa.gov.au/index.php/production/processes-for-creating-and-managing-content), w porozumieniu z redaktorem, urologiem i nefrologiem. Ostateczny algorytm (ryc. 1), który jest również dostępny na stronie Imaging Pathways (Online clinical decision-making tool: Dulku G. Painless Macroscopic Haematuria. Diagnostic Imaging Pathways; wrzesień 2015), zawiera wytyczne i zalecenia dotyczące obrazowania u dorosłych pacjentów z niewyjaśnioną, bezbolesną, widoczną hematurią.
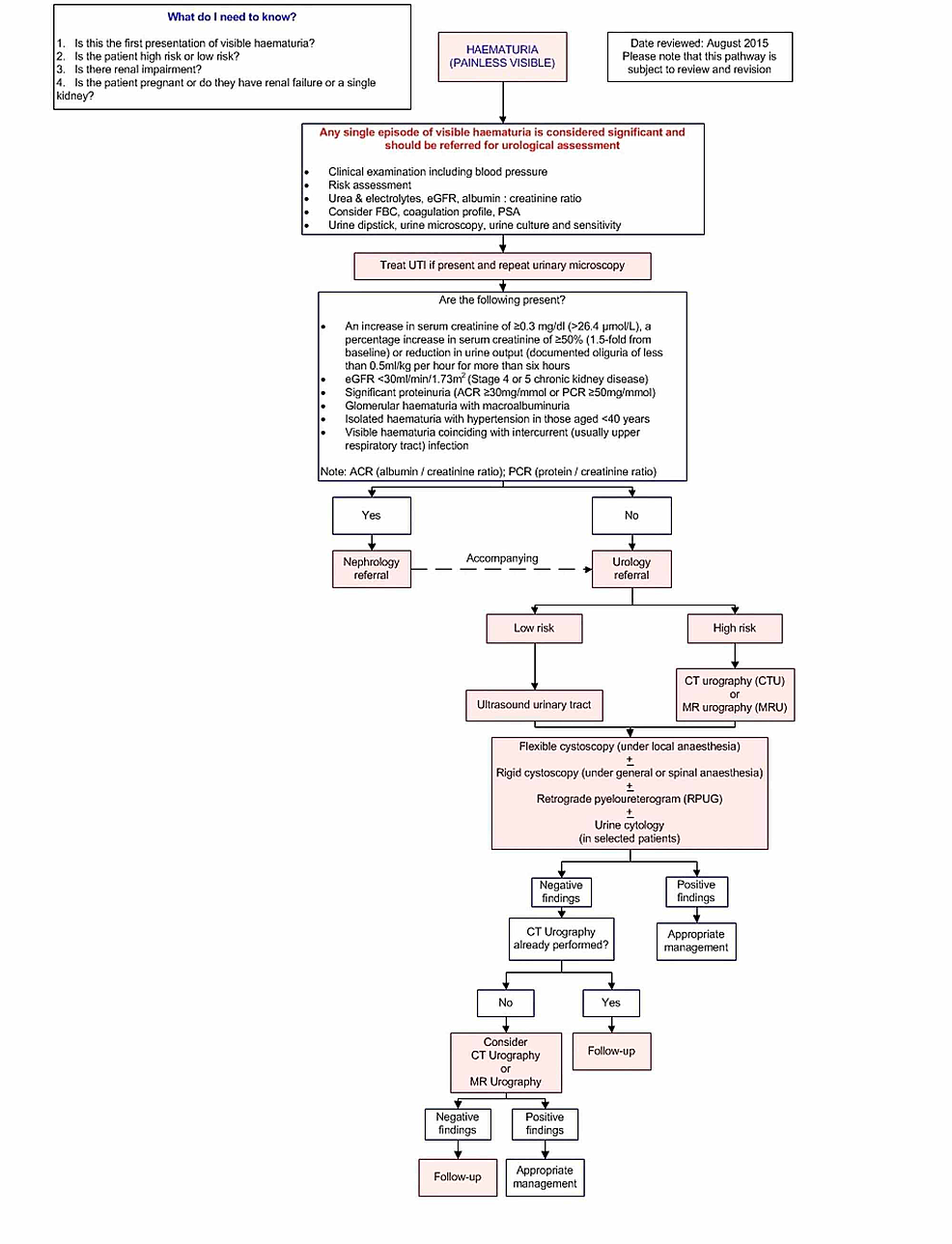
Rycina1:Ścieżka obrazowania
Ścieżka ta zawiera wytyczne dotyczące obrazowania dorosłych pacjentów z niewyjaśnioną, bezbolesną, widoczną hematurią.
eGFR: Szacowany współczynnik filtracji kłębuszkowej; FBC: Full blood count; PSA: Prostate-specific antigen; ACR: Albumin/creatinine ratio; PCR: Stosunek białko/kreatynina; UTI: Zakażenie dróg moczowych.
Nasz przegląd nie obejmował analizy wytycznych dotyczących obrazowania w celu wykrycia kamieni moczowych jako przyczyny krwiomoczu, ponieważ zazwyczaj wiąże się to z bólem. Skoncentrowaliśmy się przede wszystkim na wytycznych dotyczących obrazowania i literaturze pomocniczej dotyczącej bezbolesnego, widocznego krwiomoczu z urologicznymi nowotworami złośliwymi jako potencjalną przyczyną.
Podejście diagnostyczne i wstępne badania
Konsensus British Association of Urological Surgeons (BAUS) i Interregional Chiefs of Urology Service (IRCUS), Kaiser Permanente, Ameryka sugeruje, że każdy pojedynczy epizod VH jest uważany za znaczący i powinien być skierowany do oceny urologicznej, która w prawie wszystkich przypadkach będzie obejmować cystoskopię.
W międzyczasie można przeprowadzić badania w celu zidentyfikowania przemijających, uleczalnych przyczyn i zorganizować podstawowe obrazowanie. Pacjenci z VH i potwierdzoną infekcją dróg moczowych (UTI) powinni być nadal badani pod kątem współistnienia nowotworu złośliwego, ponieważ nowotwór złośliwy często współistnieje z infekcją lub działa jak nidus, z którego infekcja może się rozprzestrzeniać. Infekcja dróg moczowych powinna być leczona przed cystoskopią, ponieważ istnieje ryzyko posocznicy, jeśli cystoskopia jest wykonywana w obecności aktywnej UTI.
Obecność VH nie powinna być również przypisywana terapii przeciwzakrzepowej lub przeciwpłytkowej, a ci pacjenci powinni być również oceniani niezależnie od tych leków, ponieważ doniesienia o leżącej u podstaw złośliwości zostały znalezione u 24% i 7% pacjentów w dwóch oddzielnych seriach .
W związku z tym podstawową rolą obrazowania jest identyfikacja tych pacjentów ze złośliwą przyczyną hematurii. Wybór metody obrazowania zależy jednak od różnych indywidualnych czynników dotyczących pacjenta (np. wieku, czynników ryzyka złośliwości, czynności nerek i ciąży) oraz innych czynników, takich jak lokalna polityka i praktyka, efektywność kosztowa i dostępność zasobów .
Tradycyjnie badania pierwszego rzutu obejmowały konwencjonalną radiografię, ultrasonografię nerek (USG) i/lub dożylny pyelogram (IVP) w połączeniu z cystoskopią. To ostatnie jest ważne, ponieważ wiele krwawiących zmian w drogach moczowych powstaje w pęcherzu moczowym, a procedury obrazowania nie są jeszcze ostatecznie udowodnione jako tak czułe jak cystoskopia w rozpoznawaniu większości z nich.
Badania drugiego rzutu obejmują urogram wielodetektorowej tomografii komputerowej (MDCTU) i urografię rezonansu magnetycznego (MRU), często wykonywane tylko wtedy, gdy badania pierwszego rzutu wykazują nieprawidłowości.
IRCUS zalecił wykonanie zmodyfikowanej CTU lub IVP z jednoczesnym USG nerek u pacjentów z istotnym krwiomoczem. Nie ma potrzeby wykonywania tomografii nerek przy dożylnej urografii (IVU), jeśli jednocześnie wykonywane jest USG nerek. Takie podejście zmniejszy ekspozycję na promieniowanie jonizujące .
Przy zalecaniu badań obrazowych do oceny VH, Cowan zasugerował, że rodzaj zastosowanej metody obrazowania powinien być oparty na ocenie ryzyka, przy czym pacjenci >40 lat powinni być poddawani urografii CT, a pacjenci <40 lat powinni być poddawani ultrasonografii jako metodzie obrazowania pierwszego rzutu . European Society of Urogenital Radiology (ESUR) zasugerowało, że badanie pacjentów z niskim ryzykiem wymaga USG i cystoskopii, a pacjenci z wysokim ryzykiem wymagają tomografii komputerowej i cystoskopii w celu dokładnego obrazowania nerek i dróg moczowych.
Cytologia moczu
Cytologia moczu, choć kontrowersyjna, jest niezbędna do oceny raka urotelialnego górnych dróg moczowych (UUT-UCC), a wytyczne Europejskiego Towarzystwa Urologicznego (EAU) zalecają, aby cytologia moczu była wykonywana jako część standardowego badania diagnostycznego. Cytologia moczu ma czułość 25%, swoistość 91%, wysoką dodatnią wartość predykcyjną, ale niską ujemną wartość predykcyjną .
Jednakże cytologia moczu ma wysoki wskaźnik fałszywie ujemny w wykrywaniu złośliwości, a ujemna cytologia nigdy nie może całkowicie wykluczyć obecności guza pęcherza moczowego, cystoskopia jest uzasadniona we wszystkich przypadkach.
Liczne dostępne komercyjnie testy na biomarkery przenoszone przez mocz obejmują BTA TRAK, ImmunoCyt/uCyt+, CxBladder, Nuclear Matrix Protein 22 (NMP-22) i UroVysion (FISH), chociaż mogą one przeoczyć znaczny odsetek pacjentów z rakiem pęcherza moczowego, szczególnie gdy ich dokładność jest słaba w przypadku guzów o niskim stopniu zaawansowania i niskim stopniu złośliwości. Z tych powodów nie osiągnięto konsensusu co do roli cytologii moczu i/lub markerów nowotworowych pęcherza moczowego w ocenie pacjentów z krwiomoczem.
Wstępne badania obrazowe u pacjentów z niskim ryzykiem
ESUR zasugerował, że badanie pacjentów z niskim ryzykiem wymaga USG i cystoskopii, a pacjenci z wysokim ryzykiem wymagają tomografii komputerowej i cystoskopii w celu dokładnego obrazowania nerek i dróg moczowych. Czułość USG nie jest jednak wystarczająca, aby wyeliminować potrzebę cystoskopii z powodu braku czułości w wykrywaniu małych guzów pęcherza moczowego, szczególnie tych o średnicy mniejszej niż 0,5 cm. Ultradźwięki (USG) są ważne we wstępnej ocenie hematurii, a poza tym, że są łatwo dostępne i niedrogie, nie wiążą się z narażeniem na promieniowanie jonizujące i są szczególnie przydatne w populacjach wrażliwych na promieniowanie, takich jak dzieci i kobiety w ciąży lub w wieku rozrodczym. Ultrasonografia pozwala również na nieograniczoną liczbę płaszczyzn skanowania, co umożliwia dobrą wizualizację nerek i pęcherza moczowego. Dodatkowo badania dopplerowskie mogą dostarczyć dalszych informacji na temat unaczynienia mas (Rycina 2A, 2B).
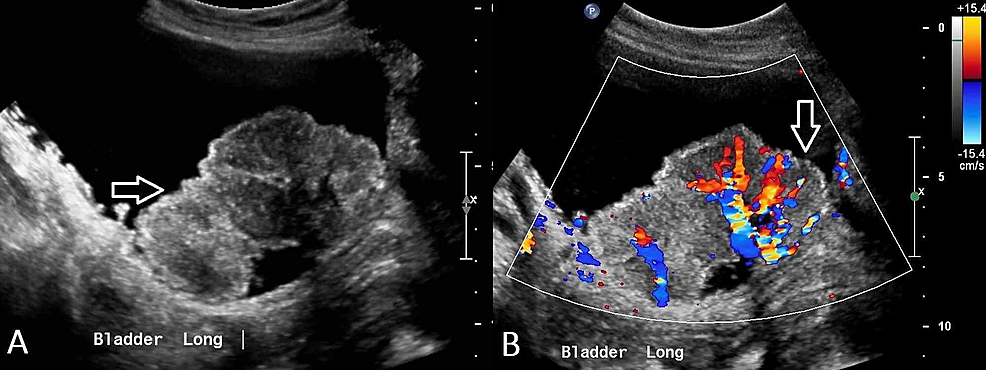
Rycina2:Transitional cell carcinoma of the bladder (US)
(A) USG miednicy wykazuje nieregularny, niejednorodny w obrębie pęcherza moczowego z wieloma mniejszymi zmianami polipowatymi widocznymi w sąsiedztwie, co sugeruje raka pęcherza moczowego. (B) Vascularity is demonstrated within this mass.
In the detection of UUT tumours, US ma zmienną czułość w wykrywaniu raków urotelialnych, z umiarkowaną czułością (82%) w wykrywaniu raka nerkowokomórkowego i niską czułością (12%) w wykrywaniu raka urotelialnego moczowodu. Jednak w porównaniu z IVP w wykrywaniu nieprawidłowości UUT u pacjentów z krwiomoczem, USG jest bardziej czułe w wykrywaniu guzów nerek i pęcherza moczowego, z wyższą czułością (96% w porównaniu z 25%) i ujemną wartością predykcyjną (98% w porównaniu z 91%) odpowiednio .
Ponadto USG jest również użyteczne w wykrywaniu wodonercza i/lub wodonercza, które mogą być następstwem guzów pęcherza moczowego utrudniających połączenie pęcherzowo-moczowodowe (ryc. 3). Niemniej jednak, w porównaniu z obrazowaniem przekrojowym, takim jak MDCTU lub MRU, USG ma mniejszą czułość w wykrywaniu nieprawidłowości układu moczowego.
Ultrasonografia jest doskonała w określaniu, czy masa jest torbielowata czy nie oraz czy zmiana torbielowata jest torbielą prostą, minimalnie powikłaną lub powikłaną. Zmiany, które nie są torbielami prostymi, wymagają dalszych badań za pomocą tomografii komputerowej (TK) lub rezonansu magnetycznego (MRI). Badanie USG z kontrastem (Contrast-enhanced US) jest obiecującą alternatywą we wstępnych badaniach mas nerkowych. Przedstawione wyniki badania CEUS w ocenie podejrzanych litych lub złożonych mas torbielowatych sugerują podobną wartość CEUS w porównaniu z CT. Zaletami CEUS są brak nefrotoksyczności, brak promieniowania jonizującego i możliwość oceny obrazu wzmocnienia w czasie rzeczywistym, co może być wykonane podczas pierwszego badania pacjenta. Miejsce CEUS w algorytmie diagnostycznym wymaga jednak dalszego wyjaśnienia.
W związku z tym wykorzystanie USG jako metody obrazowania pierwszego rzutu w ocenie hematurii wydaje się uzasadnione. Biorąc pod uwagę, że samo USG może potencjalnie przeoczyć zmiany w moczowodach i urotelialu, konieczna jest dalsza ocena za pomocą cystoskopii, a pirelomocznikografia wsteczna jest przydatnym uzupełnieniem (ryc. 3).
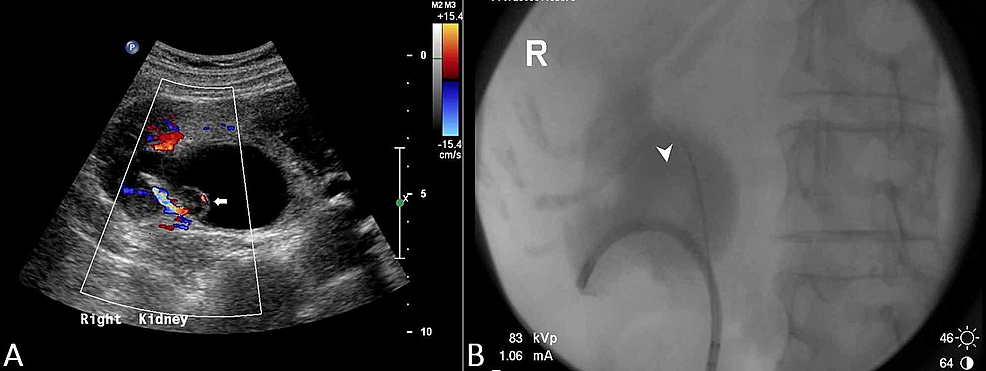
Rycina 3:Renal transitional cell carcinoma (US and RPUG)
(A) Ultrasound pelvis demonstrates a diffusely thickened proximal right ureter with a papillary lesion (arrow) seen within the right renal pelvis, and resultant right hydronephrosis. (B) Odpowiada to wynikom wstecznego pyelo-ureterogramu (RPUG) (głowa strzałki), co sugeruje niedrożność raka przejściowokomórkowego prawych górnych dróg moczowych.
Wstępne badania obrazowe u pacjentów wysokiego ryzyka
Urografia TK
Urografia TK (określana również jako CT IVP, chociaż preferowanym terminem jest CTU) przewyższa USG, IVU, i radiografię w ocenie mas miąższowych nerek i kamieni moczowych z czułością i swoistością dla nowotworów złośliwych górnych dróg moczowych wynoszącą odpowiednio 67-100% i 93-99%.
W przypadku wszystkich innych kategorii pacjentów, w tym młodszych pacjentów i pacjentów z bardziej łagodnymi wskazaniami i niższym prawdopodobieństwem wystąpienia raka przed badaniem, USG jest metodą obrazowania pierwszego rzutu . Modyfikacje techniki badania urografii TK, polegające na ograniczeniu protokołów i kombinacji faz skanowania, mogą być stosowane alternatywnie lub uzupełniająco w stosunku do innych badań obrazowych .
Protokół skanowania powinien obejmować: skanowanie bez kontrastu, fazę nefrograficzną (90-100 sekund po podaniu bolusa kontrastu) i fazę wydalniczą (lub pyelograficzną) (5-15 minut po podaniu kontrastu) . Faza korowo-śródmiąższowa jest przydatna w wybranych przypadkach, np. przy podejrzeniu tętniaka rzekomego lub pseudotumora. Rutynowa akwizycja w tej fazie może nie być uzasadniona. Obrazy bez kontrastu są przydatne do wykrywania kamicy nerkowej. Faza nefrograficzna ma największą czułość w wykrywaniu mas nerkowych, a do jednoznacznego wzmocnienia konieczna jest korelacja z obrazami niewzmocnionymi. Faza pyelograficzna/wydalnicza służy do oceny układu zbiorczego, moczowodów i pęcherza moczowego, przy czym zastosowanie technik rozszerzania moczowodów, takich jak ucisk, dożylne podanie bolusa soli fizjologicznej i leków moczopędnych, daje różne wyniki. Urografia TK może również wykrywać choroby pozamoczowodowe .
W przeciwieństwie do guzów urotelialnych, wielu pacjentów z nowotworami złośliwymi nerek pozostaje bezobjawowych aż do późnych stadiów choroby, biorąc pod uwagę, że zdecydowana większość nowotworów nerek jest mała i wykrywana przypadkowo. Ponadto masy nerkowe rzadko naciekają na układ zbiorczy. W konsekwencji klasyczna triada: ból w dole brzucha, krwiomocz i wyczuwalna palpacyjnie masa nerki w przypadku raka nerkowokomórkowego (RCC) występuje u co najwyżej 6-9% pacjentów, a jej obecność silnie sugeruje miejscowo zaawansowaną chorobę i złe rokowanie. W tym przypadku CT i MRI są zalecane do wykonania i uważane za równorzędne w ocenie zaawansowania i diagnostyce (ryc. 4, 5). Oczekuje się jednak badań porównawczych między TK i MRI o wysokim polu obrazowania. W międzyczasie MRI może być stosowany w wybranych przypadkach do rozwiązywania problemów. W wykrywaniu i charakterystyce zmian chorobowych może być również przydatny dyfuzyjny rezonans magnetyczny (DWI), ale przeglądy systematyczne wskazują jedynie na jego umiarkowaną dokładność.
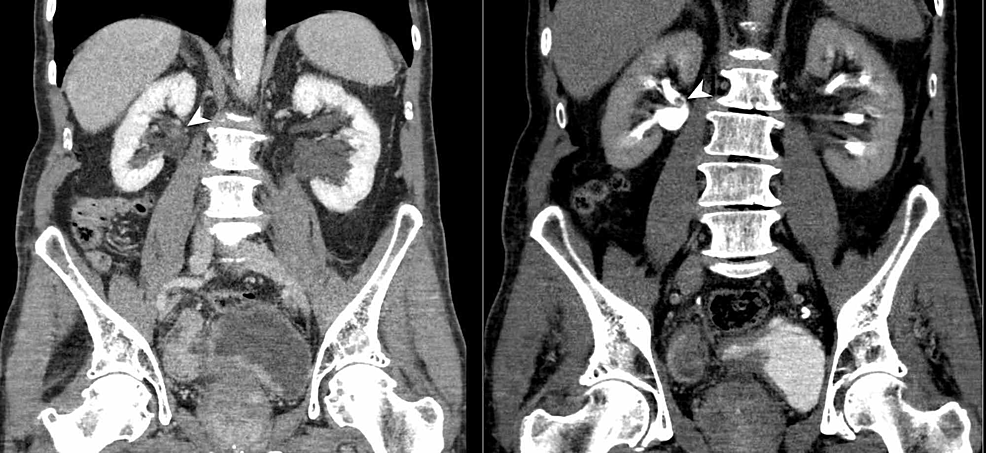
Rycina4:Pęcherzowo-nerkowy TCC (CTU)
CT urografia (reformat koronalny) wykazuje nieregularne pogrubienie ściany pęcherza moczowego, a także bezsekcyjny polipowaty ubytek wypełnienia w tylnym aspekcie prawej miedniczki nerkowej (główki strzałek). Wyniki sugerują wieloogniskowego raka przejściowokomórkowego dróg moczowych (TCC).
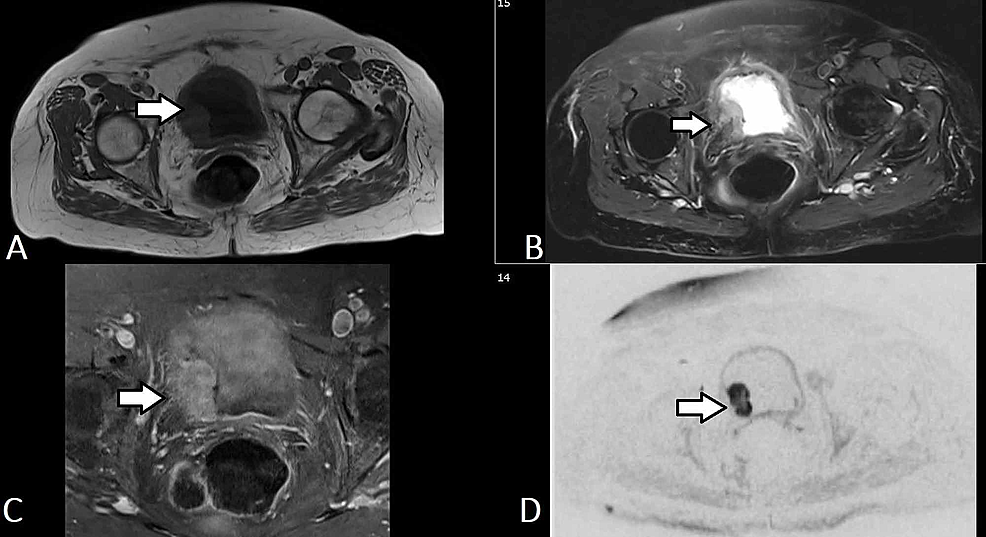
Rycina5:TCC pęcherza moczowego (MRI)
(A-D) Wybrane osiowe obrazy urografii MR u tego samego pacjenta wykazują zrazikową masę (strzałka) wyrastającą z prawej bocznej ściany pęcherza moczowego, która rozciąga się do trigonu i wnika w ścianę pęcherza moczowego, obejmując warstwę zewnętrzną bez rozszerzenia na tłuszcz okołopęcherzowy. Masa jest o niskiej intensywności sygnału T1 i wysokiej intensywności sygnału T2. Masa wykazuje stosunkowo jednorodne, rozsiane wzmocnienie kontrastowe i wyraźne ograniczenie dyfuzji (b50/400/800). Konstelacja wyników odzwierciedla guz pęcherza moczowego, który jest prawdopodobnie klasyfikowany jako T2b No Mx.
TCC: Transitional cell carcinoma
Klasyfikacja Bosniaka torbielowatych mas nerkowych opiera się na charakterystyce obrazowania w tomografii komputerowej z wzmocnieniem kontrastowym i jest pomocna w przewidywaniu ryzyka złośliwości oraz dostarczaniu wskazówek dotyczących postępowania. Ryzyko złośliwości dla zmian torbielowatych typu Bosniak 1, 2, 2F, 3 i 4 wynosi odpowiednio 0%, 0%, 25%, 54% i 100%.
Urografia TK może być również skuteczna w diagnostyce guzów pęcherza moczowego. Wyniki mogą się jednak różnić w zależności od badanej populacji. W grupie wysokiego ryzyka jednoznaczne wyniki CTU były czułe w 93% i swoiste w 99% w wykrywaniu raka pęcherza moczowego, a ogólna negatywna wartość predykcyjna (NPV) wynosiła 95%. Wysoka wartość NPV CTU może wyeliminować cystoskopię u tych wybranych pacjentów, chociaż cystoskopia pozostaje złotym standardem w wykrywaniu nowotworów dolnych dróg moczowych, w tym nowotworów urotelialnych pęcherza moczowego, ponieważ ani IVP, ani MDCTU konsekwentnie nie mają wystarczająco dużej czułości, aby wykluczyć nieprawidłowości błony śluzowej pęcherza moczowego.
Dawki promieniowania budzą obawy w przypadku MDCTU i można je zmniejszyć, ograniczając liczbę faz obrazowania poprzez zastosowanie dwuenergetycznej tomografii komputerowej (DECT) lub techniki split-bolus. Dodatkowo, (25) pominięcie akwizycji niewzmocnionej powoduje zmniejszenie ekspozycji na promieniowanie o prawie 50%.
DECT dostarcza informacji o tym, jak substancje zachowują się przy różnych energiach, możliwość generowania wirtualnych zestawów danych niewzmocnionych oraz lepsze wykrywanie substancji zawierających jod na obrazach niskoenergetycznych. Inne zalety DECT to dobra rejestracja czasowa i przestrzenna oraz dobra separacja spektralna pomiędzy skanami wysokoenergetycznymi i niskoenergetycznymi, łatwa do wyrównania dawki i szumu. W prospektywnym badaniu wykazano, że jednofazowa urografia DECT z synchronicznym wzmocnieniem fazy nefrograficzno-wydzielniczej stanowi dokładne podejście „wszystko w jednym” z oszczędnością dawki promieniowania do 45% w porównaniu ze standardowym protokołem dwufazowym z dobrą opakeracją w 86.9% przypadków i doskonałymi lub dobrymi wirtualnymi obrazami bez wzmocnienia (VUE) w 83,3% przypadków .
Z drugiej strony, split-bolus MDCTU zapewnia co najmniej 50% opakerfikację większości segmentów UUT z wysoką czułością (88.9-100%), swoistością (99-99,5%) i dokładnością (98,5-99,5%) w wykrywaniu guzów górnych dróg moczowych (ryc. 6) .
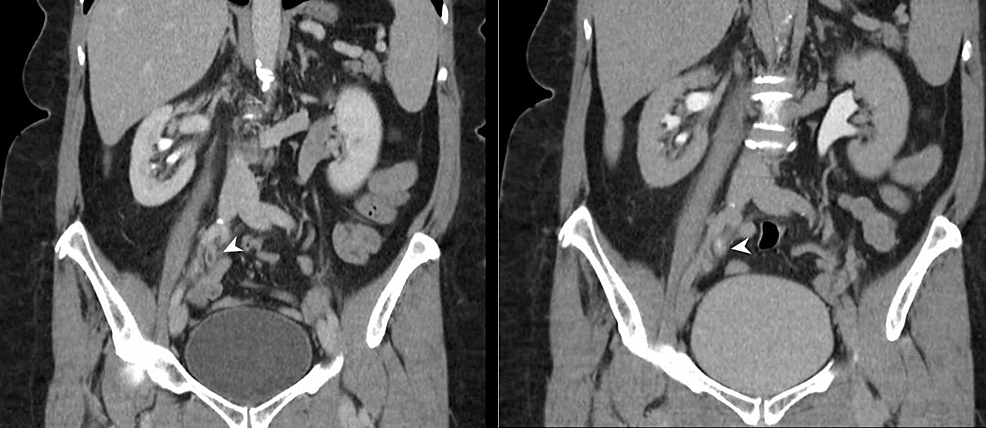
Rycina6:Ureteric TCC (CTU)
CT urografia (reformaty koronalne) wykazuje 4-cm segment obwodowego pogrubienia urotelialnego w miejscu połączenia moczowodu środkowego i dystalnego prawego (główki strzałek) z nieprawidłowym wzmocnieniem urotelialnym. Widoczna jest wtórna niedrożność prawego układu zbiorczego z punktem przejściowym na poziomie nieprawidłowego pogrubienia urotelialnego, co jest wysoce podejrzane dla prawostronnego urotelialnego TCC.
TCC: Transitional cell carcinoma
Urografia rezonansem magnetycznym
Obrazowanie rezonansem magnetycznym jest przydatne w diagnostyce i ocenie zaawansowania nowotworów złośliwych nerek, pęcherza moczowego i gruczołu krokowego oraz w ocenie czynności nerek. Służy jako alternatywna technika obrazowania dla populacji wrażliwej na promieniowanie, w tym dzieci i kobiet w ciąży; osób wymagających powtarzanych badań dróg moczowych oraz osób z przeciwwskazaniami do stosowania jodowanych środków kontrastowych .
Pełny protokół MRU może być stosowany do obrazowania wszystkich elementów nerek i układu zbiorczego moczu w jednej sesji obrazowania. Urografia MR jest wykonywana dwiema głównymi metodami: statyczno-płynowa urografia z ultraszybkimi sekwencjami T2-ważonymi, podobnymi do tych stosowanych w cholangiopankreatografii rezonansu magnetycznego (MRCP), oraz sekwencje T1-ważone urografii wydalniczej po dożylnym podaniu kontrastu gadolinowego .
Statyczno-płynna MRU jest preferowana w stosunku do wydalniczej MRU w obrazowaniu pacjentów z upośledzoną funkcją nerek, pacjentów w ciąży i pacjentów z niedrożnością moczowodów, szczególnie gdy istnieje uzasadnione ryzyko nefrogennego włóknienia układowego . Jednak biorąc pod uwagę, że sekwencje T2-ważone są wykonywane bez dożylnego podawania kontrastu, modyfikacje obrazowania są często konieczne w celu optymalizacji obrazowania moczowodów.
Obrazowanie moczowodów można również poprawić, szczególnie w MRU wydalniczym, po podaniu dożylnego materiału kontrastowego, roztworu soli fizjologicznej i diuretyku w celu uzyskania bardziej jednolitego rozkładu kontrastu. Chociaż dowody ujawniają, że DWI wykazuje jedynie umiarkowaną dokładność w przewidywaniu złośliwości nerek, jego wydajność jako niezależnego testu jest nadal niesprawdzona . Dodanie DWI do obrazowania T1- i T2-ważonego zwiększa czułość w identyfikacji raka UUT z doskonałą zgodnością międzyobserwacyjną. W szczególności kombinacja T2WI+DWI wykazuje czułość pomiędzy 92-98% w rozpoznawaniu guzów pęcherza moczowego (Rycina 5).
Wady MRU obejmują koszt, dostępność, dłuższy czas akwizycji, degradację obrazu z powodu artefaktów ruchowych, niższą rozdzielczość przestrzenną i pewność diagnostyczną w wykrywaniu nowotworów złośliwych urotelialnych w porównaniu z CTU. Oczekuje się jednak, że opracowanie szybszych sekwencji i optymalizacja protokołów 3-T MRI rozwiąże te problemy .
Cystoskopia
Cystoskopia jest nadal metodą z wyboru w ocenie pęcherza moczowego i nie powinna być zastępowana przez żadną technikę obrazowania układu wydalniczego . Ostatnie wytyczne EAU zalecają również, aby cystoskopia była wykonywana w celu wykluczenia współistniejącego guza pęcherza moczowego (Rycina 7) w przypadku rozpoznania raka UUT, szczególnie gdy autorzy wykazali godne uwagi fałszywie dodatnie i fałszywie ujemne wyniki CTU i MRU w wykrywaniu guzów pęcherza moczowego w porównaniu z histopatologią u pacjentów z widocznym krwiomoczem . Cystoskopia powinna być wykonywana praktycznie u wszystkich pacjentów z bezbolesnym, widocznym krwiomoczem.
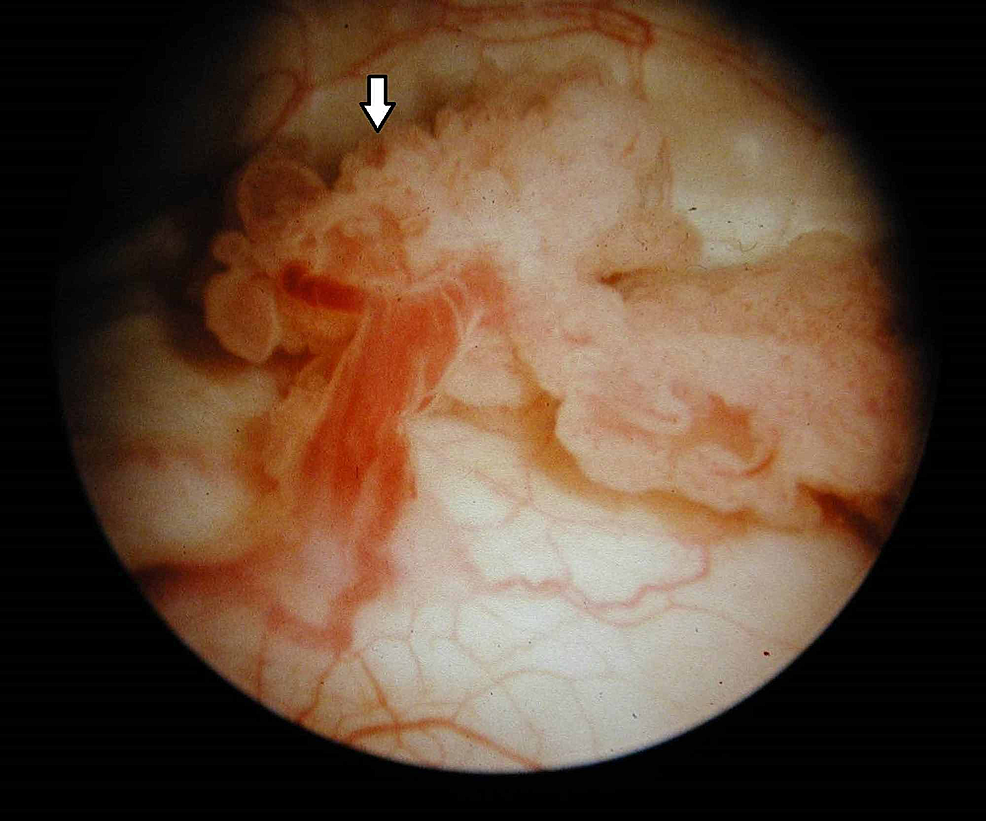
Rycina7:Guz pęcherza moczowego (cystoskopia)
Cystoskopia ujawnia egzofityczną, kalafiorowatą narośl z delikatnymi listkami i obszarami owrzodzenia, co wskazuje na nowotwór złośliwy pęcherza moczowego (strzałka).
Cystoskopia giętka jest prostą, szybką i bezpieczną procedurą wykonywaną w znieczuleniu miejscowym jako przypadek jednodniowy, dającą niezawodną pewność i pozwalającą pacjentom operowanym na postawienie diagnozy i przygotowanie do operacji podczas tej samej wizyty .
Z drugiej strony, cystoskopia sztywna jest wykonywana w znieczuleniu ogólnym lub rdzeniowym, szczególnie gdy przewidywane są bardziej złożone procedury dodatkowe. Retrograde pyelo-ureterogram (RPUG) można wykonać w czasie sztywnej cystoskopii w celu zobrazowania górnych dróg moczowych, jeśli wcześniej nie wykonano CTU .
Inne badania obrazowe
Retrograde pyelo-ureterography
CT urogram okazał się mieć większą dokładność diagnostyczną niż RPUG w wykrywaniu zmian urotelialnych . W związku z tym uzasadnione jest stosowanie CTU przed RP, jako pojedynczego, nieinwazyjnego i kompleksowego badania, które umożliwia jednoczesną diagnostykę i/lub ocenę stopnia zaawansowania.
Pirolografia wsteczna może być nadal stosowana jako badanie drugiego rzutu w celu dalszego scharakteryzowania wad wypełnienia wykrytych w innych metodach, niediagnostycznej CTU lub u pacjentów z niewydolnością nerek lub w przypadkach uczulenia na środek kontrastowy. Retrograde pyelo-ureterografia może uwidocznić jedynie światło moczowodu i nie może bezpośrednio zobrazować zewnątrzpochodnych nieprawidłowości (Rycina 3).
Radiografia nerek, moczowodów i pęcherza moczowego (Plain X-ray KUB)
Plain X-ray KUB ma obecnie niewielką wartość w badaniu pacjentów z bezbolesnym krwiomoczem i nie jest stosowana jako metoda obrazowania pierwszego rzutu.
Urografia zewnątrzwydzielnicza/Urografia dożylna (IVU)
Urografia dożylna jest dobrym wyborem w ocenie chorób urotelialnych i wewnątrzmiedniczkowych, ale nie jest wystarczająco czuła w wykrywaniu mas nerkowych o wielkości <2-3 cm i obecnie została zastąpiona przez tomografię komputerową (CTU) w obrazowaniu UUT. Nie zaleca się już badania krwiomoczu u pacjentów z grupy wysokiego ryzyka wyłącznie za pomocą IVU.
Jej główną zaletą jest to, że IVU obrazuje cały UUT z dużą rozdzielczością przestrzenną, a także dostarcza informacji strukturalnych oraz ograniczonych danych czynnościowych. Jest to często najbardziej opłacalny test w wielu ośrodkach .
Jednakże wady IVU obejmują długi czas akwizycji, potencjalnie niebezpieczne reakcje kontrastowe, wymagające przygotowania jelita i narażenia na znaczne obciążenie promieniowaniem. Jego względna niedokładność jest jego główną wadą i wkrótce będzie przestarzały .
Kliniczna kontynuacja
Istnieje ryzyko, że 1-3% pacjentów z negatywnym workup rozwija złośliwy w ciągu trzech lat, jeśli pozostawione bez kontroli . Panel najlepszej polityki Amerykańskiego Towarzystwa Urologicznego (AUA) zaleca lekarzom podstawowej opieki zdrowotnej sprawdzanie VH, nowych objawów ze strony układu moczowego i dodatniej cytologii co sześć miesięcy przez trzy lata, a jeśli do tego czasu wyniki będą stale ujemne, można zaprzestać obserwacji. BAUS zaleca ponowne skierowanie do urologa, jeżeli w trakcie obserwacji w ramach podstawowej opieki zdrowotnej wystąpi VH lub objawowa niewidoczna hematuria (NVH), której czas trwania nie został jasno określony. The Best Practice Advocacy Centre New Zealand zaleciło coroczne monitorowanie w przypadku przyczyn nefrologicznych przy pomocy bagnetu moczu, ciśnienia krwi, eGFR i stosunku albumin do kreatyniny w moczu/proteiny do kreatyniny (ACR/PCR), gdy utrzymuje się hematuria, oraz corocznie przez dwa lata w przypadku przyczyn urologicznych przy pomocy bagnetu moczu, eGFR, ACR/PCR i cytologii. Inicjatywa ta pozwala na prowadzenie obserwacji w ramach podstawowej opieki zdrowotnej, aby uspokoić pacjentów, którzy mają obawy związane z utrzymującym się krwinkomoczem, który może być przerywany, ale utrzymuje się pomimo negatywnych wyników badań. Wskazania do skierowania nefrologicznego i urologicznego podsumowano w tabeli 2 .
Skierowanie nefrologiczne
Zwiększenie stężenia kreatyniny w surowicy o ≥0.3 mg/dl (>26,4 µmol/L), procentowy wzrost stężenia kreatyniny w surowicy o ≥50% (1,5-krotny w stosunku do wartości wyjściowej) lub zmniejszenie ilości oddawanego moczu (udokumentowana oliguria poniżej 0.5 ml/kg na godzinę przez ponad sześć godzin
Znaczący białkomocz (ACR ≥30 mg/mmol lub PCR ≥50 mg/mmol) oprócz krwiomoczu nasuwa podejrzenie samoistnej choroby nerek
Krwiomocz kłębuszkowy z makroalbuminurią
Izolowany krwiomocz (tj, przy braku istotnego białkomoczu) z nadciśnieniem tętniczym u osób w wieku <40 lat
Widoczny krwiomocz współistniejący z współistniejącą infekcją (zwykle górnych dróg oddechowych)
Skierowanie do urologa
Widoczny krwiomocz u wszystkich pacjentów (niezależnie od wieku)
Pacjenci z jakimkolwiek objawowym niewidocznym krwiomoczem przy braku UTI lub innych przemijających przyczyn (niezależnie od wieku)
Mężczyźni z bezobjawowym niewidocznym krwiomoczem
Wszyscy pacjenci z bezobjawowym niewidocznym krwiomoczem i innymi czynnikami ryzyka
Tabela2: Wskazania do skierowania
† Obecność dysmorficznych krwinek czerwonych, białkomoczu, odlewów komórkowych i/lub niewydolności nerek lub jakiegokolwiek innego wskaźnika klinicznego podejrzewanego o chorobę miąższu nerek uzasadnia równoczesne wykonanie badań nefrologicznych, ale nie wyklucza potrzeby oceny urologicznej.
‡ Kobiety z bezobjawowym niewidocznym krwinkomoczem w wieku <40 lat nie wymagają skierowania na badania urologiczne.
