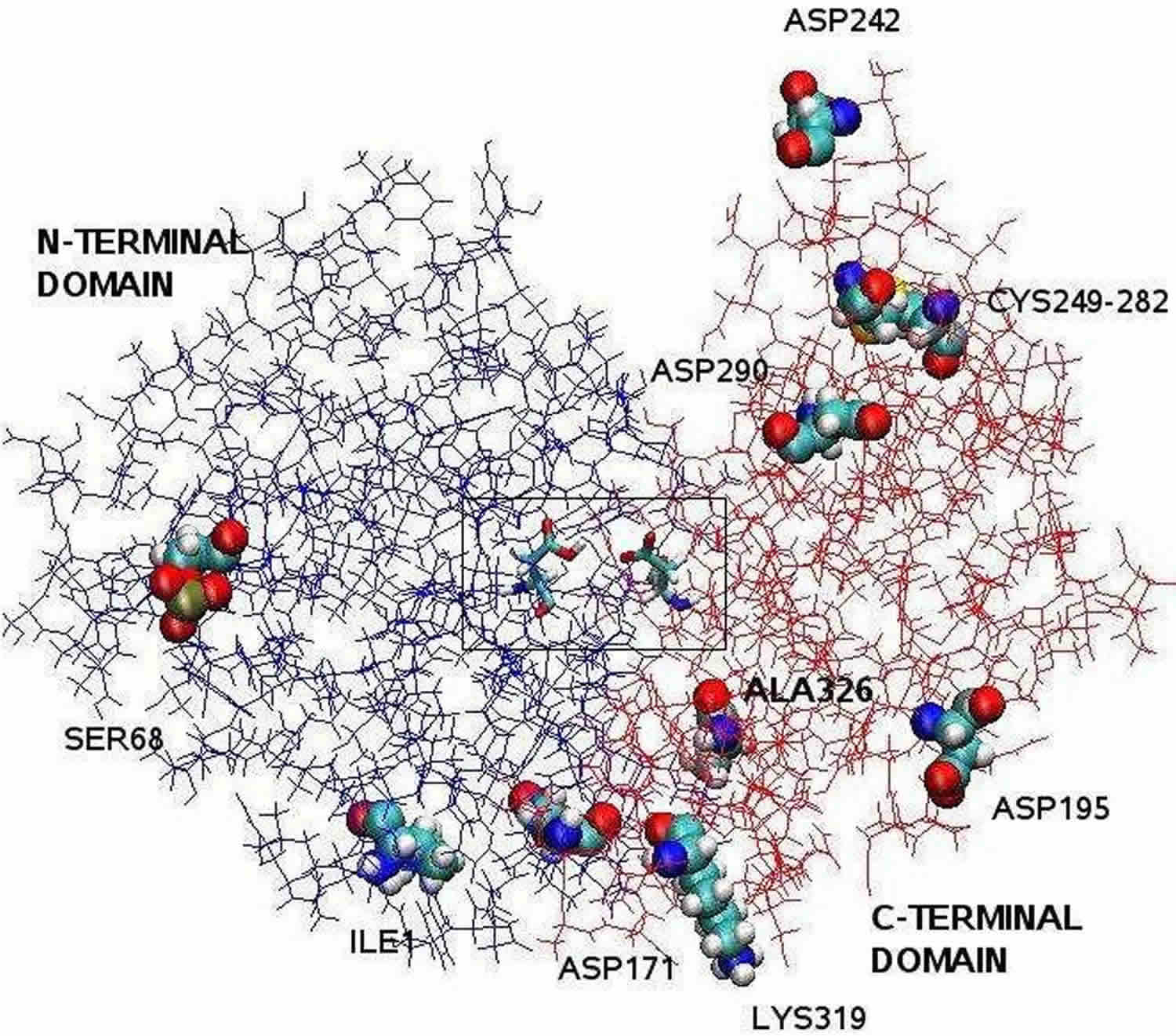
 Przypis: Struktura pepsyny wyjaśniona przez krystalografię rentgenowską jest bilobalna z dużą szczeliną miejsca aktywnego między dwoma płatami. Rezydy od 1 do 175 tworzą domenę N-końcową, podczas gdy reszty od 176 do 326 stanowią domenę C-końcową. Dwa asparaginiany w centrum szczeliny, Asp32 i Asp215, funkcjonują jako reszty katalityczne. Miejsce katalityczne, składające się z Asp32 i Asp215, znajduje się w centrum szczeliny. Naładowane reszty aminokwasowe znajdujące się na powierzchni białka to: Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-końcowa), Ala326 (C-końcowa). Fosforylowany Ser68 jest w pełni wyeksponowany do rozpuszczalnika, a mostek dwusiarczkowy pomiędzy Cys 249 i Cys 282 znajduje się na powierzchni białka.
Przypis: Struktura pepsyny wyjaśniona przez krystalografię rentgenowską jest bilobalna z dużą szczeliną miejsca aktywnego między dwoma płatami. Rezydy od 1 do 175 tworzą domenę N-końcową, podczas gdy reszty od 176 do 326 stanowią domenę C-końcową. Dwa asparaginiany w centrum szczeliny, Asp32 i Asp215, funkcjonują jako reszty katalityczne. Miejsce katalityczne, składające się z Asp32 i Asp215, znajduje się w centrum szczeliny. Naładowane reszty aminokwasowe znajdujące się na powierzchni białka to: Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-końcowa), Ala326 (C-końcowa). Fosforylowany Ser68 jest w pełni wyeksponowany do rozpuszczalnika, a mostek dwusiarczkowy pomiędzy Cys 249 i Cys 282 znajduje się na powierzchni białka.
Pepsyna, jako proteaza aspartylowa, ma bardzo niskie optimum pH. Kondjoyan, Daudin, i Santé-Lhoutellier 9) badali strawność białek miofibrylarnych znaleźli maksymalną aktywność pepsyny przy pH około 2. Pletschke, Naudé i Oelofsen 10) badali hydrolizę hemoglobiny przez pepsynę świńską i strusią, i również znaleźli optymalne pH 2,0 dla aktywności pepsyny. Po aktywacji przez pH <4,5, enzymy pepsyny są łatwo denaturowane przez pH powyżej 7,0, stanowiąc właściwości, które określają charakterystykę pepsyny 11).
W przeciwieństwie do wpływu pH, wpływ siły jonowej na aktywność enzymów jest rzadziej omawiany. Wcześniejsza praca Dale’a i White’a 12) wykazała, że zwiększenie siły jonowej wyraźnie zmniejsza szybkość reakcji unieruchomionej rybonukleazy trzustkowej, natomiast Butré, Wierenga i Gruppen 13) badali hydrolizę enzymatyczną izolatu białek serwatkowych przez alkalazę i neutrazę i również stwierdzili, że obecność 0.5M NaCl zmniejszyła szybkość hydrolizy.
Znane są dwa silne naturalnie występujące inhibitory pepsyny: pepstatyna, pentapeptyd ze Streptomyces i unikalny białkowy inhibitor z Ascaris. Pepsyna ulega również inhibicji zwrotnej; produkt trawienia białka spowalnia reakcję poprzez hamowanie pepsyny 14).
Gdzie wytwarzana jest pepsyna?
Komórki naczelne wydzielają pepsynę w postaci nieaktywnego prekursora enzymu zwanego pepsynogenem. Kiedy pepsynogen styka się z kwasem solnym z komórek ciemieniowych, ulega gwałtownemu rozpadowi, tworząc pepsynę 15). Pepsyna rozpoczyna trawienie prawie wszystkich rodzajów białek pokarmowych do polipeptydów. Enzym ten jest najbardziej aktywny w środowisku kwaśnym, które zapewnia kwas solny zawarty w soku żołądkowym.
Rysunek 2. Komórki żołądka (gruczoły żołądkowe)
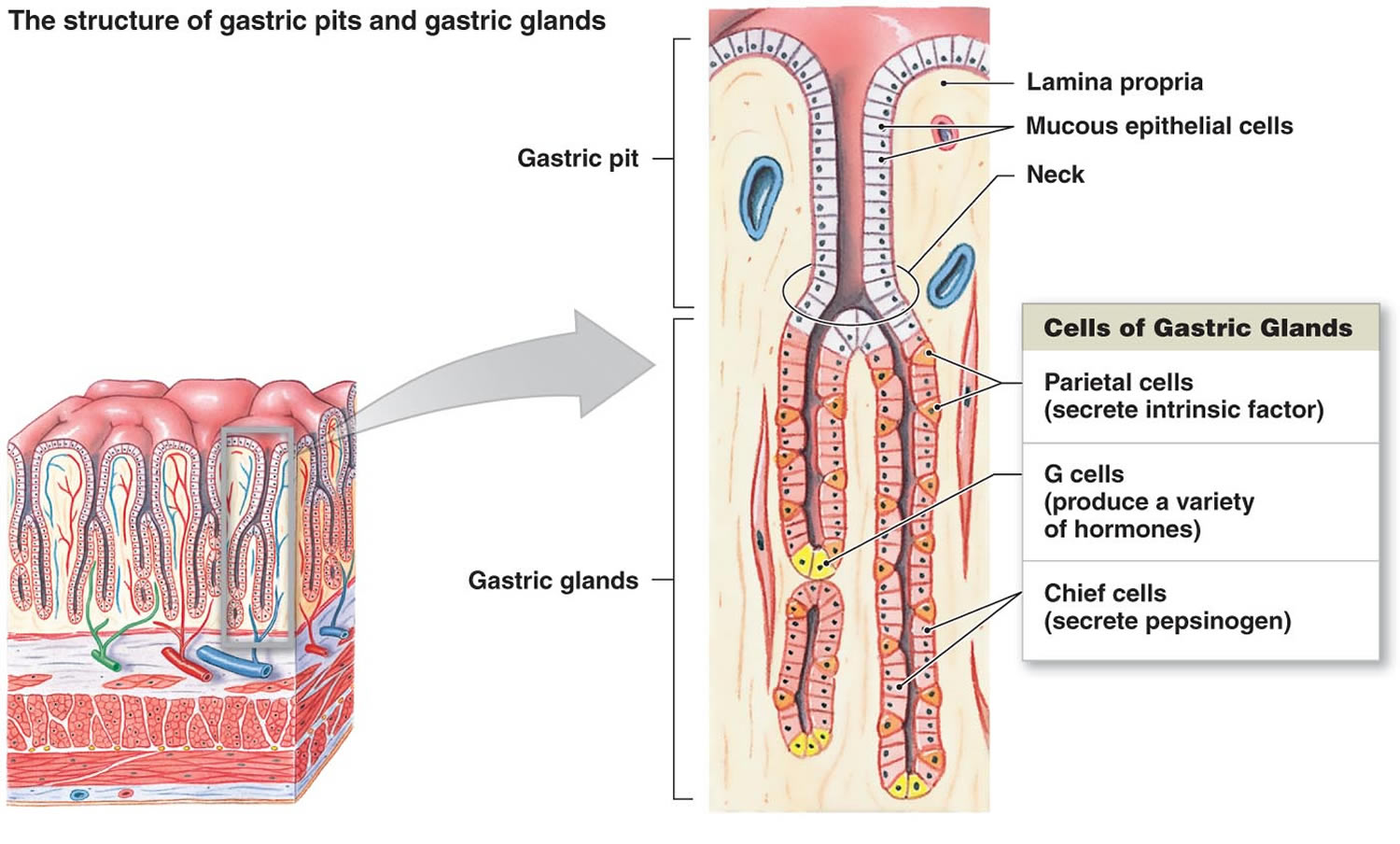 Przypis: Wyściółka żołądka. Gruczoły żołądkowe obejmują komórki śluzowe, komórki ciemieniowe i komórki naczelne. Błona śluzowa żołądka jest usiana dołkami żołądkowymi, które są otworami gruczołów żołądkowych.
Przypis: Wyściółka żołądka. Gruczoły żołądkowe obejmują komórki śluzowe, komórki ciemieniowe i komórki naczelne. Błona śluzowa żołądka jest usiana dołkami żołądkowymi, które są otworami gruczołów żołądkowych.
Co robi pepsyna?
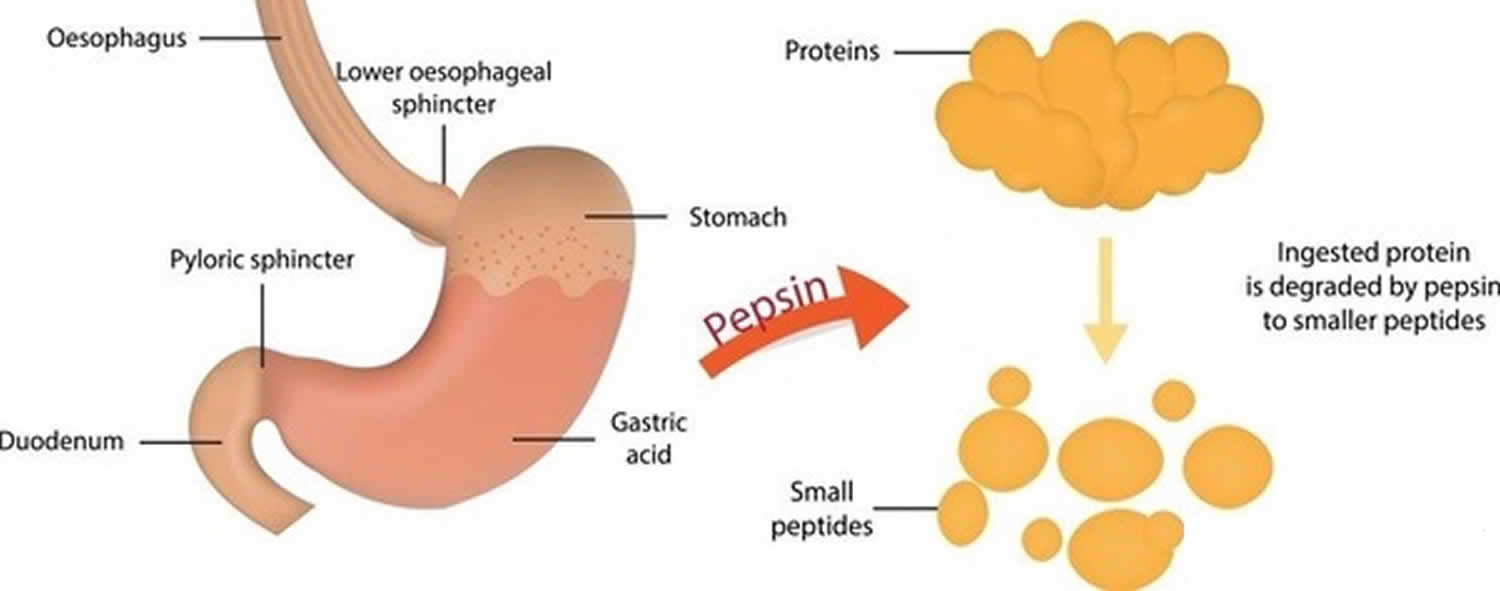
Pepsyna utworzona z pepsynogenu (nieaktywnej formy pepsyny) w obecności kwasu solnego, trawi prawie wszystkie rodzaje białek pokarmowych do polipeptydów (mniejszych związków białkowych). Pepsyna trawi białka w silnym kwasie żołądkowym. Pepsyna jest zoptymalizowana do trawienia pokarmu w kwaśnym środowisku żołądka i jest pierwszą proteazą, z którą białka pokarmowe stykają się w przewodzie pokarmowym. Pepsyna jest najbardziej aktywna w kwaśnych środowiskach między 37 °C a 42 °C 16).
Swoistość pepsyny (tj. prawdopodobieństwo rozszczepienia wiązań peptydowych przez pepsynę) zależy głównie od reszt aminokwasowych w pozycji P1 i P1′, podczas gdy reszty aminokwasowe w innych miejscach mogą również odgrywać rolę. Ogólnie rzecz biorąc, pepsyna preferuje rozszczepianie po fenyloalaninie, leucynie i metioninie, podczas gdy rzadko rozszczepia po histydynie, lizynie, prolinie i argininie 17). Reszty aromatyczne: tyrozyna, tryptofan i fenyloalanina są preferowane w pozycji P1′. Prolina jest silnie faworyzowana w pozycji P2, P2′ i P3′, podczas gdy histydyna, lizyna i arginina są faworyzowane w pozycji P3. Pozycje P4 i P4′ mają niewielki wpływ 18).
Rysunek 3. Funkcja pepsyny
.
