Zbieranie owadów jest ciekawym hobby dla wielu, ale jest również bardzo przydatne w badaniach naukowych. Ten post będzie wyjaśnić, jak zbierać i konserwować owady, i pokazać, jak powinny one być przypięte.
Zbieranie owadów można zrobić w każdej chwili, chociaż są one głównie obecne podczas wiosny, do późnej jesieni. Lato jest prawdopodobnie najlepszy czas, jak owady są najbardziej obfite. Ciepłe, słoneczne dni prawdopodobnie będą miały najwięcej owadów obecnych, jednak byłoby mądrze sprawdzić przez różne czasy i warunki pogodowe, jak różne owady pojawią się w różnym czasie. W nocy, światła uliczne i światła ganku są doskonałym miejscem, aby spojrzeć. Ściółka liściowa i rośliny są prawdopodobnie do domu owadów, i istnieje również wiele nocnych owadów, które pozostają z dala od świateł.
Zbieranie Sprzęt:
- Insect Net – Te mogą być kupione lub wykonane. Powinny być wykonane z tkaniny sieciowej, która jest zszyta do muślinu lub płótna, które owija się wokół drutu. Stamtąd owad może być przeniesiony do słoika, albo przez włożenie słoika do siatki, albo przez przytrzymanie owada za tułów.
-

Mój słoik do zabijania. PC: Colton Weaver Killing Jar – Najlepiej jest mieć 2-3 słoiki w wielu kształtach i rozmiarach. Najlepiej gdyby były zakorkowane, jednak to może zależeć. Powinny być w widocznym miejscu oznaczone napisem „POISON”. Do słoika dodaje się gips lub bawełnę, aby utrzymać środek zabijający. Borror, Delong i Triplehorn zalecają cyjanek, jednak octan etylu może być również używany i jest znacznie bezpieczniejszy. Czterochlorek węgla lub chloroform mogą być również stosowane.
- Pudełka z tkanki
- Koperty, lub papier do ich wykonania – Przydatne do tymczasowego przechowywania. Mogą być łatwo skonstruowane w terenie i zapewnią względne bezpieczeństwo okazów.
- Fiolki wypełnione płynem konserwującym
- Fiolki
- Fiolki
- Soczewki
- Aspirator – Łapią małe owady do fiolek za pomocą oddechu. Zazwyczaj mają one ekran, który zapobiega wdychaniu owadów.
- Parasol lub prześcieradło – Prześcieradło lub parasol umieszcza się pod rośliną, która jest następnie bita lub potrząsana tak, aby małe owady spadały na prześcieradło.
- Przesiewacz – Ściółka z liści może być powoli przesiewana na białą tkaninę lub tekturę, a następnie znalezione owady mogą być aspirowane.
- Pułapki – Istnieje wiele rodzajów pułapek. Berlese funnel ma lejek z ekranem i żarówką na górze, z alkoholem na dole. Owady są przyciągane, a następnie wpadają do słoika, w którym są zabijane. Światło pułapka może być skuteczny na niektóre insekty, i może być równie prosty jak światło nad zabijającym środkiem, lub spacer w pułapce dokąd insekty osiedlają i mogą zbierać ręcznie. Pitfall pułapki mogą używać na carrion beetles lub innych nie latających insektach, i są po prostu puszkami z przynętą na dnie. Insekty wpadają do środka i nie mogą uciec. Prosta pułapka może być po prostu roztworem cukru rozłożonym na powierzchni.
- Lampa
- Nóż
Obsługa połowu: Wiele owadów o miękkim ciele można umieścić bezpośrednio w 70-90% alkoholu izopropylowego lub etylowego. Obejmuje to larwy i nimfy wielu gatunków, jak również niektóre mniejsze owady. Owady o twardym ciele powinny być umieszczone w słoiku do zabijania. Długość, że to trwa zależy od owada, jak również środek zabijania, i może wynosić od kilku minut do kilku godzin. Kiedy owad jest martwy, należy go usunąć tak szybko, jak to możliwe, aby zapobiec dodatkowym przebarwieniom. Mogą one być przechowywane w pudełkach po tabletkach lub w papierowych kopertach opisanych powyżej.
Relaksowanie: Jeśli nie można natychmiast przypiąć i rozłożyć próbki, prawdopodobnie wyschnie. Kiedy jest w tym stanie, jest dość kruchy i złamie się, jeśli spróbujesz go ułożyć. Aby to naprawić, możesz użyć komory relaksacyjnej, płynu relaksacyjnego lub ugotować owada w wodzie (jednak może to go uszkodzić).
Komory relaksacyjne to pojemniki z mokrym piaskiem lub tkaniną w środku. Idealnie, kwas karbolowy powinien być dodany, aby zapobiec jakiemukolwiek spleśnieniu. Po dniu lub dwóch powinieneś być w stanie manipulować okazem ponownie.
Płyn odprężający może być wykonany z różnych mieszanek, i zazwyczaj pozostawiasz owada w nim przez kilka minut. Jedna mieszanina, często znana jako płyn Barbera, jest wymieniona poniżej: octan etylu
Inną metodą, którą można zastosować jest wstrzykiwanie wody z kranu. Działa to na wiele Lepidoptera. Używając igły o rozmiarze 20-25, wstrzykuj wodę do tułowia pod skrzydło, aż zostanie całkowicie wypełniona. Po 5-20 minutach owad powinien być zrelaksowany.
Konserwacja w płynie: To może być stosowane na wielu miękkich owadów ciała (takich jak jętki, stoneflies, caddisflies, itp.), które nie mogą być przypięte, chyba że są one suszone, jak wspomniano powyżej. Jest to również przydatne w przypadku bardzo małych okazów, które będą badane na szkiełkach mikroskopowych, oraz larw i nimf owadów. Stawonogi nie będące owadami również powinny być konserwowane w ten sposób.
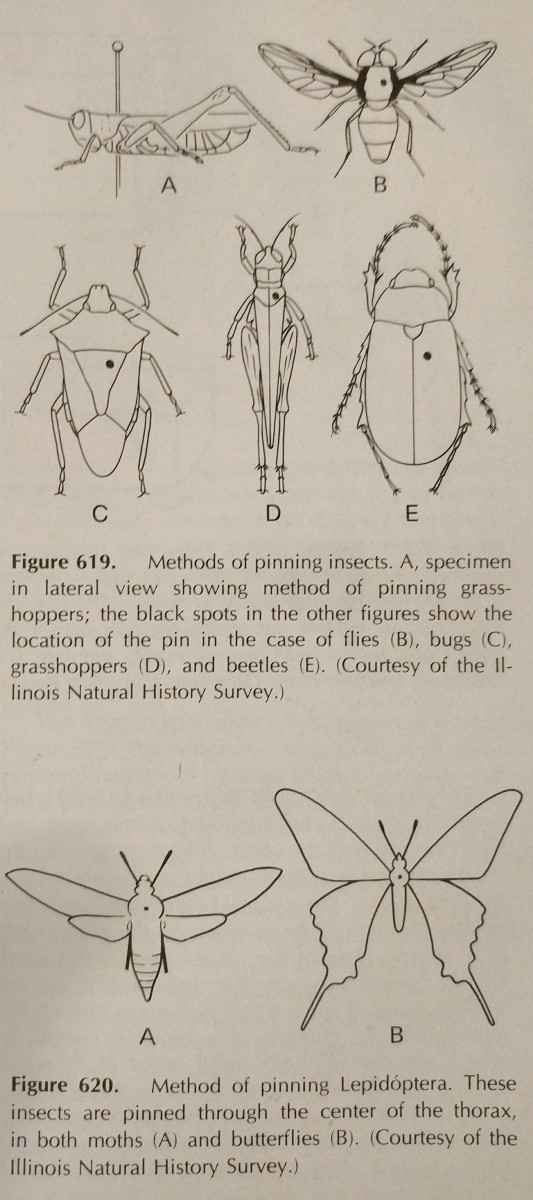
Przypinanie: Jest to najprostszy sposób na zachowanie owada o twardym ciele. Kolory często blakną, gdy owad wyschnie, jednak trudno tego uniknąć. Specjalistyczne szpilki owadów powinny być używane, które są dłuższe i nie rdzewieją. Są one dostępne w rozmiarach 00-7, jednak te mniejsze mogą być mniej przydatne. Różne zamówienia powinny być przypinane w różnych miejscach, co pokazano na zdjęciu. Nogi powinny być wydłużone, podobnie jak skrzydła. Często pszczoły mają wysunięty język dla łatwiejszej identyfikacji.
Najlepiej jest, gdy wszystkie gatunki w kolekcji są przypięte w jednakowych odległościach. Około 25 mm powyżej punktu jest idealne, a jednolite odległości mogą być łatwo osiągnięte przy użyciu pinezki, która jest po prostu blokiem drewna z otworami wywierconymi na różne głębokości.
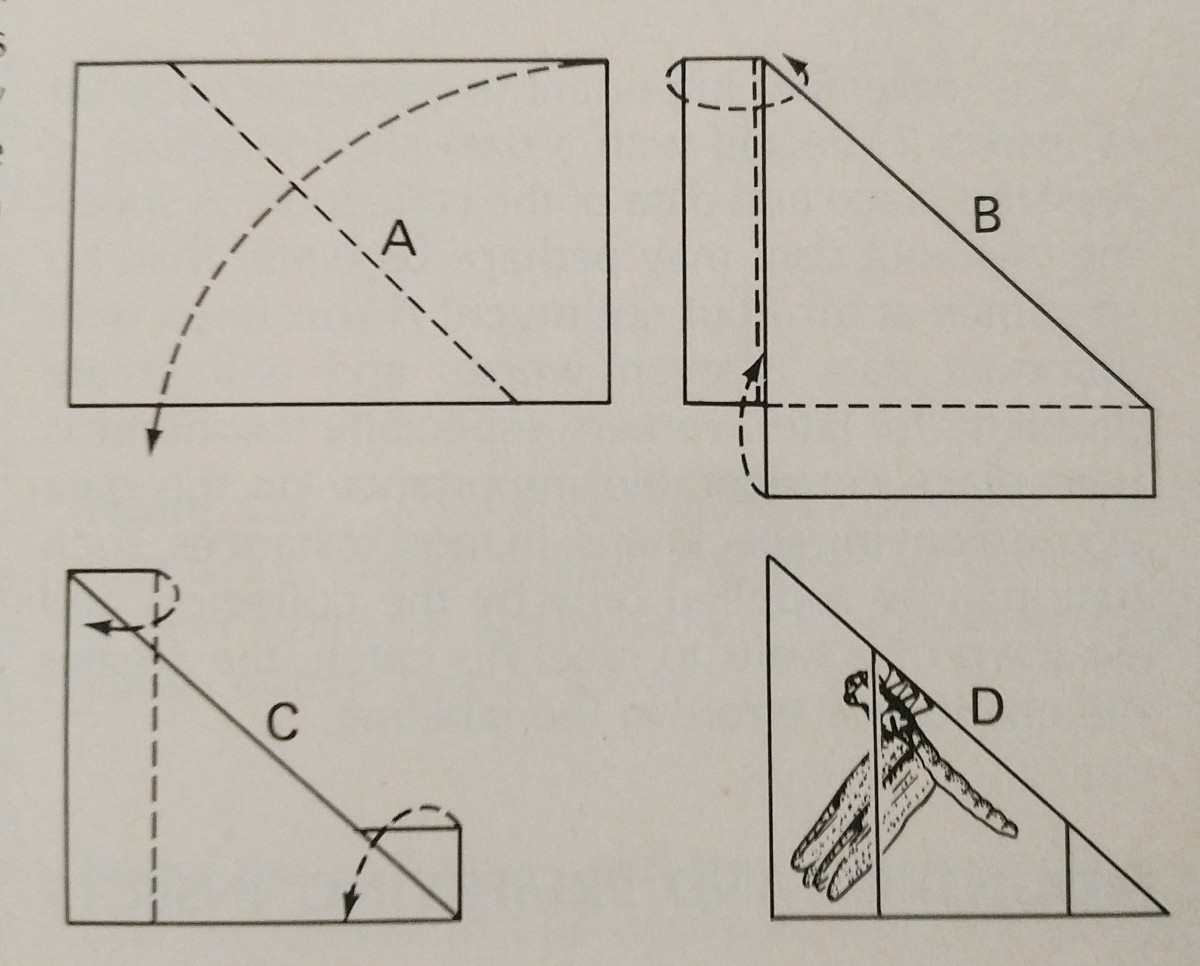
Rozrzucanie owadów jest w dużej mierze kwestią praktyki. Używanie deski do smarowania znacznie ułatwia zadanie,
a posiadanie dodatkowych szpilek i pasków papieru jest niezbędne. Szpilki mogą być używane do poruszania się wokół kończyn i skrzydeł.
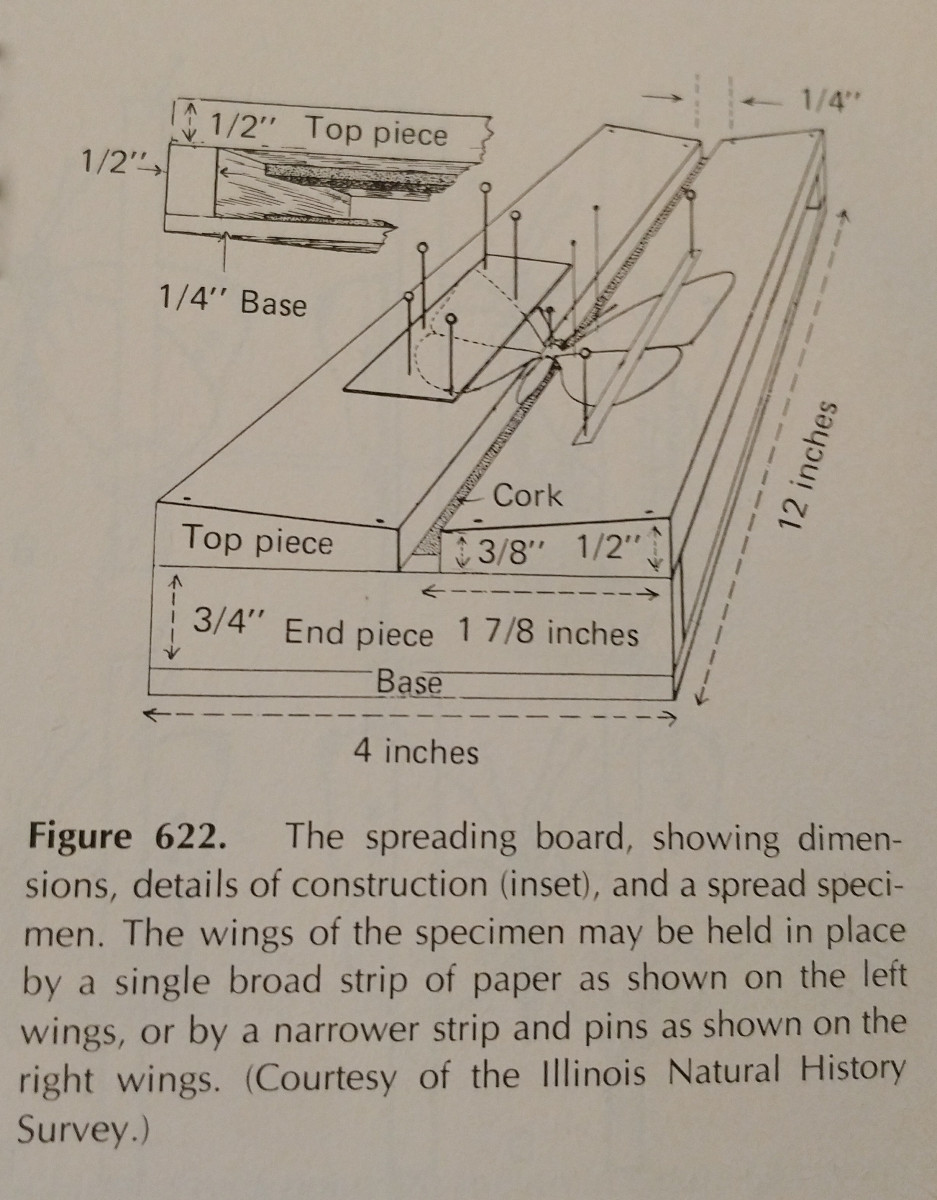
Typowo nacisk powinien być wywierany na przednią żyłę brzeżną skrzydła, szczególnie u Lepidoptera. Tylna krawędź skrzydeł Lepidoptera powinna być ustawiona pod kątem prostym w stosunku do tułowia, a tylne skrzydła do góry, tak aby nie było przerwy między nimi a skrzydłami przednimi, jak na ilustracji. To jest  ważne, aby być bardzo ostrożnym, i używać kleszczy do obsługi owadów. Są one bardzo delikatne, a często łuski i anteny mogą być łatwo strącone. Paski papieru i szpilki mogą być używane do zabezpieczenia skrzydeł, a następnie pozostaną one w pozycji po wyschnięciu.
ważne, aby być bardzo ostrożnym, i używać kleszczy do obsługi owadów. Są one bardzo delikatne, a często łuski i anteny mogą być łatwo strącone. Paski papieru i szpilki mogą być używane do zabezpieczenia skrzydeł, a następnie pozostaną one w pozycji po wyschnięciu.
Małe owady potrzebują trochę pomysłowości, aby być montowane, i mogą być przyklejone do końcówek kart, małe szpilki, lub mikroskopijne slajdy. Wystarczy przypiąć końcówkę karty, umieścić niewielką ilość kleju na nim, a następnie przykleić owada na.
Suszenie: Wiele przypiętych owadów może być suszone powietrzem w ciepłym, suchym miejscu. Większe ćmy mogą potrzebować komory suszenia z jednym lub wieloma żarówkami wewnątrz, a niektóre duże okazy mogą nawet wymagać usunięcia narządów odwłokowych. Nie ma ostatecznego czasu to zajmuje okaz do wyschnięcia, jednak to przyjdzie z doświadczeniem.
Miękkie owady ciała mogą być liofilizowane lub suszone próżniowo, a następnie pinezki, aby utworzyć non-fragile, non-discolored okazu. Zazwyczaj będą one kurczyć się, jednak ten krok czyni je wystarczająco suche, aby pozostać na pin.
Typowo roztwór alkoholu etylowego jest używany. Niektóre wspólne są wymienione poniżej.
| Roztwór Hooda | |
| 70-.80% Ethyl Alcohol | 95 cm3 |
| Glycerin | 5 cm3 |
| Roztwór Kahle’a | |
| 95%. Alkohol etylowy | 30 cm3 |
| Formaldehyd | 12 cm3 |
| Kwas octowy lodowaty | 4 cm3 |
| Woda | 60 cm3 |
| Alkoholowy roztwór Bouina | |
| 80% Alkohol Etylowy | 150 cm3 |
| Formaldehyd | 60 cm3 |
| Kwas octowy lodowaty | 15 cm3 |
| Kwas cytrynowy | 1g |
Jak już jesteśmy przy temacie roztworów, Octan etylu może być często nieskuteczny na larwy, więc tutaj są środki zabijające, które są wystarczające:
| mieszankaKAAD | |
| 95% Ethyl Alcohol | 70-.100 cm3 |
| Kerozyna (ograniczyć do larw o miękkim ciele, takich jak larwy) | 10 cm3 |
| Kwas octowy lodowaty | 20 cm3 |
| Dioksan | 10 cm3 |
| Mieszanina XA | |
| 95% octan etylu | 50 cm3 |
| Xylen | 50 cm3 |
Obydwie metody powinny trwać 1/2 – 4 godziny. Wszystkie znane środki zabijające usuwają kolor, szczególnie zielenie, pozwalają, i czerwienie.
Typowo, zakonserwowane okazy powinny być sprawdzane raz lub dwa razy do roku, w przypadku, gdy jakikolwiek płyn wyparował. Jeśli tak, należy go wymienić.
Montaż na szkiełkach mikroskopowych: Istnieją dwa rodzaje uchwytów mikroskopowych: stałe i tymczasowe. Stosuje się w nich różne media montażowe, a w przypadku prowizorycznych statywów, po zamontowaniu, próbki są zazwyczaj umieszczane z powrotem w konserwatywie, gdzie mogą być przechowywane przez czas nieokreślony. Okłady stałe są montowane raz i nie mogą być usunięte, jednak mogą one trwać dość długo, nawet kilka lat.
Wiele owadów o miękkim ciele może być umieszczonych bezpośrednio w podłożu montażowym, jednak niektóre muszą być najpierw oczyszczone w specjalnym płynie. Główne roztwory używane do tego są KOH i roztwór Nesbitta. Proces ten często obejmuje moczenie owadów przez kilka godzin do wielu dni, gdy odbywa się na zimno, chociaż można to zrobić szybciej przy użyciu ciepła i KOH.
Małe okazy mogą być montowane w normalnym slajdzie, podczas gdy większe mogą wymagać slajdu depresyjnego lub wsparcia dla szkła pokrywającego.
Środki używane do tymczasowego montażu slajdów obejmują wodę, alkohol, glicerynę i galaretkę glicerynową. Woda i alkohol mogą trwać tylko kilka minut zanim wyparują, więc gliceryna jest generalnie używana jeśli okazy mają być badane przez dłuższy okres czasu.
To kończy ten post, i sekcję konserwacji Borror, Delong, i Triplehorn. Większość reszty pracy nad tym SOS będzie polegała na kompilacji moich dokumentów i slajdów, jak również na upewnieniu się, że moje schematy blokowe i protokół są w porządku.
