![]()
Es posible que las personas que utilizan tecnología de asistencia no puedan acceder completamente a la información de este archivo. Si necesita ayuda, envíe un correo electrónico a: [email protected]. Escriba 508 Accommodation y el título del informe en el asunto del correo electrónico.
![]() PDF
PDF
El Comité Asesor sobre Prácticas de Inmunización (ACIP, por sus siglas en inglés) revisa anualmente el Calendario de Vacunación para Adultos recomendado para garantizar que el calendario refleja las recomendaciones actuales para el uso de las vacunas autorizadas. En junio de 2005, el ACIP aprobó el Calendario de Vacunación de Adultos para el período comprendido entre octubre de 2005 y septiembre de 2006. Este calendario también ha sido aprobado por la Academia Americana de Médicos de Familia y el Colegio Americano de Obstetras y Ginecólogos.
Cambios en el calendario para octubre de 2005–septiembre de 2006
El calendario 2005–2006 difiere del anterior de la siguiente manera:
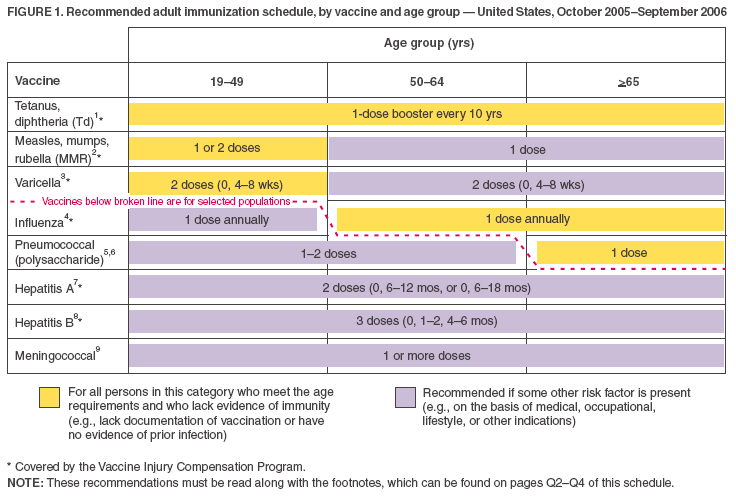
- Las vacunas enumeradas en el calendario basado en la edad (Figura 1) se muestran de forma que las vacunas recomendadas para el uso rutinario puedan diferenciarse de las recomendadas para adultos con ciertos indicadores de riesgo (de forma similar al calendario de vacunación infantil). Esto se ilustra tanto por el esquema de colores como por la línea discontinua.
- Las barras amarillas («Para todas las personas de este grupo») y las barras verdes («Para las personas que carecen de documentación de vacunación o evidencia de enfermedad») del calendario anterior se han fusionado en una sola barra amarilla, que ahora dice: «Para todas las personas de esta categoría que cumplen los requisitos de edad y que carecen de evidencia de inmunidad (por ejemplo, carecen de documentación de vacunación o no tienen evidencia de infección previa)».
- La barra púrpura se ha cambiado de «Para personas de riesgo (por ejemplo, con indicaciones médicas/de exposición)» a «Recomendada si está presente algún otro factor de riesgo (por ejemplo, sobre la base de indicaciones médicas, ocupacionales, de estilo de vida u otras)». Se ha añadido la barra morada a las columnas de grupos de edad de 50 a 64 años y de > a 65 años para la vacuna contra el sarampión, las paperas y la rubeola (SPR).
- Se ha transpuesto la columna «Diabetes, enfermedad cardíaca, enfermedad pulmonar crónica o enfermedad hepática crónica, incluido el alcoholismo crónico» con la columna «Inmunodeficiencia congénita, leucemia, linfoma, neoplasia maligna generalizada, terapia con agentes alquilantes, antimetabolitos, fugas de líquido cefalorraquídeo, radiación o grandes cantidades de corticosteroides» en el esquema de indicaciones médicas/otras indicaciones (Figura 2), de modo que las contraindicaciones para las vacunas de la triple vírica y de la varicela están ahora al lado.
- La fila de la vacuna contra la varicela se ha desplazado hacia arriba en ambas figuras (es decir, a inmediatamente después de la vacuna triple vírica) porque la vacuna se recomienda ahora universalmente para ciertos grupos de edad.
- Se ha añadido la vacuna meningocócica al calendario de indicaciones médicas/otras indicaciones (Figura 2). Se ha revisado la nota a pie de página para incorporar las recomendaciones del ACIP recientemente publicadas para esta vacuna (1).
- Se ha reformulado la nota a pie de página sobre tétanos y difteria (nº 1).
- Se ha reformulado la nota a pie de página sobre varicela (nº 3) de acuerdo con las recomendaciones del ACIP adoptadas en junio de 2005.
- Se ha revisado la nota a pie de página sobre la gripe (#4) para añadir la más reciente afección de alto riesgo: las afecciones neuromusculares que comprometen la función respiratoria (2).
- Se ha añadido una décima nota a pie de página relativa a la vacunación contra el Haemophilus influenzae tipo b para las poblaciones de alto riesgo (es decir, personas con asplenia, leucemia e infección por el virus de la inmunodeficiencia humana).
El Calendario de Vacunación de Adultos está disponible en inglés y español en http://www.cdc.gov/nip/recs/adult-schedule.htm. La información general sobre la vacunación de adultos, incluidas las recomendaciones relativas a la vacunación de personas con VIH y otras enfermedades inmunodepresivas, está disponible en los departamentos de salud estatales y locales y en el Programa Nacional de Vacunación en http://www.cdc.gov/nip. Las declaraciones informativas sobre las vacunas están disponibles en http://www.cdc.gov/nip/publications/vis. Las declaraciones del ACIP para cada vacuna recomendada pueden verse, descargarse e imprimirse en el sitio web del Programa Nacional de Inmunización en http://www.cdc.gov/nip/publications/acip-list.htm. Las instrucciones para notificar eventos adversos al Sistema de Notificación de Eventos Adversos de Vacunas están disponibles en http://www.vaers.hhs.gov o por teléfono, 800-822-7967.
- CDC. Prevención y control de la enfermedad meningocócica: recomendaciones del Comité Asesor de Prácticas de Inmunización (ACIP). MMWR 2005;54(No. RR-7).
- CDC. Prevención y control de la gripe: recomendaciones del Comité Asesor sobre Prácticas de Inmunización (ACIP). MMWR 2005;54(No. RR-8).
Figura 1
Volver al principio.
Figura 2

Volver al principio.
Aprobado por el Comité Asesor sobre Prácticas de Inmunización, el Colegio Americano de Obstetras y Ginecólogos y la Academia Americana de Médicos de Familia
1. Vacunación contra el tétanos y la difteria (Td). Los adultos con antecedentes inciertos de una serie de vacunación primaria completa con vacunas que contienen toxoide diftérico y tetánico deben recibir una serie primaria con toxoide Td combinado. La serie primaria para adultos es de 3 dosis; administrar las 2 primeras dosis con un intervalo de al menos 4 semanas y la tercera dosis entre 6 y 12 meses después de la segunda. Administrar 1 dosis si la persona recibió la serie primaria y si la última vacunación se recibió >10 años antes. Consulte la declaración del ACIP sobre las recomendaciones para administrar la Td como profilaxis en el tratamiento de heridas (http://www.cdc.gov/mmwr/preview/mmwrhtml/00041645.htm). El Grupo de Trabajo del Colegio Americano de Médicos sobre Inmunización en Adultos apoya una segunda opción para el uso de la Td en adultos: un único refuerzo de Td a la edad de 50 años para las personas que hayan completado la serie pediátrica completa, incluyendo el refuerzo para adolescentes/adultos jóvenes. Existe una nueva vacuna autorizada contra el tétanos, la difteria y la tos ferina acelular para adultos. Se publicarán las recomendaciones del ACIP para su uso.
2. Vacunación contra el sarampión, las paperas y la rubéola (MMR). Componente del sarampión: los adultos nacidos antes de 1957 pueden considerarse inmunes al sarampión. Los adultos nacidos durante o después de 1957 deben recibir >1 dosis de la triple vírica a menos que tengan una contraindicación médica, documentación de >1 dosis, historial de sarampión basado en el diagnóstico del proveedor de atención médica o evidencia de laboratorio de inmunidad. Se recomienda una segunda dosis de la triple vírica para los adultos que 1) hayan estado expuestos recientemente al sarampión o en un entorno de brote; 2) hayan sido vacunados previamente con la vacuna antisarampionosa; 3) hayan sido vacunados con un tipo desconocido de vacuna antisarampionosa durante los años 1963-1967; 4) sean estudiantes de centros de enseñanza superior; 5) trabajen en un centro sanitario; o 6) tengan previsto viajar al extranjero. No administrar la vacuna triple vírica u otras vacunas que contengan sarampión a personas infectadas por el VIH con inmunosupresión grave. Componente de las paperas: 1 dosis de la vacuna triple vírica debería ser suficiente para proteger a los nacidos durante o después de 1957 que carezcan de antecedentes de paperas basados en el diagnóstico del proveedor de atención sanitaria o que carezcan de pruebas de laboratorio de inmunidad. Componente de la rubéola: administrar 1 dosis de la vacuna triple vírica a las mujeres cuyos antecedentes de vacunación contra la rubéola no sean fiables o que carezcan de pruebas de laboratorio de inmunidad. Para las mujeres en edad fértil, independientemente del año de nacimiento, determinar rutinariamente la inmunidad a la rubéola y aconsejar a las mujeres sobre el síndrome de rubéola congénita. No vacunar a las mujeres que estén embarazadas o que puedan quedarse embarazadas en las 4 semanas siguientes a la recepción de la vacuna. Las mujeres que no tengan evidencia de inmunidad deben recibir la vacuna triple vírica al finalizar o terminar el embarazo y antes de ser dadas de alta del centro sanitario.
3. Vacunación contra la varicela. Se recomienda la vacunación contra la varicela para todos los adultos sin evidencia de inmunidad a la varicela. Se debe prestar especial atención a aquellos que 1) tienen un contacto estrecho con personas de alto riesgo de padecer la enfermedad grave (trabajadores sanitarios y contactos familiares de personas inmunodeprimidas) o 2) tienen un alto riesgo de exposición o transmisión (por ejemplo, profesores de niños pequeños; empleados de guarderías; residentes y miembros del personal de entornos institucionales, incluyendo instituciones penitenciarias; estudiantes universitarios; personal militar; adolescentes y adultos que viven en hogares con niños; mujeres no embarazadas en edad fértil; y viajeros internacionales). Las pruebas de inmunidad a la varicela en adultos incluyen cualquiera de las siguientes 1) vacunación documentada contra la varicela adecuada a la edad (es decir, recepción de 1 dosis antes de los 13 años o recepción de 2 dosis después de los 13 años); 2) nacido en EE.UU. antes de 1966 o antecedentes de enfermedad de la varicela antes de 1966 para las personas no nacidas en EE.UU.; 3) antecedentes de enfermedad de la varicela.3) antecedentes de varicela basados en el diagnóstico de un profesional sanitario o en la declaración de los padres o del propio paciente de haber padecido la enfermedad típica de la varicela en el caso de las personas nacidas entre 1966 y 1997 (en el caso de un paciente que declare haber padecido un caso atípico y leve, los profesionales sanitarios deben buscar una relación epidemiológica con un caso típico de varicela o una prueba de confirmación de laboratorio, si se realizó en el momento de la enfermedad aguda); 4) antecedentes de herpes zoster basados en el diagnóstico de un profesional sanitario; o 5) pruebas de laboratorio de inmunidad. No vacunar a las mujeres que estén embarazadas o que puedan quedarse embarazadas en las 4 semanas siguientes a la recepción de la vacuna. Evaluar a las mujeres embarazadas para comprobar la inmunidad a la varicela. Las mujeres que no tengan evidencia de inmunidad deben recibir la dosis 1 de la vacuna contra la varicela al finalizar o terminar el embarazo y antes de ser dadas de alta del centro de salud. La dosis 2 debe administrarse entre 4 y 8 semanas después de la dosis 1.
4. Vacunación contra la gripe. Indicaciones médicas: trastornos crónicos de los sistemas cardiovascular o pulmonar, incluyendo el asma; enfermedades metabólicas crónicas, incluyendo la diabetes mellitus, la disfunción renal, las hemoglobinopatías o la inmunosupresión (incluyendo la inmunosupresión causada por medicamentos o por el VIH); cualquier condición (por ejemplo, disfunción cognitiva, lesión medular, trastorno convulsivo u otro trastorno neuromuscular) que comprometa la función respiratoria o el manejo de las secreciones respiratorias o que pueda aumentar el riesgo de aspiración; y el embarazo durante la temporada de gripe. No existen datos sobre el riesgo de enfermedad gripal grave o complicada entre las personas con asplenia; sin embargo, la gripe es un factor de riesgo para las infecciones bacterianas secundarias que pueden causar enfermedad grave entre las personas con asplenia. Indicaciones profesionales: trabajadores de la salud y empleados de centros de asistencia y cuidados de larga duración. Otras indicaciones: residentes de residencias de ancianos y otros centros de cuidados de larga duración y de vida asistida; personas susceptibles de transmitir la gripe a personas de alto riesgo (es decir, contactos domésticos y cuidadores de niños de 0 a 23 meses, o personas de todas las edades con afecciones de alto riesgo), y cualquier persona que desee vacunarse. En el caso de personas sanas, no embarazadas, de 5 a 49 años de edad, sin afecciones de alto riesgo y que no sean contactos de personas gravemente inmunodeprimidas en unidades de cuidados especiales, se puede administrar la vacuna antigripal por vía intranasal (FluMist®) en lugar de la vacuna inactivada.
5. Vacunación antineumocócica de polisacáridos. Indicaciones médicas: trastornos crónicos del sistema pulmonar (excluyendo el asma); enfermedades cardiovasculares; diabetes mellitus; enfermedades crónicas del hígado, incluyendo enfermedades del hígado como resultado del abuso del alcohol (por ejemplo, cirrosis); insuficiencia renal crónica o síndrome nefrótico; asplenia funcional o anatómica (por ejemplo, enfermedad de células falciformes o esplenectomía ); condiciones inmunosupresoras (por ejemplo, inmunodeficiencia congénita, infección por VIH , leucemia, linfoma, mieloma múltiple, enfermedad de Hodgkin, malignidad generalizada o trasplante de órganos o médula ósea); quimioterapia con agentes alquilantes, antimetabolitos o corticosteroides sistémicos a largo plazo; e implantes cocleares. Otras indicaciones: Nativos de Alaska y ciertas poblaciones de indios americanos; residentes de residencias de ancianos y otros centros de atención a largo plazo.
6. Revacunación con la vacuna neumocócica de polisacáridos. Revacunación única después de 5 años para personas con insuficiencia renal crónica o síndrome nefrítico; asplenia funcional o anatómica (por ejemplo, enfermedad de células falciformes o esplenectomía); condiciones inmunosupresoras (por ejemplo, inmunodeficiencia congénita, infección por VIH, leucemia, linfoma, mieloma múltiple, enfermedad de Hodgkin, enfermedad maligna generalizada o trasplante de órganos o médula ósea); o quimioterapia con agentes alquilantes, antimetabolitos o corticosteroides sistémicos a largo plazo. Para personas de edad >65 años, revacunación única si fueron vacunadas >5 años antes y tenían una edad <65 años en el momento de la vacunación primaria.
7. Vacunación contra la hepatitis A. Indicaciones médicas: personas con trastornos del factor de coagulación o enfermedad hepática crónica. Indicaciones conductuales: hombres que tienen relaciones sexuales con hombres o consumidores de drogas ilegales. Indicaciones profesionales: Personas que trabajan con primates infectados por el virus de la hepatitis A (VHA) o con VHA en un laboratorio de investigación. Otras indicaciones: personas que viajen o trabajen en países con endemicidad alta o intermedia de hepatitis A (para la lista de países, véasehttp://www.cdc.gov/travel/diseases.htm#hepa), así como cualquier persona que desee obtener inmunidad. Las vacunas actuales deben administrarse en una serie de 2 dosis a los 0 y 6–12 meses, o a los 0 y 6–18 meses. Si se utiliza la vacuna combinada contra la hepatitis A y la hepatitis B, administrar 3 dosis a los 0, 1 y 6 meses.
8. Vacunación contra la hepatitis B. Indicaciones médicas: pacientes en hemodiálisis (utilizar formulación especial o dos dosis de 20-µg/mL) o pacientes que reciben concentrados de factor de coagulación. Indicaciones profesionales: trabajadores de la salud y de la seguridad pública que estén expuestos a la sangre en el lugar de trabajo y personas en formación en escuelas de medicina, odontología, enfermería, tecnología de laboratorio y otras profesiones relacionadas con la salud. Indicaciones conductuales: usuarios de drogas inyectables; personas con más de una pareja sexual durante los 6 meses anteriores; personas con una enfermedad de transmisión sexual (ETS) recientemente adquirida; y hombres que tienen relaciones sexuales con hombres. Otras indicaciones: contactos domésticos y parejas sexuales de personas con infección crónica por el virus de la hepatitis B (VHB); clientes y miembros del personal de instituciones para personas con discapacidades del desarrollo; todos los clientes de clínicas de ETS; reclusos de centros penitenciarios; y viajeros internacionales que vayan a estar en países con prevalencia alta o intermedia de infección crónica por el VHB durante más de 6 meses (para la lista de países, véase http://www.cdc.gov/travel/diseases.htm#hepa).
9. Vacunación antimeningocócica. Indicaciones médicas: adultos con asplenia anatómica o funcional o con deficiencias del componente terminal del complemento. Otras indicaciones: estudiantes universitarios de primer año que viven en residencias universitarias; microbiólogos que se exponen habitualmente a aislados de Neisseria meningitidis; reclutas militares; y las personas que viajan o residen en países en los que la enfermedad meningocócica es hiperendémica o epidémica (por ejemplo, el «cinturón de la meningitis» del África subsahariana durante la estación seca), especialmente si el contacto con las poblaciones locales va a ser prolongado. El gobierno de Arabia Saudí exige la vacunación a todos los viajeros a La Meca durante el Hajj anual. Se prefiere la vacuna conjugada antimeningocócica para los adultos que cumplan cualquiera de las indicaciones anteriores y que tengan una edad <55 años, aunque la vacuna polisacárida antimeningocócica (MPSV4) es una alternativa aceptable. La revacunación después de 5 años podría estar indicada para los adultos previamente vacunados con MPSV4 que sigan teniendo un alto riesgo de infección (por ejemplo, personas que residen en zonas en las que la enfermedad es epidémica).
10. Condiciones seleccionadas para las que se puede utilizar la vacuna contra Haemophilus influenzae tipo b (Hib). Las vacunas conjugadas contra la Hib están autorizadas para niños de 6 a 71 meses. No se dispone de datos de eficacia en los que basar una recomendación sobre el uso de la vacuna contra el Hib en niños mayores y adultos con afecciones crónicas asociadas a un mayor riesgo de enfermedad por Hib. Sin embargo, los estudios sugieren una buena inmunogenicidad en pacientes que padecen anemia de células falciformes, leucemia o infección por VIH o que se han sometido a esplenectomías; la administración de la vacuna a estos pacientes no está contraindicada.
El Calendario de Vacunación Recomendado para Adultos ha sido aprobado por el Comité Asesor sobre Prácticas de Inmunización, el Colegio Americano de Obstetras y Ginecólogos y la Academia Americana de Médicos de Familia. El formato estándar de las notas a pie de página del MMWR ha sido modificado para la publicación de este calendario.
Cita sugerida: Centros para el Control y la Prevención de Enfermedades. Recommended Adult Immunization Schedule—United States, October 2005–September 2006. MMWR 2005;54:Q1–Q4.
Este calendario indica los grupos de edad recomendados y las indicaciones médicas para la administración rutinaria de las vacunas actualmente autorizadas para personas de >19 años. Las vacunas combinadas autorizadas pueden utilizarse siempre que cualquiera de los componentes de la combinación esté indicado y cuando los otros componentes de la vacuna no estén contraindicados. Para obtener recomendaciones detalladas, consulte los prospectos de los fabricantes y las declaraciones completas del ACIP (http://www.cdc.gov/nip/publications/acip-list.htm).
Notifique todas las reacciones posvacunales clínicamente significativas al Sistema de Notificación de Efectos Adversos de las Vacunas (VAERS). Los formularios de notificación y las instrucciones para presentar un informe VAERS están disponibles por teléfono, 800-822-7967, o en el sitio web de VAERS en http://www.vaers.hhs.gov.
La información sobre cómo presentar una reclamación del Programa de Compensación por Lesiones por Vacunas está disponible en http://www.hrsa.gov/osp/vicp o por teléfono, 800-338-2382. Para presentar una reclamación por lesiones causadas por vacunas, póngase en contacto con el Tribunal de Reclamaciones Federales de los Estados Unidos, 717 Madison Place, N.W., Washington, DC 20005, teléfono 202-357-6400.
También se puede obtener información adicional sobre las vacunas mencionadas anteriormente y las contraindicaciones de la vacunación en http://www.cdc.gov/nip o en el Centro de Contacto del CDC-INFO en el 800-CDC-INFO (232-4636) en inglés y español, 24 horas al día, 7 días a la semana.
El uso de nombres comerciales y fuentes comerciales es sólo para identificación y no implica el respaldo del Departamento de Salud y Servicios Humanos de los Estados Unidos.Las referencias a sitios que no son de los CDC en Internet se proporcionan como un servicio a los lectores de MMWR y no constituyen o implican el respaldo de estas organizaciones o sus programas por parte de los CDC o el Departamento de Salud y Servicios Humanos de los Estados Unidos. Los CDC no son responsables del contenido de las páginas que se encuentran en estos sitios. Las direcciones URL que aparecen en MMWR estaban actualizadas en la fecha de publicación.
Descargo de responsabilidad Todas las versiones HTML de artículos de MMWR son conversiones electrónicas de texto ASCII a HTML. Esta conversión puede haber dado lugar a errores de traducción de caracteres o de formato en la versión HTML. Los usuarios no deben confiar en este documento HTML, sino que deben remitirse a la versión electrónica en PDF y/o al ejemplar original en papel de MMWR para obtener el texto oficial, las figuras y las tablas. Se puede obtener un ejemplar original en papel de este número en la Superintendencia de Documentos, U.S. Government Printing Office (GPO), Washington, DC 20402-9371; teléfono: (202) 512-1800. Póngase en contacto con GPO para conocer los precios actuales.
**Las preguntas o mensajes sobre errores de formato deben dirigirse a [email protected].
Fecha de la última revisión: 10/13/2005
