Forma lungă a tabelului periodic, folosită în mod obișnuit, este concepută pentru a pune accentul pe configurațiile electronice. Deoarece electronii cei mai externi (de valență) sunt cei care sunt implicați în primul rând în interacțiunile chimice dintre atomi, ultimul electron adăugat la un atom în procesul de alcătuire este mult mai interesant pentru un chimist decât primul. Acest ultim electron se numește electron distinctiv, deoarece distinge un atom de cel care îl precede imediat în tabelul periodic. Tipul de subshell (s, p, d, f) în care este plasat electronul distinctiv este foarte strâns legat de comportamentul chimic al unui element și dă naștere la clasificarea prezentată prin codul de culori din tabelul periodic văzut aici. Elementele reprezentative sunt cele în care electronul distinctiv intră în subshell-ul ans sau p. Cele mai multe dintre elementele a căror chimie și valență am discutat până acum se încadrează în această categorie. Multe dintre proprietățile chimice ale elementelor reprezentative pot fi explicate pe baza diagramelor Lewis. Altfel spus, valențele elementelor reprezentative pot fi prezise pe baza numărului de electroni de valență pe care îi au, sau din numărul de electroni care ar trebui adăugați pentru a obține aceeași configurație electronică ca un atom dintr-un gaz nobil. Pentru elementele reprezentative, numărul de electroni de valență este același cu numărul grupului periodic, iar numărul necesar pentru a corespunde următoarei configurații a unui gaz nobil este 8 minus numărul grupului. Acest lucru este în concordanță cu regulile de valență derivate din tabelul periodic și are ca rezultat formule pentru clorurile din prima duzină de elemente care prezintă variația periodică a valenței.
| Element | Greutate atomică | Compuși ai hidrogenului | Compuși ai oxigenului | Compuși ai clorului | |
|---|---|---|---|---|---|
| Hidrogen | 1.01 | H2 | H2O, H2O2 | HCl | |
| Heliu | 4.00 | Nu s-a format | Nu s-a format | Nu s-a format | |
| Litiu | 6.94 | LiH | Li2O, Li2O2 | LiCl | |
| Beriliu | 9.01 | BeH2 | BeO | BeCl2 | |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 | |
| Carbon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 | |
| Nitrogen | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 | |
| Oxigen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 | |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 | |
| Neon | 20.18 | Nu s-a format | Nu s-a format | Nu s-a format | |
| Sodiu | 22.99 | NaH | Na2O, Na2O2 | NaCl | |
| Magneziu | 24.31 | MgH2 | MgO | MgCl2 |
Primile trei rânduri sau perioade orizontale din tabelul periodic modern sunt alcătuite în întregime din elemente reprezentative. În prima perioadă, electronii distinctivi pentru H și He se află în subshell-ul 1s. De-a lungul celei de-a doua perioade, Li și Be au electroni distinctivi în subshell-ul 2s, iar în atomii de la B la Ne se adaugă electroni în subshell-ul 2p. În cea de-a treia perioadă, subshell-ul 3s se umple pentru Na și Mg și, prin urmare, pentru Al, Si, P, S, S, Cl și Ar. Ca regulă generală, în cazul elementelor reprezentative, electronul distinctiv se va afla într-o subshell ns sau np. Valoarea lui n, numărul cuantic principal pentru electronul distinctiv, poate fi determinată rapid prin numărarea descrescătoare din partea de sus a tabelului periodic. De exemplu, iodul este un element reprezentativ din a cincea perioadă. Prin urmare, electronul distinctiv trebuie să ocupe fie subshell-ul 5s, fie subshell-ul 5p. Deoarece I se află în partea dreaptă a tabelului, 5p este alegerea corectă.
Când numărul cuantic principal este trei sau mai mare, sunt posibile și subshell-uri de tip d. Elementele de tranziție sau metalele de tranziție sunt acele elemente al căror electron distinctiv se găsește într-un orbital d. Primele exemple de metale de tranziție (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) se găsesc în perioada a patra, chiar dacă electronul distinctiv în fiecare caz este un electron 3d și aparține celei de-a treia învelișuri. Acest hiatus rezultă, așa cum am văzut deja, deoarece 4s are o energie mai mică decât 3d. Astfel, orbitalul 4s începe să se umple, începând a patra perioadă înainte ca oricare dintre orbitalii 3d să poată fi ocupat.
Figura \(\PageIndex{1}\) compară distribuțiile de probabilitate ale unui electron 4s și ale unui electron 3d într-un atom V. Deși norul de electroni 4s se află, în medie, mai departe de nucleu decât norul 3d, o mică parte din densitatea de electroni 4s se găsește foarte aproape de nucleu, unde este cu greu protejată de sarcina nucleară totală de +23. Forța de atracție foarte puternică a acestei mici fracțiuni din densitatea totală de electroni 4s este cea care scade energia electronului 4s sub cea a electronului 3d.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
Faptul că norul electronic 4s este mai extins decât cel 3d are o influență importantă asupra chimiei elementelor de tranziție. Atunci când un atom precum V (Figura \(\PageIndex{1}\) ) interacționează cu un alt atom, electronii 4s care se întind cel mai departe de nucleu sunt cei care intră primii în contact cu celălalt atom. Astfel, electronii 4s sunt adesea mai importanți decât cei 3d în determinarea valenței și a formulelor compușilor. Electronii 3d sunt „îngropați” sub suprafețele atomilor din metalele de tranziție. Adăugarea unui electron 3d în plus are un efect considerabil mai mic asupra proprietăților chimice ale acestora decât a avut adăugarea unui electron 3s sau 3p în cazul elementelor reprezentative. Prin urmare, există o tranziție lentă, dar constantă a proprietăților de la un element de tranziție la altul. Observați, de exemplu, că, cu excepția Sc, toate metalele de tranziție formează cloruri, MCl2, în cazul în care metalul are o valență 2; exemple sunt TiCl2, VCl2, CrCl2 și așa mai departe. Acest lucru poate fi observat în tabelul găsit în partea de sus a acestei pagini. Valența 2 corespunde cu cei doi electroni de valență 4s.
Care dintre metalele de tranziție prezintă și alte valențe în care sunt implicați și unul sau mai mulți electroni 3d. De exemplu, în unii compuși, V (vanadiu) are valența 2 (VO, VCl2), în alții are valența 3 (V2O3, VCl3), în alții are valența 4 (VO2, VCl4), iar în cel puțin un caz (V2O5) are valența 5. Chimia metalelor de tranziție este mai complicată și este posibilă o varietate mai mare de formule pentru compușii metalelor de tranziție din cauza acestei valențe variabile. În unele cazuri, electronii din subshell-urile d acționează ca electroni de valență, în timp ce în alte cazuri nu o fac. Deși norii de electroni 3d nu se extind mai departe de nucleu decât 3s și 3p (și, prin urmare, nu constituie o altă înveliș, așa cum o fac electronii 4s), ei sunt bine protejați de sarcina nucleară și, prin urmare, acționează adesea ca electroni de valență. Acest comportament Jekyll și Hyde al electronilor 3d face viața mai complicată (și adesea mult mai interesantă) pentru chimiștii care studiază elementele de tranziție.
| Z | Element | Configurație | |||
|---|---|---|---|---|---|
| 1 | H | 1s 1 | |||
| 2 | He | 1s 2 | |||
| 3 | Li | 2s 1 | |||
| 4 | Be | 2s 2 | |||
| 5 | B | 2s 2 2p1 | |||
| 6 | C | 2s 2 2p2 | |||
| 7 | N | 2s 2 2p3 | |||
| 8 | 0 | 2s 2 2p4 | |||
| 9 | F | . 2s 2 2p5 | |||
| 10 | Ne | 2s 2 2p6 | |||
| 11 | Na | 3s 1 | |||
| 12 | Mg | 3s 2 | |||
| 13 | Al | 3s 2 3p1 | |||
| 14 | Si | 3s 2 3p2 | |||
| 15 | P | 3s 2 3p3 | |||
| 16 | S | 3s 2 3p4 | |||
| 17 | Cl | 3s 2 3p5 | |||
| 18 | Ar | 3s 2 3p6 | |||
| 19 | K | 4s 1 | |||
| 20 | Ca | 4s 2 | |||
| 21 | Sc | 3d 1 4s 2 | |||
| 22 | Ti | 3d 2 4s 2 | |||
| 23 | V | 3d 3 4s 2 | |||
| 24 | Cr | 3d 5 4s 1 | |||
| 25 | Mn | 3d 5 4s 2 | |||
| 26 | . Fe | 3d 6 4s 2 | |||
| 27 | Co | 3d 7 4s 2 | |||
| 28 | Ni | 3d 8 4s 2 | |||
| 29 | Cu | 3d 10 4s 1 | |||
| 30 | Zn | 3d 10 4s 2 | |||
| 31 | Ga | 3d 10 4s 2 4p 1 | |||
| 32 | Ge | 3d 10 4s 2 4p 2 | |||
| 33 | . As | 3d 10 4s 2 4p 3 | |||
| 34 | Se | 3d 10 4s 2 4p 4 | |||
| 35 | Br | 3d 10 4s 2 4p 5 | |||
| 36 | Kr | 3d 10 4s 2 4p 6 | |||
| 37 | Rb | 5s 1 | |||
| 38 | Sr | 5s 2 | |||
| 39 | Y | 4d 1 5s 2 | |||
| 40 | Zr | 4d 2 5s 2 | |||
| 41 | Nb | 4d 4 5s 1 | |||
| 42 | Mo | 4d 5 5s 1 | |||
| 43 | Tc | 4d 5 5s 2 | |||
| 44 | Ru | 4d 7 5s 1 | |||
| 45 | Rh | 4d 8 5s 1 | |||
| 46 | Pd | 4d 10 | |||
| 47 | Ag | 4d 10 5s 1 | |||
| 48 | Cd | 4d 10 5s 2 | |||
| 49 | In | 4d 10 5s 2 5p 1 | |||
| 50 | Sn | 4d 10 5s 2 5p 2 | |||
| 51 | Sb | 4d 10 5s 2 5p 3 | |||
| 52 | Te | 4d 10 5s 2 5p 4 | |||
| 53 | I | 4d 10 5s 2 5p 5 | |||
| 54 | Xe | 4d 10 5s 2 5p 6 | |||
| 55 | Cs | 6s 1 | |||
| 56 | Ba | 6s 2 | |||
| 57 | La | 5d 1 6s 2 | |||
| 58 | Ce | 4f 1 5d 1 6s 2 | |||
| 59 | Pr | 4f 3 6s 2 | |||
| 60 | Nd | 4f 4 6s 2 | |||
| 61 | Pm | 4f 5 6s 2 | |||
| 62 | Sm | 4f 6 6s 2 | |||
| 63 | Eu | 4f 7 6s 2 | |||
| 64 | Gd | 4f 7 5d 1 6s 2 | |||
| 65 | Tb | 4f 9 6s 2 | |||
| 66 | Dy | 4f 10 6s 2 | |||
| 67 | Ho | 4f 11 6s 2 | |||
| 68 | Er | 4f 12 6s 2 | |||
| 69 | Tm | 4f 13 6s 2 | |||
| 70 | Yb | 4f 14 6s 2 | |||
| 71 | Lu | 4f 14 5d 1 6s 2 | |||
| 72 | Hf | 4f 14 5d 2 6s 2 | |||
| 73 | Ta | 4f 14 5d 3 6s 2 | |||
| 74 | W | 4f 14 5d 4 6s 2 | |||
| 75 | . Re | 4f 14 5d 5 6s 2 | |||
| 76 | 0s | 4f 14 5d 6 6s 2 | |||
| 77 | Ir | 4f 14 5d 7 6s 2 | |||
| 78 | Pt | 4f 14 5d 9 6s 1 | |||
| 79 | Au | 4f 14 5d 10 6s 1 | |||
| 80 | Hg | 4f 14 5d 10 6s 2 | |||
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 | |||
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 | |||
| 83 | Bi | 4f 14 5d 10 6s 2 6p 3 | |||
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 | |||
| 85 | At | 4f 14 5d 10 6s 2 6p 5 | |||
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 | |||
| 87 | . Fr | 7s 1 | |||
| 88 | Ra | 7s 2 | |||
| 89 | Ac | 6d 1 7s 2 | |||
| 90 | Th | 6d 2 7s 2 | |||
| 91 | Pa | 5f 2 6d 1 7s 2 | |||
| 92 | U | 5f 3 6d 1 7s 2 | |||
| 93 | Np | 5f 4 6d 1 7s 2 | |||
| 94 | Pu | 5f 6 7s 2 | |||
| 95 | Am | 5f 7 7s 2 | |||
| 96 | Cm | 5f 7 6d 1 s 2 | |||
| 97 | Bk | 5f 9 s 2 | |||
| 98 | Cf | 5f 10 s 2 | |||
| 99 | Es | 5f 11 s 2 | |||
| 100 | Fm | 5f 12 s 2 | |||
| 101 | Md | 5f 13 s 2 | |||
| 102 | No | 5f 14 s 2 | |||
| 103 | Lr | 5f 14 6d 1 s 2 | |||
| 104 | Rf | 5f 14 6d 2 s 2 |
Cea de-a treia mare categorie de elemente apare atunci când electronul distinctiv ocupă un subshell f. Primul exemplu apare în cazul lantanoizilor (elemente cu numere atomice cuprinse între 57 și 71). lantanoizii au configurația electronică generală
4d104f i5s25p65d0 sau 16s2
unde i este un număr cuprins între 0 și 14. Astfel, în procesul de constituire a lantanoizilor, electronii sunt adăugați la un subshell (4f) al cărui număr cuantic principal este cu două mai mic decât cel al orbitalului cel mai exterior (6s). Adăugarea unui alt electron la un înveliș intern îngropat la fel de adânc ca și 4f are un efect redus sau chiar nul asupra proprietăților chimice ale acestor elemente. Toate sunt destul de asemănătoare cu lantanul (La) și s-ar putea încadra exact în același spațiu din tabelul periodic ca și La. Elementele lantanoide sunt atât de asemănătoare între ele încât sunt necesare tehnici speciale pentru a le separa. Ca urmare, chiar și probele aproximativ pure ale majorității lor nu au fost pregătite până în anii 1870. După elementul actiniu (Ac) urmează o serie de atomi în care se umple subshell-ul 5f. Actinoizii sunt ceva mai puțin asemănători cu Ac decât sunt lantanoizii cu La, deoarece în cazul lui Th, Pa și U apar unele excepții de la ordinea obișnuită a orbitalilor de umplere (Tabelul \(\PageIndex{1}\) ).
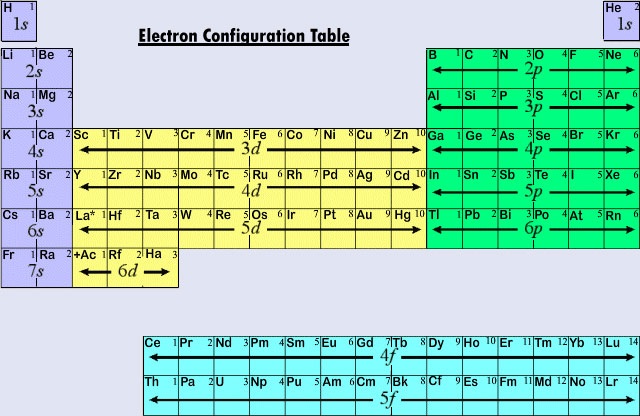
Pentru că lantanoidele și majoritatea actinoidelor se comportă chimic ca și cum ar trebui să se încadreze în grupa IIIB a tabelului periodic (unde se găsesc Lu și Lr), ambele grupe sunt separate de restul tabelului și plasate împreună într-un bloc de mai jos. Luate împreună, lantanoidele și actinoidele sunt numite elemente de tranziție interioară, deoarece subshell-urile f care sunt umplute se află atât de adânc în structura electronică rămasă a atomilor lor.
Figura \(\PageIndex{2}\) rezumă tipul de subshell în care trebuie să se găsească electronul distinctiv pentru atomii elementelor din diferite regiuni ale tabelului periodic. Aceste informații sumare fac relativ simplă utilizarea tabelului periodic pentru a obține configurațiile electronice, așa cum arată exemplul următor.
Exemplu \(\PageIndex{1}\): Configurația electronică
Obțineți configurația electronică pentru (a) Nb; (b) Pr.
Soluție
a) Nb, elementul cu numărul 41, se găsește în perioada a cincea și într-o regiune a tabelului periodic în care se umple o subînveliș d (a doua serie de tranziție). Mergând înapoi (spre numere atomice mai mici) în tabelul periodic, cel mai apropiat gaz nobil este Kr, și astfel folosim nucleul Kr:
Nb _____
Următorul element după 36K este 37Rb, în care se umple subshell-ul 5s. Deplasându-ne încă un spațiu spre dreapta, ajungem la 38Sr care are o pereche 5s2. Până acum avem Nb _____ 5s2 pentru configurația Nb. Acum ne deplasăm mai la dreapta în regiunea subshell-ului 4d din tabelul periodic și numărăm peste trei spații (Y, Zr, Nb) pentru a ajunge la Nb. Configurația totală a electronilor este astfel Nb 4d35s2 (Rețineți că numărul cuantic principal al subshell-ului d este 4 – cu unul mai puțin decât numărul perioadei. De asemenea, dacă vă uitați la tabelul de configurații electronice, trebuie remarcat faptul că Nb este o excepție de la regulile tipice de umplere a orbitalilor) b) O procedură similară este urmată pentru Pr, elementul cu numărul 59. Mergând înapoi în tabel, cel mai apropiat gaz nobil este Xe și, prin urmare, folosim nucleul Xe. Numărând din nou înainte, Cs și Ba corespund la 6s2. Apoi, La, Ce și Pr corespund la încă trei electroni în subshell-ul 4f. Configurația este astfel Pr…4f36s2
Încă un aspect trebuie subliniat cu privire la relația dintre configurația electronică și tabelul periodic. Atomii elementelor din aceeași coloană verticală a tabelului au configurații electronice similare. De exemplu, luați în considerare elementele alcalino-pământoase (grupa IIA). Folosind regulile noastre de derivare a configurațiilor electronice (Exemplul 1) avem
| Element | Configurație electronică | Diagrama Lewis | ||
|---|---|---|---|---|
| Be | 2s2 | Be: | ||
| Mg | 3s2 | Mg: | ||
| Ca | 4s2 | Ca: | ||
| Sr | 5s2 | Sr: | 5s2 | Sr: |
| Ba | 6s2 | Ba: | Ba: | |
| Ra | 7s2 | Ra: |
Astfel, asemănările de comportament chimic și de valență observate anterior pentru aceste elemente se corelează cu asemănările norilor lor electronici cei mai exteriori. Astfel de asemănări explică succesul predicțiilor lui Mendeleev cu privire la proprietățile elementelor nedescoperite.
Contribuitori și atribuții
-
Ed Vitz (Universitatea Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff și Adam Hahn.
