\
În funcție de proprietățile acido-bazice ale ionilor săi componenți, o sare se poate dizolva în apă pentru a produce o soluție neutră, o soluție bazică sau o soluție acidă.
Când o sare precum \(NaCl\) se dizolvă în apă, aceasta produce ioni \(Na^+_{(aq)}\) și \(Cl^-_{(aq)}\). Utilizând o abordare Lewis, ionul \(Na^+\) poate fi considerat un acid, deoarece este un acceptor de perechi de electroni, deși sarcina sa scăzută și raza relativ mare îl fac un acid foarte slab. Ionul \(Cl^-\) este baza conjugată a acidului puternic \(HCl\), deci nu are în esență caracter bazic. În consecință, dizolvarea \(NaCl\) în apă nu are niciun efect asupra \(pH\) unei soluții, iar soluția rămâne neutră.
Acum să comparăm acest comportament cu cel al soluțiilor apoase de cianură de potasiu și acetat de sodiu. Din nou, cationii (\(K^+\) și \(Na^+\)) nu au în esență niciun caracter acid, dar anionii (\(CN^-\) și \(CH_3CO_2^-\)) sunt baze slabe care pot reacționa cu apa, deoarece sunt bazele conjugate ale acizilor slabi \(HCN\) și, respectiv, ale acidului acetic.
\
\
Niciuna dintre cele două reacții nu se desfășoară foarte mult spre dreapta, așa cum este scris, deoarece este favorizată formarea perechii acid-bază mai slabă. Atât \(HCN\), cât și acidul acetic sunt acizi mai puternici decât apa, iar hidroxidul este o bază mai puternică decât acetatul sau cianura, astfel că, în ambele cazuri, echilibrul se află la stânga. Cu toate acestea, fiecare dintre aceste reacții generează suficienți ioni de hidroxid pentru a produce o soluție bazică. De exemplu, \(pH\) unei soluții de 0,1 M de acetat de sodiu sau cianură de potasiu la 25°C este de 8,8, respectiv 11,1. Din tabelul \(\(\PageIndex{1}\) și figura \(\PageIndex{1}\), putem observa că \(CN^-\) este o bază mai puternică (\(pK_b = 4,79\)) decât acetatul (\(pK_b = 9.24\)), ceea ce este în concordanță cu faptul că \(KCN\) produce o soluție mai bazică decât acetatul de sodiu la aceeași concentrație.
În schimb, acidul conjugat al unei baze slabe ar trebui să fie un acid slab (Ecuația \(\ref{16.2}\)). De exemplu, clorura de amoniu și clorura de piridiniu sunt săruri produse prin reacția amoniacului și, respectiv, a piridinei, cu \(HCl\). După cum știți deja, ionul de clorură este o bază atât de slabă încât nu reacționează cu apa. În schimb, cationii celor două săruri sunt acizi slabi care reacționează cu apa, după cum urmează:
\
\
Ecuația \(\ref{16.2}}\) indică faptul că \(H_3O^+\) este un acid mai puternic decât \(NH_4^+\) sau \(C_5H_5NH^+\) și, invers, amoniacul și piridina sunt ambele baze mai puternice decât apa. Prin urmare, echilibrul se va situa mult spre stânga în ambele cazuri, favorizând perechea acid-bază mai slabă. Cu toate acestea, concentrația de \(H_3O^+\) produsă de reacții este suficient de mare pentru a scădea semnificativ \(pH\) soluției: \(pH\) unei soluții de 0,10 M de clorură de amoniu sau de clorură de piridiniu la 25°C este de 5,13, respectiv 3,12. Acest lucru este în concordanță cu informațiile prezentate în figura 16.2, indicând că ionul de piridiniu este mai acid decât ionul de amoniu.
Ce se întâmplă cu soluțiile apoase ale unei săruri precum acetatul de amoniu, unde atât cationul, cât și anionul pot reacționa separat cu apa pentru a produce un acid și, respectiv, o bază? Conform figurii 16.10, ionul de amoniu va scădea \(pH\), în timp ce, conform ecuației \(\ref{16.3}\), ionul de acetat va crește \(pH\). Acest caz particular este neobișnuit, în sensul că cationul este un acid la fel de puternic precum anionul este o bază (pKa ≈ pKb). În consecință, cele două efecte se anulează, iar soluția rămâne neutră. În cazul sărurilor în care cationul este un acid mai puternic decât anionul este o bază, soluția finală are un \(pH\) < 7,00. Invers, dacă cationul este un acid mai slab decât anionul este o bază, soluția finală are un \(pH\) > 7,00.
Soluțiile de săruri simple de ioni metalici pot fi, de asemenea, acide, chiar dacă un ion metalic nu poate dona un proton direct apei pentru a produce \(H_3O^+\). În schimb, un ion metalic poate acționa ca un acid Lewis și interacționa cu apa, o bază Lewis, prin coordonarea cu o pereche de electroni solitari de pe atomul de oxigen pentru a forma un ion metalic hidratat (partea (a) din figura \(\PageIndex{1}\)). O moleculă de apă coordonată cu un ion metalic este mai acidă decât o moleculă de apă liberă din două motive. În primul rând, interacțiunile electrostatice repulsive dintre ionul metalic încărcat pozitiv și atomii de hidrogen parțial încărcați pozitiv ai moleculei de apă coordonată fac ca apa coordonată să piardă mai ușor un proton.
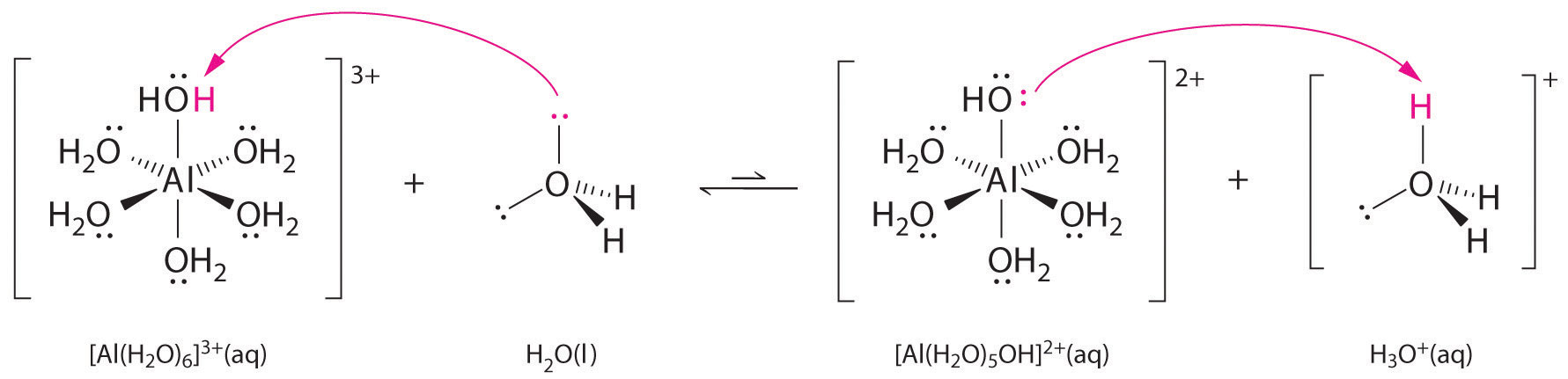
În al doilea rând, sarcina pozitivă a ionului \(Al^{3+}\) atrage densitatea de electroni de la atomii de oxigen ai moleculelor de apă, ceea ce scade densitatea de electroni în legăturile \(\ce{O-H}\), așa cum se arată în partea (b) din figura \(\PageIndex{1}\). Cu o densitate mai mică de electroni între atomii de \(O\) și atomii de H, legăturile \(\ce{O-H}\) sunt mai slabe decât într-o moleculă de \(H_2O\) liberă, ceea ce face mai ușoară pierderea unui ion \(H^+\).
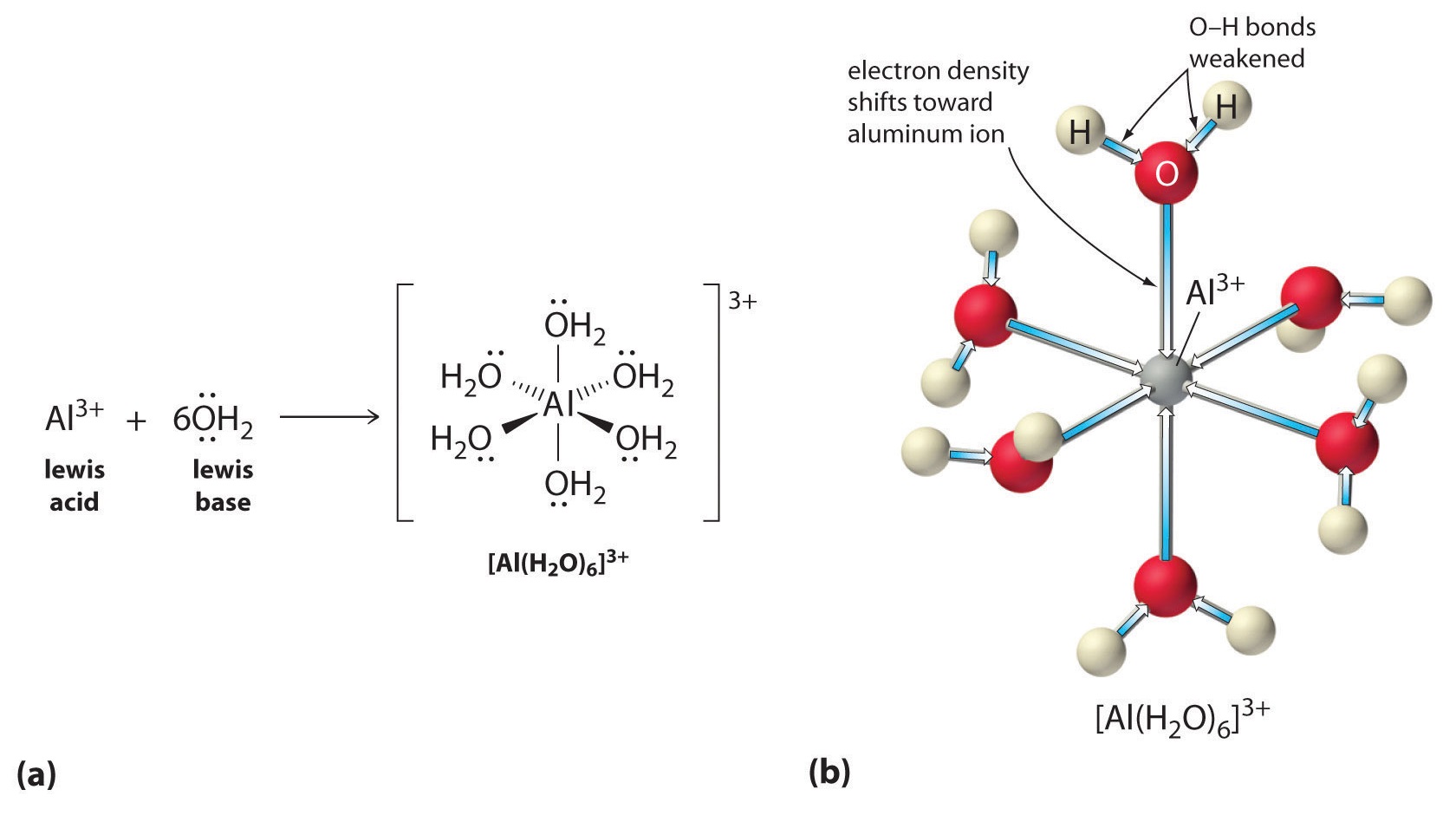
Figura \(\PageIndex{1}\): Efectul unui ion metalic asupra acidității apei (a) Reacția ionului metalic \(Al^{3+}\) cu apa pentru a forma ionul metalic hidratat este un exemplu de reacție acido-bazică de tip Lewis. (b) Sarcina pozitivă a ionului de aluminiu atrage densitatea de electroni de la atomii de oxigen, ceea ce deplasează densitatea de electroni departe de legăturile O-H. Scăderea densității de electroni slăbește legăturile O-H din moleculele de apă și facilitează pierderea unui proton de către acestea.
Mărimea acestui efect depinde de următorii doi factori (Figura \(\PageIndex{2}\)):
- Carcina pe ionul metalic. Un ion divalent (\(M^{2+}\)) are un efect aproximativ de două ori mai puternic asupra densității de electroni dintr-o moleculă de apă coordonată decât un ion monovalent (\(M^+\)) de aceeași rază.
- Raza ionului metalic. Pentru ionii metalici cu aceeași sarcină, cu cât ionul este mai mic, cu atât distanța internucleară față de atomul de oxigen al moleculei de apă este mai mică și cu atât mai mare este efectul metalului asupra distribuției densității electronice în molecula de apă.
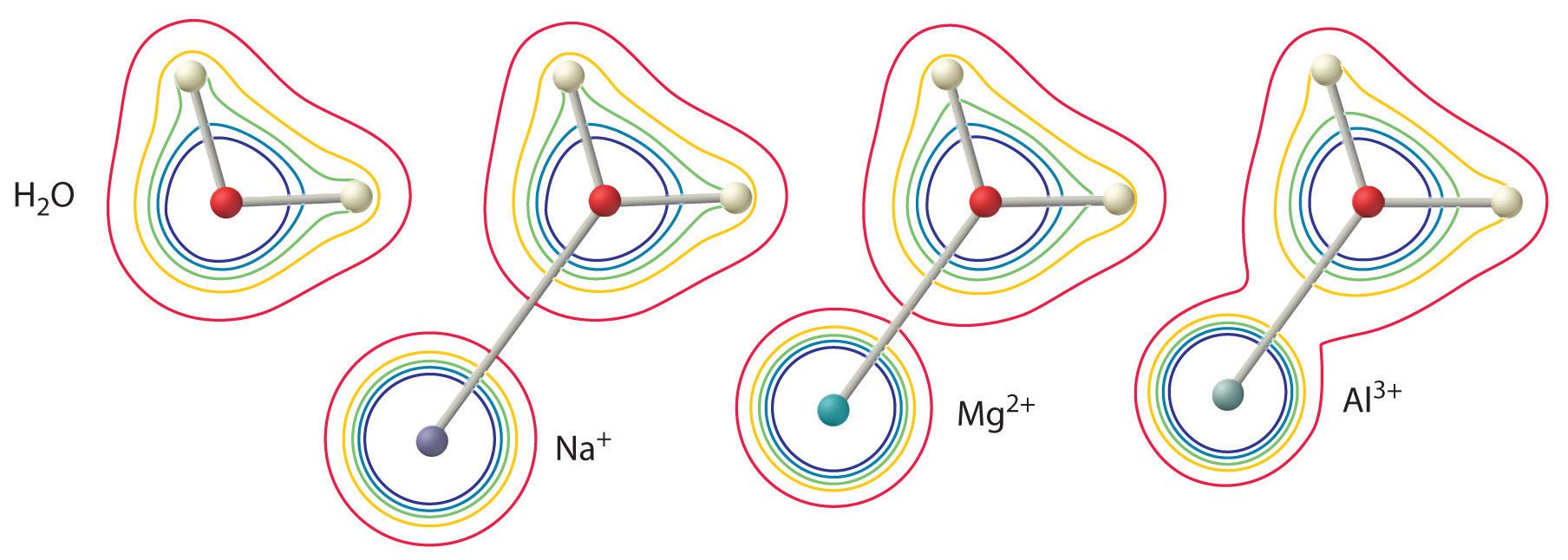
Figura \(\PageIndex{2}\): Efectul sarcinii și razei unui ion metalic asupra acidității unei molecule de apă coordonate. Contururile arată densitatea de electroni pe atomii de O și pe atomii de H atât într-o moleculă de apă liberă (stânga), cât și în moleculele de apă coordonate cu ioni \(Na^{+\), \(Mg^{2+}\) și \(Al^{3+}\). Aceste hărți de contur demonstrează că cel mai mic și mai puternic încărcat ion metalic (\(Al^{3+}\)) provoacă cea mai mare scădere a densității electronice a legăturilor O-H ale moleculei de apă. Datorită acestui efect, aciditatea ionilor metalici hidratați crește pe măsură ce sarcina ionului metalic crește și raza acestuia scade.
Din acest motiv, soluțiile apoase de ioni metalici mici, foarte încărcați, cum ar fi \(Al^{3+}\) și \(Fe^{3+}\), sunt acide:
\^{3+}_{(aq)} \rightleftharpoons ^{2+}_{(aq)}+H^+_{(aq)} \label{16.36}\]
Ionul \(^{3+}\) are un \(pK_a\) de 5,0, ceea ce îl face un acid aproape la fel de puternic ca și acidul acetic. Din cauza celor doi factori descriși anterior, cel mai important parametru pentru prezicerea efectului unui ion metalic asupra acidității moleculelor de apă coordonate este raportul sarcină/rază al ionului metalic. Un număr de perechi de ioni metalici care se află pe o linie diagonală în tabelul periodic, cum ar fi \(Li^+\) și \(Mg^{2+}\) sau \(Ca^{2+}\) și \(Y^{3+}\), au dimensiuni și sarcini diferite, dar raporturi similare între sarcină și rază. Ca urmare, aceste perechi de ioni metalici au efecte similare asupra acidității moleculelor de apă coordonate și prezintă adesea și alte asemănări semnificative din punct de vedere chimic.
Soluțiile de ioni metalici mici, foarte încărcați în apă sunt acide.
Reacțiile precum cele discutate în această secțiune, în care o sare reacționează cu apa pentru a da o soluție acidă sau bazică, sunt adesea numite reacții de hidroliză. Folosirea unui nume separat pentru acest tip de reacție este nefericită, deoarece sugerează că ele sunt cumva diferite. De fapt, reacțiile de hidroliză sunt doar reacții acido-bazice în care acidul este un cation sau baza este un anion; ele se supun acelorași principii și reguli ca toate celelalte reacții acido-bazice.
Reacția de hidroliză este o reacție acido-bazică.
Exemplu \(\PageIndex{1}\)
Precizați dacă soluțiile apoase ale acestor compuși sunt acide, bazice sau neutre.
- \(KNO_3\)
- \(CrBr_3 cdot H_2O\)
- \(Na_2SO_4\)
Dat: compus
Întrebat: aciditatea sau bazicitatea soluției apoase
Strategie:
- Evaluați proprietățile acido-bazice ale cationului și anionului. Dacă cationul este un acid Lewis slab, acesta nu va afecta \(pH\) soluției. Cu toate acestea, dacă cationul este acidul conjugat al unei baze slabe sau al unui cation metalic relativ puternic încărcat, acesta va reacționa cu apa pentru a produce o soluție acidă.
- Dacă anionul este baza conjugată a unui acid puternic, nu va afecta \(pH\) soluției. Dacă, totuși, anionul este baza conjugată a unui acid slab, soluția va fi bazică.
Soluție:
a
- Cationul \(K^+\) are o sarcină pozitivă mică (+1) și o rază relativ mare (deoarece se află în al patrulea rând al tabelului periodic), deci este un acid Lewis foarte slab.
- Anionul \(NO_3-\) este baza conjugată a unui acid puternic, deci nu are practic niciun caracter bazic (tabelul 16.1). Prin urmare, nici cationul, nici anionul nu vor reacționa cu apa pentru a produce \(H^+\) sau \(OH^-\), iar soluția va fi neutră.
b.
- Ionul \(Cr^{3+}\) este un cation metalic relativ puternic încărcat care ar trebui să se comporte în mod similar cu ionul \(Al^{3+}\) și să formeze complexul \(^{3+}\), care se va comporta ca un acid slab: \^{3+}_{(aq)} \ce{ <=>>}}. Cr(H_2O)_5(OH)]^{2+}_{(aq)} + H^+_{(aq)} \numărul nehotărât\]
- Anionul \(Br^-\) este o bază foarte slabă (este baza conjugată a acidului puternic \(HBr\)), deci nu afectează \(pH-ul\) soluției. Prin urmare, soluția va fi acidă.
c.
- Ionul \(Na^+\), ca și \(K^+\), este un acid foarte slab, deci nu ar trebui să afecteze aciditatea soluției.
- În schimb, \(SO_4^{2-}\) este baza conjugată a \(HSO_4^-\), care este un acid slab. Prin urmare, ionul \(SO_4^{2-}\) va reacționa cu apa, așa cum se arată în figura 16.6, pentru a da o soluție ușor bazică.
Exercițiu \(\PageIndex{1}\)
Precizați dacă soluțiile apoase ale următoarelor sunt acide, bazice sau neutre.
- \(KI\)
- \(Mg(ClO_4)_2\79>
- \(NaHS\)
Răspuns:
- neutru
- acid
- bazic (datorită reacției lui \(HS^-\) cu apa pentru a forma \(H_2S\) și \(OH^-\))
Rezumat
O sare se poate dizolva în apă pentru a produce un neutru, o soluție bazică sau o soluție acidă, în funcție de faptul dacă conține baza conjugată a unui acid slab ca anion (\(A^-\)), acidul conjugat al unei baze slabe ca și cation (\(BH^+\)) sau ambele. Sărurile care conțin ioni metalici mici, foarte încărcați, produc soluții acide în apă. Reacția unei săruri cu apa pentru a produce o soluție acidă sau bazică se numește reacție de hidroliză.
.
