A: AMINO ACIDE
BIOCHIMIE – DR. JAKUBOWSKI
Ultima actualizare: 02/27/16
București de învățare/obiective pentru capitolul 2A: După orele de curs și această lectură, elevii vor fi capabili să
- stabilească sarcina lanțurilor laterale ale aminoacizilor folosind ecuația Henderson Hasselbach și sarcina aproximativă prin inspecție la orice pH dat
- deseneze mecanismele și să identifice produsele pentru reacția lanțurilor laterale nucleofile Lys și Cys cu agenți chimici comuni de modificare și să extindă această înțelegere la reacțiile lui His.
- desenați mecanisme pentru reacțiile de schimb de disulfură pentru sulfhidrile, folosindu-le și numerele de oxidare pentru a explica reacțiile redox ale cisteinei/cistinei.
A7. Chimia cistinei
Două lanțuri laterale de cisteină pot interacționa covalent într-o proteină pentru a produce o disulfură. La fel cum HOOH (peroxidul de hidrogen) este mai oxidat decât HOH (O din H2O2 are numărul de oxidare 1- în timp ce O din H2O are numărul de oxidare 2-) , RSSR este forma oxidată (numărul de oxidare S 1-) și RSH este forma redusă (numărul de oxidare S 2-) a tiolilor. Aceste numere de oxidare sunt analoge, deoarece O și S sunt ambele în grupa 6 din tabelul periodic și ambele sunt mai electronegative decât C.
O scurtă trecere în revistă a reacțiilor redox și a numerelor de oxidare.
Figura: REACȚII DE DISULFID – CISTINE – REACȚII
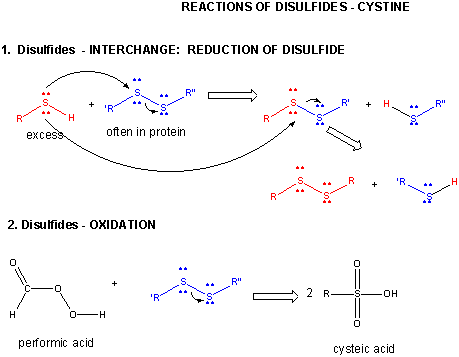
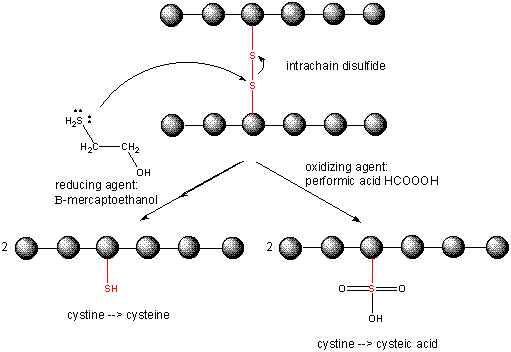
Când o proteină se pliază, două lanțuri laterale Cys ar putea să se apropie unul de celălalt și să formeze o legătură disulfură intracatenară. De asemenea, două lanțuri laterale Cys de pe proteine separate s-ar putea apropia unul de celălalt și să formeze o disulfură intercatenă. Astfel de disulfuri trebuie scindate, iar lanțurile trebuie separate înainte de a analiza secvența proteinei. Disulfura din proteină poate fi scindată de agenți reducători, cum ar fi beta-mercaptoetanolul, ditiotreitolul, tris (2-carboxietil) fosfină (TCEP) sau agenți oxidanți care oxidează în continuare disulfura pentru a separa acizii cisteici.
Figura: Agenți de oxidare a disulfidelor – b-mercaptoetanol, ditiotreitol și fosfine
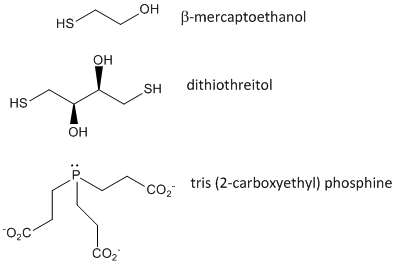
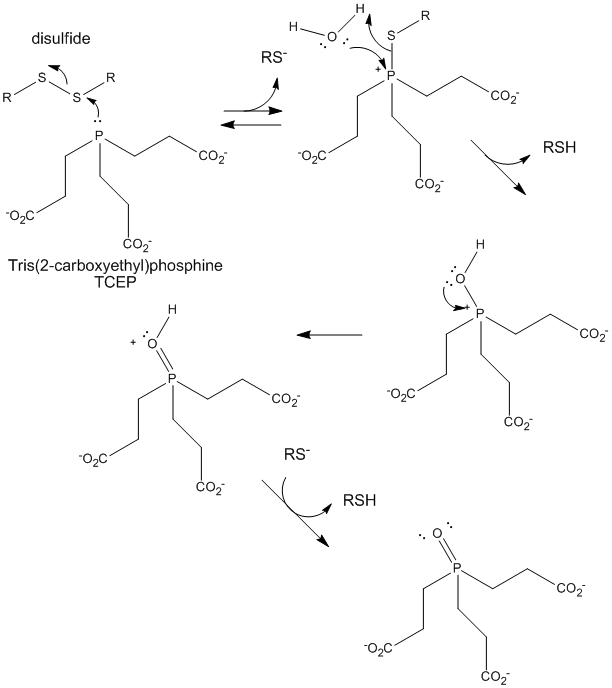
Figura: Reducerea TCEP a disulfidelor
Interiorul celulelor este menținut într-un mediu redus prin prezența a numeroși agenți „reducători”, cum ar fi tripeptida g-glu-cys-gly (glutationul). Prin urmare, proteinele intracelulare nu conțin, de obicei, disulfuri, care sunt abundente în proteinele extracelulare (cum ar fi cele găsite în sânge) sau în anumite organite, cum ar fi reticulul endoplasmatic și spațiul intermembranar mitocondrial, unde pot fi introduse disulfidesc.
Figura:
Cuplarea legăturilor disulfidice în proteine
Chimia redox a cisteinei
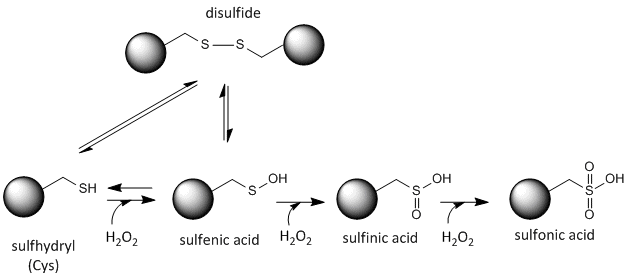
Sulfurul din cisteină este redox-activ și, prin urmare, poate exista într-o mare varietate de stări, în funcție de mediul redox local și de prezența agenților oxidanți și reducători. Un agent oxidant puternic care poate fi produs în celule este peroxidul de hidrogen, care poate duce la modificări chimice mai drastice și ireversibile ale lanțurilor laterale ale Cys. Dacă o Cys reactivă este importantă pentru funcția proteică, atunci funcția proteinei poate fi modulată (uneori în mod reversibil, alteori ireversibil) cu diferiți agenți oxidanți, așa cum se arată în figura de mai jos.
Figura: Starea redox a cisteinei
Navigație
Întoarceți laCapitolul 2A: Secțiuni de aminoacizi
Întoarceți laBiochimie Online Table of Contents
Versiune arhivată integrală a Capitolului 2A: Aminoacizi
.
