Introducere
Boala diverticulară a colonului reprezintă cea mai frecventă boală care afectează intestinul gros în lumea occidentală. Prevalența bolii diverticulare a crescut în ultimul secol în întreaga lume, probabil din cauza schimbărilor în stilul de viață, cum ar fi fumatul, excesul de greutate și, în general, inactivitatea fizică și dieta săracă în fibre. Prevalența crește odată cu vârsta, variind de la aproximativ 5% la adulții cu vârsta mai mică de 40 de ani la 50-70% în rândul celor cu vârsta de 80 de ani sau mai mult; 80% dintre pacienții care se prezintă cu diverticulită au 50 de ani sau mai mult. Diverticulii se pot prezenta în număr de la solitari la sute, au în mod obișnuit un diametru de 5-10 mm, dar pot depăși 2 cm. Diverticuloza apare în principal în colonul sigmoid și descendent la mai mult de 90% dintre pacienți, dar poate fi predominantă în grade diferite în restul colonului.1
Există mai mulți termeni legați de diverticule care vor fi utilizați în această analiză. Prezența diverticulilor în colon în absența unei inflamații evidente se numește diverticuloză sau boală diverticulară necomplicată (UDD). Aceasta poate fi simptomatică sau asimptomatică. Termenul „diverticulită acută a colonului” (DAC) este utilizat pentru a descrie inflamația diverticulilor, care poate sau nu să evolueze spre complicații (DAC complicată). Există, de asemenea, diverticulita cronică, din cauza diverticulitei recurente sau din cauza dezvoltării unei colite segmentare asociate cu diverticulii. În concluzie, spectrul clinic al bolii diverticulare este larg.
Studiile privind istoria naturală a bolii evidențiază faptul că marea majoritate a pacienților cu diverticule (aproximativ 80%) vor rămâne asimptomatici pe tot parcursul vieții lor. Din cei 15-20% care dezvoltă simptome, aproximativ 1/4 vor avea în cele din urmă un episod de boală diverticulară dureroasă simptomatică fără inflamație și până la 10-25% vor avea un episod de ACD. Aproximativ 1-2% vor necesita spitalizare și 0,5% intervenție chirurgicală. Diverticulii sunt responsabili de majoritatea (24-42%) episoadelor de hemoragie gastrointestinală inferioară.2-4
Fiziopatologie și dezvoltarea simptomelor
Un diverticul colonic este o hernie a mucoasei și submucoasei, corespunzând unui punct slab în care vasa recti penetrează tunica musculară. Mecanismele patogenetice ale bolii diverticulare sunt încă slab înțelese, însă este în general recunoscut faptul că acestea sunt probabil legate de interacțiuni complexe între dietă, microbiota colonică, factori genetici, motilitatea și structura colonului, care au ca rezultat formarea diverticulilor colonici în timp.5 Vezi Fig. 1. În 1971, Painter și Burkitt au publicat faimoasa lor ipoteză conform căreia boala diverticulară era cauzată de un exces de presiune în colon datorat segmentării bazate pe un aport insuficient de fibre alimentare. Ca răspuns la presiunea intraluminală crescută, se pot dezvolta și proeminențe în zonele de potențială slăbiciune.6 Staza sau obstrucția în diverticulul cu gât îngust poate duce la o creștere excesivă a bacteriilor și la ischemia locală a țesuturilor, ducând în cele din urmă la perforație.7 De atunci, numeroase studii observaționale au încercat să demonstreze posibilul efect al fibrelor în prevenirea bolii diverticulare. Cele mai multe dintre acestea au concluzionat că riscul de UDD a fost invers asociat cu aportul de fibre alimentare.8-10 Pe baza acestor dovezi, în majoritatea ghidurilor și documentelor de poziție actuale se recomandă o dietă bogată în fibre pentru a preveni boala diverticulară.11-15 Cu toate acestea, această ipoteză a fost recent contestată deoarece: (1) asocierea inversă dintre aportul de fibre și diverticuloză a fost pusă sub semnul întrebării în unele studii epidemiologice recente16,17 și (2) apar noi ipoteze patogene, cum ar fi ipoteza neuropatică și miopatică.18-22 Alți factori care au fost asociați cu un risc crescut de boală diverticulară includ inactivitatea fizică, constipația, obezitatea și fumatul.23-27
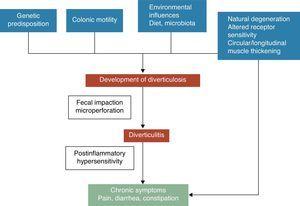
Dezvoltarea simptomelor în boala diverticulară este probabil legată de interacțiuni complexe între caracteristicile genetice, structura colonului, motilitatea intestinală inflamația de grad scăzut și hipersensibilitatea postinflamatorie.
Asociația dintre boala diverticulară necomplicată (UDD) și simptome este incertă. Există unele dovezi care sugerează că boala diverticulară dureroasă ar putea fi o afecțiune legată de inflamație și de efectele acesteia asupra funcției neuromusculare din colon.22-28 Prezența unei inflamații intestinale cronice, de grad scăzut, ar induce o disfuncție senzorio-motorie, ceea ce ar duce la dezvoltarea și/sau persistența simptomelor. Modificările în microflora intestinală ar putea fi unul dintre mecanismele putative responsabile de inflamația de grad scăzut. Creșterea excesivă a bacteriilor, ajutată de staza fecală din interiorul diverticulilor, ar putea contribui la inflamația cronică de grad scăzut care sensibilizează atât neuronii eferenți primari intrinseci, cât și neuronii aferenți primari extrinseci. Aceste modificări ar putea duce la hipertrofia mușchilor netezi și la o sensibilitate crescută la distensia abdominală și, în cele din urmă, la apariția simptomelor.3,22 A se vedea Fig. 1.
După cum am menționat mai sus, majoritatea persoanelor cu diverticuloză colonică rămân asimptomatice, dar în cele din urmă pot dezvolta complicații precum ACD sau sângerare diverticulară. În acest articol ne vom concentra pe ACD. Manifestarea clinică a acestui eveniment va depinde de o serie de factori, inclusiv dimensiunea perforației, nivelul de contaminare extracolonică și capacitatea organismului de a conține această contaminare.29,30
Managementul bolii diverticulareManagementul bolii diverticulare necomplicate (UDD)
La pacienții cu UDD asimptomatică,2 se poate recomanda o dietă bogată în fibre datorită posibilului său beneficiu profilactic în prevenirea UDD simptomatice și a complicațiilor. Nu există dovezi că alte medicamente sunt utile la acești pacienți.
Există mai multe dovezi privind beneficiul tratamentului în UDD simptomatic. Cel mai frecvent simptom este durerea abdominală, care poate fi exacerbată de alimentație și ameliorată de defecație sau de eliminarea de flatus. Alte simptome sunt greața, diareea, constipația și balonarea. Peste 61% dintre pacienții cu UDD simptomatic, care nu iau nicio măsură terapeutică pentru a preveni reapariția simptomelor, vor deveni simptomatici în decurs de 1 an, iar aproximativ 4% vor dezvolta complicații.31
Cinci agenți au fost propuși pentru tratament (vezi Fig. 2):

Tratamentul bolii diverticulare necomplicate. Mecanisme de acțiune.
A) Dietă bogată în fibre sau agenți de încărcare
Diverse studii randomizate controlate (RCT) și alte studii intervenționale evaluează efectul fibrelor în UDD simptomatică, dar cu rezultate inconsistente.32-37 În orice caz, fibrele sunt recomandate în prevenirea și tratamentul UDD simptomatice, precum și în prevenirea ACD de către majoritatea ghidurilor și documentelor de poziție actuale.11-15
B) Terapia cu antibiotice
Raționamentul pentru utilizarea antibioticelor în UDD simptomatice nu este clar stabilit. Studii recente sugerează că modificările microbiotei intestinale (supracreștere bacteriană intestinală) ar putea contribui la apariția simptomelor datorită producției excesive de gaze intestinale prin fermentarea carbohidraților. Pentru a evita efectele sistematice, antimicrobienele slab absorbite care acționează împotriva agenților patogeni enterici, dar care prezintă un risc minim de toxicitate sistematică sau de efecte secundare par a fi cele mai potrivite antibiotice. A fost propusă Rifaximina.
Rifaximina
Rifaximina este un analog nesistematic al rifamicinei cu un spectru larg de activitate in vitro. Rifaximina poate scădea activitatea metabolică a florei intestinale, crescând masa fecală, și poate, de asemenea, să eradicheze supracreșterea bacteriană. Acest antibiotic are un profil de siguranță și de tolerabilitate ridicat.33,38 Nivelul plasmatic al rifaximinei este minim, prin urmare, agenții patogeni non-enterici nu sunt expuși unei presiuni selective, iar riscul de rezistență bacteriană este scăzut.39 Trei RCT-uri deschise și două dublu-orb40-44 au examinat eficacitatea administrării ciclice de rifaximină și fibre în reducerea simptomelor în comparație cu cea a administrării de fibre singure. O revizuire sistematică și două meta-analize au analizat aceste studii.44-46 Acestea au concluzionat că tratamentul combinat este eficient în obținerea unei ameliorări a simptomelor la 1 an la pacienții cu UDD. 35% dintre pacienții tratați doar cu fibre au fost asimptomatici, comparativ cu 64% în grupurile de tratament combinat. Numărul necesar pentru tratament a fost de trei pentru rifaximină față de placebo pentru ameliorarea simptomelor și de nouă pentru evitarea complicațiilor. Pe scurt, cele mai bune rezultate au fost obținute folosind o combinație de fibre solubile, cum ar fi glucomananul, și rifaximină 1 săptămână în fiecare lună.
C) Probioticele
Probioticele sunt microorganisme vii care pot restabili flora intestinală comensală care poate fi alterată în boala diverticulară din cauza stazei și a reducerii timpului de tranzit colonic.47 Din păcate, există puține date disponibile cu privire la utilizarea lor în UDD simptomatic și majoritatea studiilor sunt mici și necontrolate. Majoritatea acestora arată o ameliorare a simptomelor.48-50
Probioticele au fost, de asemenea, studiate în combinație cu 5-aminosalicilat (5-ASA). Tursi și colegii au efectuat trei RCT comparând 5-ASA singur, probioticele singure sau terapia combinată.51-53 Atât 5-ASA cât și probioticele au părut a fi eficiente pentru prevenirea UDD simptomatice, dar combinația lor a fost mai bună. Un recent RCT dublu-bind publicat de același grup științific a concluzionat că atât mesalazina ciclică, cât și Lactobacillus casei subsp DG, în special în combinație, par a fi mai bune decât placebo pentru menținerea remisiunii UDD simptomatice.54 Dar, pe scurt, designul slab al studiilor și dimensiunea redusă a acestora nu permit concluzii definitive.
D) 5-ASA: mesalazina
Mesalazina are efecte antiinflamatorii și antioxidante. În 2010, Gatta și colab.,55 au publicat o analiză sistematică Cochrane care a evaluat rolul 5-ASA la pacienții cu boală diverticulară. Autorii au concluzionat că 5-ASA poate fi eficient în tratamentul acestei boli și că mesalazina zilnică a fost mai bună decât administrarea ciclică pentru a preveni recidiva. Pentru confirmarea observațiilor lor sunt necesare RCT de înaltă calitate și bine concepute. De fapt, primul studiu dublu-orb controlat cu placebo a constatat că mesalazina este eficientă în ameliorarea durerii la pacienții cu UDD acută.56 De asemenea, există două RCT interesante care au arătat un beneficiu pentru mesalazină în comparație cu rifaximina în ceea ce privește prevenirea recidivei simptomatice și un succes similar în menținerea remisiunii pe termen lung în comparație cu probioticul Lactobacillus casei.53,57
E) Agenți anticolinergici/antispasmodici
Hipermotilitatea colonului în diverticuloză sugerează că agenții antispasmodici, cum ar fi diciclomina și iosciamina, ar putea ameliora simptomele prin diminuarea contracției musculare. Dar, nu există niciun RCT care să confirme acest beneficiu.
F) Evitați tratamentul cu AINS
Diverse studii controlate au arătat că AINS reprezintă un factor de risc pentru dezvoltarea simptomelor, ACD, perforație și hemoragie.7,58-60 Utilizatorii de AINS au un risc mai mare de a dezvolta boli diverticulare simptomatice decât non-utilizatorii (RR: 1,5, IC 95%: 1,1-2,1).58 Iar la pacienții cu boli diverticulare complicate a existat o utilizare mai mare a AINS în comparație cu controalele fără boală. S-a emis ipoteza că acest risc crescut s-a datorat deteriorării mucoasei, ceea ce a dus la afectarea funcției de barieră a mucoasei colonice, permițând translocarea bacteriilor, care provoacă inflamație.
G) Nivelurile de vitamina D
Se pare că incidența DCA a fost asociată cu variații geografice și sezoniere. Din acest motiv, Maguire et al. au efectuat două studii observaționale interesante care au arătat că nivelurile scăzute de vitamina D și expunerea scăzută la lumina UV (expunerea la UV determină statutul vitaminei D) sunt asociate cu un risc semnificativ mai mare de ACD. Sunt necesare mai multe studii de înaltă calitate înainte de a face o recomandare.61,62
Tratamentul diverticulitei acute a colonului (ACD)
Deși majoritatea persoanelor cu diverticuloză rămân asimptomatice, se estimează că aproximativ 10-25% dintre acestea vor dezvolta un episod de ACD stâng.63 În general, diagnosticul clinic nu este suficient de precis și sunt indicate tehnicile radiologice. La pacienții cu simptome ușoare (majoritatea) și fără semne de ACD complicată, combinația de durere în partea inferioară a abdomenului stâng, absența vărsăturilor și o proteină C reactivă >50mg/l, poate fi suficientă pentru diagnostic.64,65 În cazul în care imagistica este indicată, probabil, o strategie condiționată, cu ecografie ca tehnică de primă linie și urmată de tomografie computerizată (CT), dacă ecografia este neconcludentă sau îndoielnică, poate reprezenta cea mai eficientă abordare. Numărul de examinări CT poate fi redus cu 50%. În 1978, Hinchey și colab. au propus o clasificare a DCA, care a fost modificată ulterior.66,67 Aceasta distinge cinci stadii ale DCA; stadiul 0, diverticulită ușoară din punct de vedere clinic, stadiul I (a: inflamație pericic și b: abces
cm în apropierea inflamației primare), stadiul II, abces intraabdominal, pelvian sau retroperitoneal sau abces la distanță de inflamația primară, stadiul III, peritonită purulentă generalizată și stadiul IV, peritonită fecală. A se vedea Fig. 3.

Algoritm pentru managementul diverticulitei acute colonice.
Tratamentul DCA necomplicate (stadiul Hinchey 0 sau Ia)
Majoritatea DCA necomplicate pot fi tratate conservator în condiții de siguranță, cu o rată de succes între 70% și 100%.14 Tratamentul ambulatoriu poate permite economii importante de costuri pentru sistemele de sănătate. În cazurile de ACD necomplicate, criteriile pentru tratamentul în regim de spitalizare sunt inflamația semnificativă (includ prezența febrei sau a peritonitei), intoleranța la fluidele orale, vârsta peste 80-85 de ani, imunosupresia sau comorbiditățile severe. În majoritatea cazurilor, o scurtă ședere în spital va fi suficientă. Nu există dovezi că restricțiile alimentare au influențat rezultatele tratamentului, deși majoritatea medicilor recomandă, de obicei, o dietă lichidă clară.
Una dintre cele mai mari schimbări recente în managementul DCA necomplicate este utilizarea din ce în ce mai redusă a antibioticelor. O recenzie recentă a revistei Cochrane, bazată doar pe o abordare calitativă (fără meta-analiză), a constatat că cele mai bune date disponibile nu susțin utilizarea sa de rutină.68 Antibioticele nu accelerează recuperarea și nici nu previn complicațiile sau recidivele. Prin urmare, utilizarea antibioticelor în acest caz este discutabilă. Probabil, acestea ar fi adecvate la pacienții cu semne de infecție generalizată, semne de septicemie sau bacteriemie și la pacienții imunocompromiși. Regimurile recomandate se bazează pe consensul clinic. Pot fi utilizate diverse antibiotice, de la ampicilină la cefalosporine din a treia generație, atâta timp cât sunt eficiente împotriva bacteriilor gram pozitive, gram negative și anaerobe. Combinația de ciprofloxacină și metronidazol este probabil cel mai prescris tratament oral. În cazul în care această combinație este prost tolerată, ampicilina-sulfabactam poate fi o alegere bună. Pe de altă parte, date recente au arătat că nu există avantaje ale antibioticelor intravenoase față de cele orale și ale tratamentului intravenos de 4 zile față de cel de 7 zile.69-71 De obicei, ameliorarea clinică se observă în decurs de 3-4 zile de la tratament. În cele din urmă, internarea în spital cu antibiotic intravenos este recomandată atunci când pacientul este incapabil să consume alimente pe cale orală, este afectat de comorbiditate severă sau nu se ameliorează cu tratamentul ambulatoriu.
Tratamentul ACD complicate (stadiul Hinchey Ib până la IV)ACD Hinchey Ib sau II: abces
Aproximativ 15% dintre pacienții cu ACD vor dezvolta un abces.67 Nu există dovezi de înaltă calitate cu privire la cel mai optim management al ACD cu formare de abces. Este indicată spitalizarea. Dimensiunea este un factor determinant important pentru succesul tratamentului. În abcesele mai mici (
cm) se recomandă tratamentul conservator cu antibiotice cu spectru larg. Acesta va avea succes în proporție de până la 70%.72 Când tratamentul conservator eșuează sau în abcese mai mari, trebuie efectuat un drenaj percutanat. Acesta are succes în proporție de până la 80%.73 Chirurgia va fi un tratament de salvare atunci când tratamentele menționate anterior eșuează.ACD Hinchey III sau IV: peritonită purulentă sau fecală
Peritonita este cea mai gravă complicație, cu o mortalitate de 14%. Deși nu există dovezi, chirurgia precoce este considerată terapia standard pentru acești pacienți. Alegerea operației este influențată de condițiile pacientului, de constatările operatorii și de experiența chirurgului. La pacienții în stare critică cu instabilitate hemodinamică, se recomandă procedura Hartmann. Cu toate acestea, la pacienții stabili din punct de vedere hemodinamic, anastomoza primară cu sau fără deviere fecală proximală trebuie să fie considerată o alegere preferabilă.14,74
În mod tradițional, ghidurile internaționale recomandă utilizarea endoscopiei după un episod de DCA pentru a exclude cancerul colorectal. Această recomandare se bazează doar pe opiniile experților. Studii retrospective recente și o analiză sistematică75-80 arată că rata de cancer la acești pacienți este destul de scăzută. Pe baza acestor dovezi recente, cea mai eficientă strategie poate fi aceea de a trimite la colonoscopie doar acei pacienți cu simptome persistente sau cei cu rezultate suspecte la CT. Dar sunt necesare mai multe studii pentru o recomandare fermă.Management după un episod de ACDPrevenirea recurenței ACD
După un episod de ACD, aproximativ o treime va avea un al doilea ACD, iar după un al doilea episod, o altă treime va avea un alt atac.73,74 Dar dovezile pentru a defini tratamentul optim după un episod de ACD pentru a preveni un nou episod sunt puține.
A) Dieta bogată în fibre
După ce episodul acut s-a rezolvat, o dietă bogată în fibre este recomandată în mod obișnuit pentru a reduce recurențele. Dar, RCT-urile privind dietele bogate în fibre la pacienții cu ACD au avut rezultate inconsistente. O analiză sistematică publicată recent cu privire la dietele bogate în fibre nu a putut include niciun studiu care să investigheze rolul fibrelor în prevenirea recurențelor de ACD.26,81 Unele alimente (semințe, popcorn și nuci) sunt evitate în mod clasic deoarece, teoretic, intră, blochează sau irită diverticulul. Dar Strate et al. în studiul lor amplu și prospectiv nu au găsit nicio asociere cu un risc crescut de ACD. Prin urmare, excluderea din dietă a acestor alimente nu ar trebui să fie recomandată.82 De asemenea, reducerea greutății și renunțarea la fumat pot avea o influență favorabilă asupra prevenirii DCA.9,83
B) Antibiotice
Există trei recenzii sistematice recente care au evaluat rolul rifaximinei ciclice în prevenirea recurenței DCA, dar nu au arătat un beneficiu clar.46,84,85 Din punct de vedere fiziopatologic, o explicație plauzibilă a ineficienței rifaximinei în prevenirea recidivelor ar putea fi aceea că un tratament ciclic poate să nu controleze populația bacteriană colonică pe parcursul unei luni întregi, deoarece populația bacteriană colonică se recuperează în termen de 7-14 zile de la terminarea rifaximinei. Cu toate acestea, un recent RCT deschis spaniol a arătat că rifaximina ciclică poate ameliora simptomele și menține perioadele de remisiune în urma ACD.86 Recidivele au apărut la 10,4 % dintre pacienții cărora li s-a administrat rifaximină plus fibre, față de 19,3 % la cei cărora li s-au administrat numai fibre. Mai mult, pacienții diagnosticați pentru prima dată de ≥1 an au avut un risc mai mare de exacerbare (OR 3,34, IC 95%: 0,01-12,18). Dar, sunt necesare studii suplimentare, deoarece, în prezent, nu se pot face recomandări. Nu există dovezi care să susțină utilizarea altor antibiotice în acest context.
C) Probioticele
Câteva studii deschise au examinat rolul probioticelor în prevenirea recurenței ACD. Giaccari et al. în urmă cu mai bine de 20 de ani, au evaluat rolul Lactobacillus sp. după rifaximină la 79 de pacienți cu stenoză de colon după diverticulită. 88% dintre pacienți au rămas asimptomatici pentru o perioadă de 12 luni.87 Acest studiu observațional a fost primul care a sugerat un posibil rol al probioticelor în acest context. Un studiu mai recent a evaluat tratamentul combinat; balsalazidă și VSL#3 (un amestec de opt specii de probiotice). După 12 luni, 73% dintre subiecții care au urmat un tratament combinat au fost asimptomatici, comparativ cu 53% dintre cei care au urmat o monoterapie cu probiotice (p>0,05).52 În concluzie, probioticele par a fi eficiente în prevenirea recurenței ACD, dar lipsesc studiile bine concepute.
D) 5-ASA
Câteva RCT-uri dublu-orb și deschise au evaluat rolul mezalazinei în prevenirea recurenței ACD. Din nefericire, cele mai multe dintre acestea nu au constatat un beneficiu al mesalazinei față de placebo în prevenirea recurenței.88-90 Raskin et al. au publicat recent două interesante și identice RCT de fază 3 dublu-orb, placebo (PREVENT1 și PREVENT2) care arată, de asemenea, că mesalazina nu este superioară placebo în prevenirea recurenței ACD.91 De asemenea, tratamentul combinat, 5-ASA plus rifaximină, a fost evaluat în mai multe studii. Trivedi și Das au analizat datele din cinci RCT și un studiu deschis, care au implicat colectiv peste 600 de pacienți, și au concluzionat că combinația pare a fi superioară rifaximinei singure pentru prevenirea DCA recurente.92
E) Intervenția chirurgicală
Până acum câțiva ani, intervenția chirurgicală electivă era recomandată după două atacuri de DCA necomplicate sau un atac de DCA complicate pentru a reduce morbiditatea și mortalitatea prin recurență. Dar intervenția chirurgicală electivă implică, de asemenea, un risc crescut de morbi-mortalitate.93 Din acest motiv, este important să se pună în balanță morbiditatea și mortalitatea datorate intervenției chirurgicale cu riscul de recurențe complicate și severitatea simptomelor.
Datele recente arată că istoria naturală a ACD este mult mai benignă decât se credea în trecut.73,94 Riscul de recidivă pe termen lung este mai mic decât se credea anterior, iar riscurile pe termen lung de intervenție chirurgicală de urgență ulterioară (3-7%), de deces (95 au arătat că 16% din cazurile cu primul ACD au fost operate de urgență, comparativ cu doar 6% în cazurile de recidivă, și că mortalitatea la 30 de zile pentru primul episod a fost, de asemenea, mai mare comparativ cu evenimentele recurente (3% vs. 0%). De fapt, majoritatea pacienților care se prezintă cu ACD complicate nu au un istoric al bolii.96 S-a propus, de asemenea, că ACD recurentă poate proteja împotriva perforației, posibil datorită formării de aderențe cauzate de inflamație.95 Prin urmare, o politică de intervenție chirurgicală electivă după ACD nu scade probabilitatea unei intervenții chirurgicale ulterioare (până la 3%) și nu protejează pe deplin împotriva recidivei. Pe de altă parte, îmbunătățirea diagnosticului și a modalităților de tratament au redus morbi-mortalitatea în cazul ACD complicate. Din cauza acestor noi date, The American Society of Colon and Rectum Surgeons (Societatea Americană a Chirurgilor de Colon și Rectum), în cel mai recent ghid al său, recomandă ca rezecția sigmoidiană electivă după recuperarea după ACD să se facă de la caz la caz14 și consideră că numărul de episoade anterioare nu este un indicator bun pentru selecția candidaților la o intervenție chirurgicală electivă. Medicii trebuie să ia în considerare starea medicală și vârsta pacientului, frecvența și severitatea atacului (atacurilor) și prezența simptomelor persistente după episodul acut.14
Este foarte dificil de anticipat care cazuri de ACD vor recidiva. Gravitatea gradată prin CT a primului episod de ACD pare a fi un predictor al unei istorii naturale nefavorabile. ACD pe partea stângă, >5cm de colon implicat și un abces retroperitoneal au fost factori predictivi de recidivă și trebuie luați în considerare.97 Nu există un consens cu privire la faptul dacă vârsta tânără (82 Conform dovezilor actuale, vârsta nu ar trebui să fie considerată ca o indicație pentru o intervenție chirurgicală electivă, deoarece nu pare să fie legată de o evoluție severă a bolii după o ACD tratată medicamentos. Dar, ținând cont de faptul că există o incidență crescută a ACD la pacienții tineri, sunt necesare studii suplimentare pentru a clarifica acest aspect specific.
Cazuri speciale sunt persoanele imunocompromise. Studiile de cohortă indică faptul că acești pacienți au un risc ridicat de DCA recurentă complicată (un risc de 5 ori mai mare de perforație) și un risc ridicat de intervenție chirurgicală de urgență.98 Prin urmare, un prag mai scăzut pentru intervenția chirurgicală electivă ar putea fi benefic pentru aceștia.14 Dar, Biondo et al. în studiul lor recent arată că pacienții imunocompromiși au avut o rată de mortalitate semnificativ mai mare, dar numai în primul episod. Prin urmare, controversa este prezentă.99
Tratamentul sechelelorA) Fistula
O fistulă apare atunci când un flegmon diverticular sau un abces se rupe într-un organ adiacent. O fistulă apare la mai puțin de 5% dintre pacienții cu ACD. Cele mai frecvente sunt fistulele colovesicală și colovaginală. Se presupune că în cazul majorității pacienților ar putea fi efectuată o rezecție operatorie într-un singur stadiu, cu închiderea fistulei și anastomoză primară. Alte fistule ca cele coloenterice sau coluterine sunt rare.100,101
B) Obstrucția
Episoadele recurente de ACD, care pot fi subclinice, pot produce o strictură cronică a colonului fără inflamație continuă. Poate apărea o obstrucție de grad înalt sau completă. Înainte de a trata obstrucția, este necesar să se excludă o etiologie malignă. Atunci când neoplasmul este suficient de exclus și nu există ACD, dilatarea endoscopică sau decompresia temporară cu stent metalic pot fi opțiuni terapeutice.102 Ulterior, se poate realiza o rezecție ulterioară într-un singur stadiu fără deviere.
Managementul colitei segmentare asociate cu diverticuloza
Se definește ca o inflamație cronică a mucoasei interdiverticulare a unui segment colonic implicat. Sunt cruțate rectul și colonul drept. A devenit într-o tulburare clinică și patologică distinctă și se prezintă frecvent cu scaune sângeroase. Patogenia este necunoscută. Spectrul de modificări histologice variază de la inflamație nespecifică ușoară la modificări asemănătoare bolii inflamatorii intestinale. Din acest motiv, diagnosticul diferențial este adesea dificil. Majoritatea pacienților se recuperează complet în câteva săptămâni sau luni. Unii dintre ei sunt tratați inițial cu 5-ASA oral, dar probabil că aceste medicamente nu sunt necesare, deoarece majoritatea cazurilor se rezolvă spontan.103
Concluzii
În UDD simptomatic, obiectivele tratamentului sunt prevenirea complicațiilor și reducerea simptomelor. Conform dovezilor actuale, fibrele plus rifaximina ciclică sau mesalazina plus probioticele par a fi cele mai eficiente terapii. În DCA, antibioticele par să rămână pilonul de bază al tratamentului, iar un management ambulatoriu este considerat abordarea optimă în marea majoritate a pacienților cu DCA necomplicate. Cu toate acestea, managementul în regim de spitalizare și antibioticele intravenoase sunt necesare în cazul ACD complicate. În prezent, rolul chirurgiei de urgență este în schimbare. Majoritatea abceselor asociate diverticulitei pot fi tratate cu antibiotice intravenoase și/sau drenaj percutanat, iar chirurgia de urgență va fi considerată tratament standard doar în cazul pacienților cu peritonită. În cele din urmă, intervenția chirurgicală electivă după recuperarea după ACD ar trebui să se facă de la caz la caz.
Contribuțiile autorilor
Gargallo CJ, Sopeña F și Lanas A au contribuit în mod egal la proiectarea, redactarea și procesul de revizuire a acestui articol.
Conflict de interese
Dr. Carla J. Gargallo și Dr. Federico Sopeña nu raportează conflicte de interese. Dr. Angel Lanas a fost consilier al AlfaWasserman.
.
