Obiective de învățare
- Descrieți energia legăturilor covalente și ionice. formarea și ruperea legăturilor
- Utilizați energiile medii ale legăturilor covalente pentru a estima entalpiile de reacție
Tăria unei legături descrie cât de puternic este unit fiecare atom cu un alt atom, și, prin urmare, câtă energie este necesară pentru a rupe legătura dintre cei doi atomi.
Este esențial să ne amintim că trebuie adăugată energie pentru a rupe legăturile chimice (un proces endotermic), în timp ce formarea legăturilor chimice eliberează energie (un proces exotermic). În cazul ![]() , legătura covalentă este foarte puternică; trebuie adăugată o cantitate mare de energie, 436 kJ, pentru a rupe legăturile dintr-un mol de molecule de hidrogen și a face ca atomii să se separe:
, legătura covalentă este foarte puternică; trebuie adăugată o cantitate mare de energie, 436 kJ, pentru a rupe legăturile dintr-un mol de molecule de hidrogen și a face ca atomii să se separe:
![]()
În mod invers, aceeași cantitate de energie este eliberată atunci când un mol de ![]() molecule se formează din doi moli de atomi de H:
molecule se formează din doi moli de atomi de H:
![]()
Rezistența legăturii: Legături covalente
Moleculele stabile există pentru că legăturile covalente țin atomii împreună. Măsurăm puterea unei legături covalente prin energia necesară pentru a o rupe, adică energia necesară pentru a separa atomii legați. Separarea oricărei perechi de atomi legați necesită energie. Cu cât o legătură este mai puternică, cu atât mai mare este energia necesară pentru a o rupe.
Energia necesară pentru a rupe o anumită legătură covalentă într-un mol de molecule gazoase se numește energia de legătură sau energia de disociere a legăturii. Energia de legătură pentru o moleculă diatomică, ![]() , este definită ca fiind variația standard de entalpie pentru reacția endotermică:
, este definită ca fiind variația standard de entalpie pentru reacția endotermică:
![]()
De exemplu, energia de legătură a legăturii covalente pure H-H, ![]() , este de 436 kJ pe mol de legături H-H rupte:
, este de 436 kJ pe mol de legături H-H rupte:
![]()
Moleculele cu trei sau mai mulți atomi au două sau mai multe legături. Suma tuturor energiilor de legătură dintr-o astfel de moleculă este egală cu variația standard de entalpie pentru reacția endotermică care rupe toate legăturile din moleculă. De exemplu, suma celor patru energii ale legăturilor C-H din ![]() , 1660 kJ, este egală cu variația standard de entalpie a reacției:
, 1660 kJ, este egală cu variația standard de entalpie a reacției:

Energia medie a legăturii C-H, ![]() , este de 1660/4 = 415 kJ/mol, deoarece există patru moli de legături C-H rupte per mol de reacție. Deși cele patru legături C-H sunt echivalente în molecula originală, fiecare dintre ele nu necesită aceeași energie pentru a se rupe; odată ce prima legătură este ruptă (care necesită 439 kJ/mol), celelalte legături sunt mai ușor de rupt. Valoarea de 415 kJ/mol reprezintă valoarea medie, nu valoarea exactă necesară pentru ruperea oricărei legături.
, este de 1660/4 = 415 kJ/mol, deoarece există patru moli de legături C-H rupte per mol de reacție. Deși cele patru legături C-H sunt echivalente în molecula originală, fiecare dintre ele nu necesită aceeași energie pentru a se rupe; odată ce prima legătură este ruptă (care necesită 439 kJ/mol), celelalte legături sunt mai ușor de rupt. Valoarea de 415 kJ/mol reprezintă valoarea medie, nu valoarea exactă necesară pentru ruperea oricărei legături.
Tăria unei legături între doi atomi crește pe măsură ce crește numărul de perechi de electroni din legătură. În general, pe măsură ce rezistența legăturii crește, lungimea legăturii scade. Astfel, constatăm că legăturile triple sunt mai puternice și mai scurte decât legăturile duble între aceiași doi atomi; la fel, legăturile duble sunt mai puternice și mai scurte decât legăturile simple între aceiași doi atomi. Energiile medii de legătură pentru unele legături obișnuite apar în tabelul de mai jos, iar o comparație a lungimilor și rezistențelor legăturilor pentru unele legături obișnuite apare în tabelul următor. Atunci când un atom se leagă de diverși atomi dintr-un grup, puterea legăturii scade de obicei pe măsură ce ne deplasăm în josul grupului. De exemplu, ![]() este de 439 kJ/mol,
este de 439 kJ/mol, ![]() este de 330 kJ/mol, iar
este de 330 kJ/mol, iar ![]() este de 275 kJ/mol.
este de 275 kJ/mol.
| Energii de legătură (kJ/mol) | |||||||
|---|---|---|---|---|---|---|---|
| Legătură | Energie de legătură | Legătură | Energie de legătură | Legătură | Energie de legătură | ||
| 436 | 260 | 255 | |||||
| 415 | 330 | 235 | |||||
| 390 | 275 | 230 | |||||
| 464 | \text{C-I} | 240 | \text{Si-P} | 215 | |||
| 569 | 160 | 225 | |||||
| 395 | 418 | 359 | |||||
| 320 | 946 | 290 | |||||
| 340 | 200 | 215 | |||||
| 432 | 270 | 215 | |||||
| 370 | 210 | 230 | |||||
| 295 | 200 | 330 | |||||
| 345 | 245 | 270 | |||||
| 611 | 140 | 215 | |||||
| 837 | 498 | 215 | |||||
| 290 | 160 | 250 | |||||
| 615 | 370 | 215 | |||||
| 891 | 350 | 243 | |||||
| 350 | 205 | 220 | |||||
| 741 | 200 | 210 | |||||
| 1080 | 160 | 190 | |||||
| 439 | 540 | 180 | |||||
| 360 | 489 | 150 | |||||
| 265 | 285 | ||||||
| Lungimile medii ale legăturilor și energiile de legătură pentru câteva legături comune | ||
|---|---|---|
| Legătură | Lungimea legăturii (Å) | Energia legăturii (kJ/mol) |
| 1.54 | 345 | |
| 1.34 | 611 | |
| 1.20 | 837 | |
| 1.43 | 290 | |
| 1.38 | 615 | |
| 1.16 | 891 | |
| 1.43 | 350 | |
| 1.23 | 741 | |
| 1.13 | 1080 | |
Energia legăturii este diferența dintre minimul energetic (care apare la distanța de legătură) și energia celor doi atomi separați. Aceasta este cantitatea de energie eliberată atunci când se formează legătura. Invers, aceeași cantitate de energie este necesară pentru a rupe legătura. Pentru molecula ![]() prezentată în tabelul de mai sus, la distanța de legătură de 74 pm, sistemul are o energie cu 7,24 × 10-19 J mai mică decât cea a celor doi atomi de hidrogen separați. Acesta poate părea un număr mic. Cu toate acestea, după cum vom afla mai în detaliu mai târziu, energiile de legătură sunt adesea discutate pe bază de fiecare mol. De exemplu, este nevoie de 7,24 × 10-19 J pentru a rupe o legătură H-H, dar este nevoie de 4,36 × 105 J pentru a rupe un mol de legături H-H. În tabelele de mai sus este prezentată o comparație a unor lungimi și energii de legătură. Putem găsi multe dintre aceste legături într-o varietate de molecule, iar acest tabel oferă valori medii. De exemplu, ruperea primei legături C-H în
prezentată în tabelul de mai sus, la distanța de legătură de 74 pm, sistemul are o energie cu 7,24 × 10-19 J mai mică decât cea a celor doi atomi de hidrogen separați. Acesta poate părea un număr mic. Cu toate acestea, după cum vom afla mai în detaliu mai târziu, energiile de legătură sunt adesea discutate pe bază de fiecare mol. De exemplu, este nevoie de 7,24 × 10-19 J pentru a rupe o legătură H-H, dar este nevoie de 4,36 × 105 J pentru a rupe un mol de legături H-H. În tabelele de mai sus este prezentată o comparație a unor lungimi și energii de legătură. Putem găsi multe dintre aceste legături într-o varietate de molecule, iar acest tabel oferă valori medii. De exemplu, ruperea primei legături C-H în ![]() necesită 439,3 kJ/mol, în timp ce ruperea primei legături C-H în
necesită 439,3 kJ/mol, în timp ce ruperea primei legături C-H în ![]() (un diluant comun pentru vopsele) necesită 375 kJ/mol.5 kJ/mol.
(un diluant comun pentru vopsele) necesită 375 kJ/mol.5 kJ/mol.
După cum se vede în tabelele de mai sus, o legătură simplă carbon-carbon are în medie 347 kJ/mol, în timp ce într-o legătură dublă carbon-carbon, legătura ![]() crește rezistența legăturii cu 267 kJ/mol. Adăugarea unei legături suplimentare
crește rezistența legăturii cu 267 kJ/mol. Adăugarea unei legături suplimentare ![]() determină o creștere suplimentară de 225 kJ/mol. Putem observa un model similar atunci când comparăm alte legături
determină o creștere suplimentară de 225 kJ/mol. Putem observa un model similar atunci când comparăm alte legături ![]() și
și ![]() . Astfel, fiecare legătură
. Astfel, fiecare legătură ![]() individuală este, în general, mai slabă decât o legătură
individuală este, în general, mai slabă decât o legătură ![]() corespunzătoare între aceiași doi atomi. Într-o legătură
corespunzătoare între aceiași doi atomi. Într-o legătură ![]() , există un grad mai mare de suprapunere orbitală decât într-o legătură
, există un grad mai mare de suprapunere orbitală decât într-o legătură ![]() .
.
Potem folosi energiile de legătură pentru a calcula modificări aproximative de entalpie pentru reacțiile în care nu sunt disponibile entalpiile de formare. Calculele de acest tip ne vor spune, de asemenea, dacă o reacție este exotermă sau endotermă. O reacție exotermă (ΔH negativ, căldură produsă) rezultă atunci când legăturile din produși sunt mai puternice decât legăturile din reactanți. O reacție endotermică (ΔH pozitiv, căldură absorbită) rezultă atunci când legăturile din produși sunt mai slabe decât cele din reactanți.
Variația de entalpie, ΔH, pentru o reacție chimică este aproximativ egală cu suma energiei necesare pentru a rupe toate legăturile din reactanți (energie „în”, semn pozitiv) plus energia eliberată atunci când toate legăturile sunt formate în produși (energie „afară”, semn negativ). Acest lucru poate fi exprimat matematic în felul următor:
![]()
În această expresie, simbolul ![]() înseamnă „suma de”, iar D reprezintă energia legăturii în kilojouli pe mol, care este întotdeauna un număr pozitiv. Energia de legătură se obține dintr-un tabel și va depinde de faptul dacă legătura respectivă este o legătură simplă, dublă sau triplă. Astfel, atunci când calculăm entalpiile în acest mod, este important să luăm în considerare legăturile din toți reactanții și produsele. Deoarece valorile D sunt de obicei medii pentru un tip de legătură în multe molecule diferite, acest calcul oferă o estimare aproximativă, nu o valoare exactă, pentru entalpia de reacție.
înseamnă „suma de”, iar D reprezintă energia legăturii în kilojouli pe mol, care este întotdeauna un număr pozitiv. Energia de legătură se obține dintr-un tabel și va depinde de faptul dacă legătura respectivă este o legătură simplă, dublă sau triplă. Astfel, atunci când calculăm entalpiile în acest mod, este important să luăm în considerare legăturile din toți reactanții și produsele. Deoarece valorile D sunt de obicei medii pentru un tip de legătură în multe molecule diferite, acest calcul oferă o estimare aproximativă, nu o valoare exactă, pentru entalpia de reacție.
Considerați următoarea reacție:
![]()
sau
![]()
Pentru a forma doi moli de ![]() , trebuie să se rupă un mol de legături H-H și un mol de legături Cl-Cl. Energia necesară pentru ruperea acestor legături este suma energiei de legătură a legăturii H-H (436 kJ/mol) și a legăturii Cl-Cl (243 kJ/mol). În timpul reacției, se formează doi moli de legături H-Cl (energia legăturii = 432 kJ/mol), eliberând 2 × 432 kJ; sau 864 kJ. Deoarece legăturile din produși sunt mai puternice decât cele din reactanți, reacția eliberează mai multă energie decât consumă:
, trebuie să se rupă un mol de legături H-H și un mol de legături Cl-Cl. Energia necesară pentru ruperea acestor legături este suma energiei de legătură a legăturii H-H (436 kJ/mol) și a legăturii Cl-Cl (243 kJ/mol). În timpul reacției, se formează doi moli de legături H-Cl (energia legăturii = 432 kJ/mol), eliberând 2 × 432 kJ; sau 864 kJ. Deoarece legăturile din produși sunt mai puternice decât cele din reactanți, reacția eliberează mai multă energie decât consumă:
Acest exces de energie este eliberat sub formă de căldură, deci reacția este exotermă. Anexa G oferă o valoare pentru entalpia molară standard de formare a ![]() ,
, ![]() , de -92,307 kJ/mol. De două ori această valoare este de -184,6 kJ, ceea ce concordă bine cu răspunsul obținut anterior pentru formarea a doi moli de HCl.
, de -92,307 kJ/mol. De două ori această valoare este de -184,6 kJ, ceea ce concordă bine cu răspunsul obținut anterior pentru formarea a doi moli de HCl.
EXEMPLU
Utilizarea energiilor de legătură pentru a calcula modificările aproximative de entalpie
Metanol, ![]() , poate fi un combustibil alternativ excelent. Reacția la temperaturi înalte a aburului și a carbonului produce un amestec de gaze monoxid de carbon,
, poate fi un combustibil alternativ excelent. Reacția la temperaturi înalte a aburului și a carbonului produce un amestec de gaze monoxid de carbon, ![]() , și hidrogen,
, și hidrogen, ![]() , din care se poate produce metanol. Folosind energiile de legătură din tabelele de mai sus, calculați variația aproximativă de entalpie, ΔH, pentru reacția de aici:
, din care se poate produce metanol. Folosind energiile de legătură din tabelele de mai sus, calculați variația aproximativă de entalpie, ΔH, pentru reacția de aici:
![]()
Soluție
În primul rând, trebuie să scriem structurile Lewis ale reactanților și produselor:

Din aceasta, vedem că ΔH pentru această reacție implică energia necesară pentru a rupe o legătură triplă C-O și două legături simple H-H, precum și energia produsă de formarea a trei legături simple C-H, a unei legături simple C-O și a unei legături simple O-H. Putem exprima acest lucru după cum urmează:
Utilizând valorile energiei de legătură din tabel, se obține:
Potem compara această valoare cu valoarea calculată pe baza datelor ![]() din Anexa G:
din Anexa G:
Rețineți că există o diferență destul de semnificativă între valorile calculate prin cele două metode diferite. Acest lucru se întâmplă deoarece valorile D sunt media diferitelor rezistențe ale legăturilor; prin urmare, ele oferă adesea doar o concordanță aproximativă cu alte date.
Verifică-ți cunoștințele
Alcoolul etilic, ![]() , a fost una dintre primele substanțe chimice organice sintetizate în mod deliberat de către om. Are multe utilizări în industrie și este alcoolul conținut în băuturile alcoolice. Poate fi obținut prin fermentarea zahărului sau sintetizat prin hidratarea etilenei în următoarea reacție:
, a fost una dintre primele substanțe chimice organice sintetizate în mod deliberat de către om. Are multe utilizări în industrie și este alcoolul conținut în băuturile alcoolice. Poate fi obținut prin fermentarea zahărului sau sintetizat prin hidratarea etilenei în următoarea reacție:

Utilizând energiile de legătură din tabel, calculați o schimbare aproximativă de entalpie, ΔH, pentru această reacție.
-35 kJ
Rezistența legăturii ionice și energia rețelei
Un compus ionic este stabil datorită atracției electrostatice dintre ionii săi pozitivi și negativi. Energia de rețea a unui compus este o măsură a puterii acestei atracții. Energia rețelei (ΔHlattice) a unui compus ionic este definită ca fiind energia necesară pentru a separa un mol de solid în ionii gazoși care îl compun. Pentru solidul ionic MX, energia de rețea este variația de entalpie a procesului:
![]()
Rețineți că folosim convenția în care solidul ionic este separat în ioni, astfel încât energiile noastre de rețea vor fi endotermice (valori pozitive). Unele texte utilizează convenția echivalentă, dar opusă, definind energia de rețea ca fiind energia eliberată atunci când ionii separați se combină pentru a forma o rețea și oferind valori negative (exotermice). Prin urmare, dacă căutați energii de rețea într-o altă referință, asigurați-vă că verificați ce definiție este utilizată. În ambele cazuri, o mărime mai mare pentru energia rețelei indică un compus ionic mai stabil. Pentru clorura de sodiu, ![]() . Astfel, este nevoie de 769 kJ pentru a separa un mol de
. Astfel, este nevoie de 769 kJ pentru a separa un mol de ![]() în ioni gazoși
în ioni gazoși ![]() și
și ![]() . Când câte un mol din fiecare dintre ionii gazoși
. Când câte un mol din fiecare dintre ionii gazoși ![]() și
și ![]() formează ioni solizi
formează ioni solizi ![]() , se degajă 769 kJ de căldură.
, se degajă 769 kJ de căldură.
Energia rețelei ![]() a unui cristal ionic poate fi exprimată prin următoarea ecuație (derivată din legea lui Coulomb, care guvernează forțele dintre sarcinile electrice):
a unui cristal ionic poate fi exprimată prin următoarea ecuație (derivată din legea lui Coulomb, care guvernează forțele dintre sarcinile electrice):
![]()
în care C este o constantă care depinde de tipul de structură a cristalului; Z+ și Z- sunt sarcinile ionilor; iar Ro este distanța interionică (suma razelor ionilor pozitivi și negativi). Astfel, energia de rețea a unui cristal ionic crește rapid pe măsură ce sarcinile ionilor cresc și dimensiunile ionilor scad. Atunci când toți ceilalți parametri sunt menținuți constanți, dublarea încărcăturii atât a cationului, cât și a anionului, cvadruplează energia rețelei. De exemplu, energia rețelei de ![]() (Z+ și Z- = 1) este de 1023 kJ/mol, în timp ce cea a
(Z+ și Z- = 1) este de 1023 kJ/mol, în timp ce cea a ![]() (Z+ și Z- = 2) este de 3900 kJ/mol (Ro este aproape aceeași – aproximativ 200 pm pentru ambii compuși).
(Z+ și Z- = 2) este de 3900 kJ/mol (Ro este aproape aceeași – aproximativ 200 pm pentru ambii compuși).
Diferitele distanțe interatomice produc energii de rețea diferite. De exemplu, putem compara energia reticulară a ![]() (2957 kJ/mol) cu cea a
(2957 kJ/mol) cu cea a ![]() (2327 kJ/mol) pentru a observa efectul asupra energiei reticulare al dimensiunii ionice mai mici a lui F- în comparație cu I-.
(2327 kJ/mol) pentru a observa efectul asupra energiei reticulare al dimensiunii ionice mai mici a lui F- în comparație cu I-.
EXEMPLU
Comparații ale energiei rețelei
Geamia prețioasă rubin este oxid de aluminiu, ![]() , care conține urme de
, care conține urme de ![]() . Compusul
. Compusul ![]() este utilizat la fabricarea unor dispozitive semiconductoare. Care are energia de rețea mai mare,
este utilizat la fabricarea unor dispozitive semiconductoare. Care are energia de rețea mai mare, ![]() sau
sau ![]() ?
?
Soluție
În acești doi compuși ionici, sarcinile Z+ și Z- sunt aceleași, astfel încât diferența de energie de rețea va depinde de Ro. ![]() ionul este mai mic decât
ionul este mai mic decât ![]() ion. Astfel,
ion. Astfel, ![]() ar avea o distanță interionică mai mică decât
ar avea o distanță interionică mai mică decât ![]() , iar
, iar ![]() ar avea energia rețelei mai mare.
ar avea energia rețelei mai mare.
Check Your Learning
Oxidul de zinc, ![]() , este un ecran solar foarte eficient. Cum ar putea fi energia reticulară a
, este un ecran solar foarte eficient. Cum ar putea fi energia reticulară a ![]() se compară cu cea a
se compară cu cea a ![]() ?
?
PRENZII CHEIE
Trezimea unei legături covalente se măsoară prin energia de disociere a legăturii, adică prin cantitatea de energie necesară pentru a rupe acea legătură particulară într-un mol de molecule. Legăturile multiple sunt mai puternice decât legăturile simple între aceiași atomi. Entalpia unei reacții poate fi estimată pe baza aportului de energie necesar pentru ruperea legăturilor și a energiei eliberate atunci când se formează noi legături. Pentru legăturile ionice, energia de rețea este energia necesară pentru a separa un mol de compus în ionii săi din faza gazoasă. Energia de rețea crește pentru ionii cu sarcini mai mari și distanțe mai mici între ioni.
- Energia de legătură pentru o moleculă diatomică:
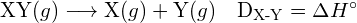
- Schimbare de entalpie:

- Energia rețelei pentru un solid MX:
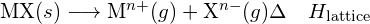
- Energia rețelei pentru un cristal ionic:
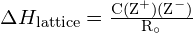
Sfârșitul capitolului EXERCIȚII
- Ce legătură din fiecare dintre următoarele perechi de legături este cea mai puternică? (a)
 sau
sau 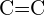 (b)
(b) 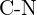 sau
sau 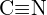 (c)
(c) 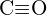 sau
sau 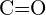 (d)
(d) 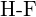 sau
sau 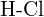 (e)
(e) 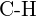 sau
sau 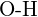 (f)
(f) 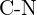 sau
sau 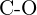
- Utilizând energiile de legătură din tabel, determinați variația aproximativă de entalpie pentru fiecare dintre următoarele reacții: (a)
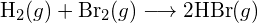 (b)
(b) 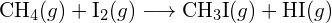 . (c)
. (c) 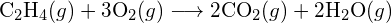 (a) -114 kJ; (b) 30 kJ; (c) -1055 kJ
(a) -114 kJ; (b) 30 kJ; (c) -1055 kJ - Utilizând energiile de legătură din tabel, determinați variația aproximativă de entalpie pentru fiecare dintre următoarele reacții: (a)
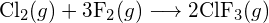 (b)
(b) 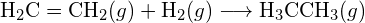 (c)
(c) 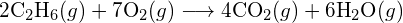
- Desenați o curbă care descrie energia unui sistem cu atomi de H și Cl la diferite distanțe. Apoi, găsiți energia minimă a acestei curbe în două moduri. (a) Folosiți energia de legătură găsită în tabele pentru a calcula energia pentru un singur
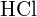 legătură (Indicație: Câte legături există într-un mol?)(b) Folosiți entalpia de reacție și energiile de legătură pentru H2 și Cl2 pentru a rezolva pentru energia unui mol de
legătură (Indicație: Câte legături există într-un mol?)(b) Folosiți entalpia de reacție și energiile de legătură pentru H2 și Cl2 pentru a rezolva pentru energia unui mol de 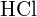 legături.
legături.
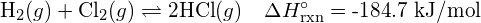
Explicați de ce legăturile apar la distanțe medii specifice de legătură în loc ca atomii să se apropie unul de altul la infinit.
Distanța medie specifică de legătură este distanța cu cea mai mică energie. La distanțe mai mici decât distanța de legătură, sarcinile pozitive de pe cele două nuclee se resping reciproc, iar energia totală crește. - Când o moleculă poate forma două structuri diferite, structura cu legăturile mai puternice este, de obicei, forma mai stabilă. Folosiți energiile de legătură pentru a prezice structura corectă a moleculei de hidroxilamină:
 Energia de legătură mai mare este în figura din stânga. Este forma mai stabilă.
Energia de legătură mai mare este în figura din stânga. Este forma mai stabilă. - Cum arată energia de legătură a
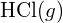 diferă de entalpia standard de formare a
diferă de entalpia standard de formare a 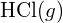 ?
? - Utilizând datele privind entalpia standard de formare din Apendicele G, arătați în ce mod entalpia standard de formare a
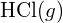 poate fi folosită pentru a determina energia de legătură.
poate fi folosită pentru a determina energia de legătură.
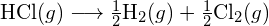
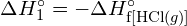
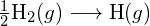
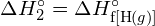
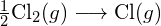
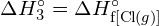
\text{HCl} (g) \longrightarrow \text{H} (g) + \text{Cl} (g) 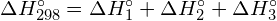
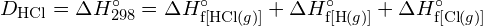
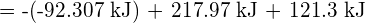
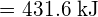
- Utilizând datele standard privind entalpia de formare din Anexa G, calculați energia de legătură a dublei legături carbon-sulfur din
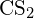 .
. - Utilizând datele standard de entalpie de formare din Anexa G, determinați care legătură este mai puternică: legătura S-F din
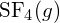 sau din
sau din 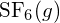 ?
Legătura S-F din
?
Legătura S-F din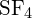 este mai puternică.
este mai puternică. - Utilizând datele standard de entalpie de formare din Anexa G, determinați care legătură este mai puternică: legătura P-Cl din
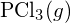 sau din
sau din 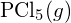 ?
? - Completați următoarea structură Lewis prin adăugarea de legături (nu de atomi) și apoi indicați cea mai lungă legătură:

 Legăturile simple C-C sunt cele mai lungi.
Legăturile simple C-C sunt cele mai lungi. - Utilizați energia de legătură pentru a calcula o valoare aproximativă a ΔH pentru următoarea reacție. Care este forma mai stabilă a
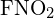 ?
?
- Utilizați principiile structurii atomice pentru a răspunde la fiecare dintre următoarele:1 (a) Raza atomului de Ca este de 197 pm; raza ionului
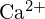 este de 99 pm. Explicați diferența. (b) Energia reticulară a
este de 99 pm. Explicați diferența. (b) Energia reticulară a 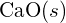 este -3460 kJ/mol; energia reticulară a
este -3460 kJ/mol; energia reticulară a 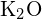 este de -2240 kJ/mol. Explicați diferența. (c) Având în vedere aceste valori de ionizare, explicați diferența dintre Ca și K în ceea ce privește prima și a doua lor energie de ionizare.
este de -2240 kJ/mol. Explicați diferența. (c) Având în vedere aceste valori de ionizare, explicați diferența dintre Ca și K în ceea ce privește prima și a doua lor energie de ionizare.
Element Prima energie de ionizare (kJ/mol) A doua energie de ionizare (kJ/mol) K 419 .
3050 Ca 590 1140 (d) Prima energie de ionizare a Mg este de 738 kJ/mol, iar cea a Al este de 578 kJ/mol. Explicați această diferență.
(a) Când doi electroni sunt eliminați din învelișul de valență, raza Ca pierde nivelul energetic cel mai exterior și revine la nivelul inferior n = 3, care are o rază mult mai mică. (b) Sarcina +2 a calciului trage oxigenul mult mai aproape în comparație cu K, crescând astfel energia rețelei în raport cu un ion mai puțin încărcat.
(c) Îndepărtarea electronului 4s din Ca necesită mai multă energie decât îndepărtarea electronului 4s din K din cauza atracției mai puternice a nucleului și a energiei suplimentare necesare pentru a rupe împerecherea electronilor. A doua energie de ionizare pentru K necesită ca un electron să fie îndepărtat de la un nivel energetic inferior, unde atracția nucleului pentru electron este mult mai puternică. În plus, este nevoie de energie pentru a desperechea doi electroni pe un orbital complet. Pentru Ca, al doilea potențial de ionizare necesită îndepărtarea doar a unui electron singuratic din nivelul energetic exterior expus.
(d) În cazul lui Al, electronul îndepărtat este relativ neprotejat și neperecheat într-un orbital p. Energia mai mare pentru Mg reflectă în principal neîmperecherea electronului 2s.
- Pentru care dintre următoarele substanțe este necesară cea mai mică energie pentru a transforma un mol de solid în ioni separați? (a)
 (b)
(b) 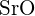 (c)
(c) 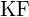 (d)
(d) 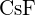 (e)
(e) 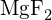 (d)
(d) - Reacția unui metal,
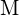 , cu un halogen,
, cu un halogen,  , se desfășoară printr-o reacție exotermă, după cum indică această ecuație:
, se desfășoară printr-o reacție exotermă, după cum indică această ecuație: 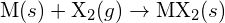 . Pentru fiecare dintre următoarele, indicați ce opțiune va face reacția mai exotermă. Explicați-vă răspunsurile. (a) o rază mare vs. o rază mică pentru
. Pentru fiecare dintre următoarele, indicați ce opțiune va face reacția mai exotermă. Explicați-vă răspunsurile. (a) o rază mare vs. o rază mică pentru  (b) o energie de ionizare mare vs. o energie de ionizare mică pentru
(b) o energie de ionizare mare vs. o energie de ionizare mică pentru  (c) o energie de legătură din ce în ce mai mare pentru halogen (d) o afinitate electronică din ce în ce mai mică pentru halogen (e) o mărime din ce în ce mai mare a anionului format de halogen
(c) o energie de legătură din ce în ce mai mare pentru halogen (d) o afinitate electronică din ce în ce mai mică pentru halogen (e) o mărime din ce în ce mai mare a anionului format de halogen - Energia rețelei pentru
 este de 1023 kJ/mol, iar distanța Li-F este de 201 pm.
este de 1023 kJ/mol, iar distanța Li-F este de 201 pm.  cristalizează în aceeași structură ca și
cristalizează în aceeași structură ca și  , dar cu o distanță Mg-O de 205 pm. Care dintre următoarele valori se apropie cel mai mult de energia rețelei de
, dar cu o distanță Mg-O de 205 pm. Care dintre următoarele valori se apropie cel mai mult de energia rețelei de  : 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol, sau 4008 kJ/mol? Explicați alegerea dumneavoastră.
4008 kJ/mol; ambii ioni din
: 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol, sau 4008 kJ/mol? Explicați alegerea dumneavoastră.
4008 kJ/mol; ambii ioni din au o sarcină dublă față de cea a ionilor din
au o sarcină dublă față de cea a ionilor din  ; lungimea legăturii este foarte asemănătoare și ambii au aceeași structură; se așteaptă o cvadruplare a energiei pe baza ecuației pentru energia rețelei
; lungimea legăturii este foarte asemănătoare și ambii au aceeași structură; se așteaptă o cvadruplare a energiei pe baza ecuației pentru energia rețelei - Ce compus din fiecare dintre următoarele perechi are energia rețelei mai mare? Notă:
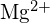 și
și 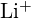 au raze similare;
au raze similare; 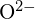 și
și 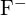 au raze similare. Explicați alegerile dumneavoastră. (a)
au raze similare. Explicați alegerile dumneavoastră. (a)  sau
sau 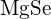 (b)
(b)  sau
sau  (c)
(c) 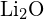 sau
sau 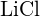 (d)
(d) 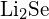 sau
sau 
- Ce compus din fiecare dintre următoarele perechi are energia de rețea mai mare? Notă:
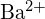 și
și 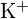 au raze similare;
au raze similare; 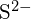 și
și 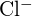 au raze similare. Explicați alegerile dumneavoastră. (a)
au raze similare. Explicați alegerile dumneavoastră. (a) 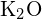 sau
sau 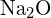 (b)
(b) 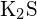 sau
sau  (c)
(c) 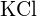 sau
sau  (d)
(d)  sau
sau 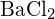 (a)
(a)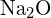 ;
; 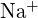 are o rază mai mică decât
are o rază mai mică decât 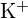 ; (b)
; (b)  ; \text{Ba}; \text{Ba}; \text{Ba} are o sarcină mai mare decât
; \text{Ba}; \text{Ba}; \text{Ba} are o sarcină mai mare decât 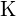 ; (c)
; (c)  ; \text{Ba} și
; \text{Ba} și 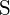 au sarcini mai mari; (d)
au sarcini mai mari; (d)  ;
; 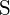 are o sarcină mai mare
are o sarcină mai mare - Care dintre următorii compuși necesită cea mai multă energie pentru a transforma un mol de solid în ioni separați? (a)
 (b)
(b) 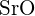 (c)
(c) 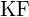 (d)
(d) 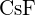 (e)
(e) 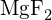
- Care dintre următorii compuși necesită cea mai multă energie pentru a transforma un mol de solid în ioni separați? (a)
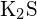 (b)
(b) 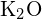 (c)
(c) 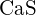 (d)
(d) 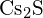 (e)
(e) 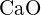 (e)
(e)
Note de subsol
- 1 Această întrebare este preluată de la Chemistry Advanced Placement Examination și este utilizată cu permisiunea Educational Testing Service.
Glosar
energia de legătură (de asemenea, energia de disociere a legăturii) energia necesară pentru a rupe o legătură covalentă într-o substanță gazoasă energia de rețea (ΔHlattice) energia necesară pentru a separa un mol dintr-un solid ionic în componentele sale ioni gazoși
energia necesară pentru a separa un mol dintr-un solid ionic în ionii săi componenți ionii gazoși
I
.
