INTRODUCERE
Cercetarea de bază și clinică efectuată în ultimii ani a stabilit o relație directă, bidirecțională, între boala cronică de rinichi și bolile cardiovasculare.1,2 În practica clinică zilnică, concentrațiile serice de creatinină și rata de filtrare glomerulară estimată cu formula Cockcroft-Gault3 sau cu ecuația Modification of Diet in Renal Disease (MDRD)4 sunt utilizate în mod obișnuit pentru a estima funcția renală. Cu toate acestea, concentrațiile plasmatice de creatinină pot fi influențate de o serie de factori, cum ar fi vârsta pacientului, sexul, masa musculară, activitatea fizică, dieta și medicația.5
Cistatina C este o proteină inhibitoare a cistein proteazei care este sintetizată într-un ritm stabil de către toate celulele nucleate. Datorită greutății sale moleculare scăzute și punctului izoelectric ridicat, poate fi eliminată aproape exclusiv prin filtrare glomerulară. Concentrațiile de cistatină C nu sunt influențate de vârstă, sex sau ingestia de proteine și sunt sensibile la mici modificări ale filtrării glomerulare. Datorită acestor caracteristici, concentrația plasmatică de cistatină C este considerată printre cei mai buni markeri ai statusului de filtrare glomerulară.6-9 Recent, mai multe studii au raportat o asociere între valorile crescute ale cistatinei C și apariția complicațiilor cardiovasculare la pacienții cu boală coronariană. În prezent nu se știe dacă această relație se datorează faptului că cistatina C este un marker mai bun al funcției renale decât creatinina serică sau dacă există alți factori, în afară de filtrarea glomerulară, care afectează concentrația acestei proteine și care sunt în plus legați de riscul cardiovascular10.
Scopul acestui studiu a fost de a evalua valoarea prognostică a concentrației plasmatice de cistatină C la pacienții spitalizați pentru sindrom coronarian acut (SCA) cu risc ridicat și de a investiga relația dintre cistatina C și alți markeri ai funcției renale și inflamației.
METODE
Este un studiu prospectiv, observațional, efectuat între mai 2006 și iulie 2007. Au fost incluși 203 pacienți cu vârsta peste 18 ani și spitalizați consecutiv în unitatea de terapie intensivă cardiacă (ICU) a centrului nostru cu diagnosticul de SCA cu risc ridicat.
Criteriile de diagnostic pentru SCA de risc înalt au inclus cel puțin 2 dintre următorii factori: durere cu caracteristici ischemice, alterări electrocardiografice compatibile cu ischemia și/sau markeri de necroză miocardică crescuți. Tratamentul oferit și testele suplimentare efectuate în timpul spitalizării pacientului s-au bazat pe deciziile clinice ale medicului curant. La majoritatea pacienților, a fost utilizată o strategie invazivă, care a implicat coronarografie urgentă (pentru infarctul miocardic cu supradenivelare a segmentului ST sau bloc de ramură stângă) sau coronarografie programată precoce în primele 24 până la 72 de ore de la internarea în spital.
Caracteristici clinice
Aceste date au fost înregistrate din fișele clinice ale pacienților: informații demografice, prezența factorilor clasici de risc cardiovascular (diabet zaharat, hipertensiune arterială sistemică, dislipidemie și fumat) și antecedente de boală vasculară cunoscută (cardiopatie ischemică, boală cerebrovasculară, boală arterială periferică și tratament anterior de revascularizare miocardică). Celelalte variabile clinice analizate au inclus tipul de SCA, clasa Killip la momentul spitalizării, valorile presiunii sistolice și diastolice, presiunea pulsului (estimată ca diferență între presiunea arterială sistolică și diastolică) și frecvența cardiacă.
Toți pacienții au fost supuși unei ecocardiografii, în care fracția de ejecție a ventriculului stâng a fost estimată prin metoda Simpson folosind o abordare cu 4 camere; s-a calculat media a 3 determinări la pacienții cu ritm sinusal și media a 5 determinări la cei cu fibrilație atrială.
La 95% dintre pacienți, s-a efectuat coronarografie, iar severitatea leziunilor coronariene a fost evaluată cu un scor bazat pe numărul de artere coronare epicardice afectate.
Date analitice
Valorile inițiale ale hemoglobinei, hematocritului, leucocitelor, glucozei și creatininei au fost înregistrate în primele analize de laborator efectuate în centrul nostru în momentul spitalizării. Concentrațiile de colesterol total, colesterol al lipoproteinelor cu densitate mare (HDL-C), colesterol al lipoproteinelor cu densitate mică (LDL-C), glucoză, proteina C reactivă de înaltă sensibilitate și cistatina C au fost înregistrate în primele 24 de ore, împreună cu nivelul maxim al troponinei I (TpI).
Cistatina C a fost măsurată cu un imunodozator omogen automatizat folosind un nefelometru Dade-Behring BN ProSpec. Reactivul pentru analiză a constat din particule de polistiren acoperite cu anticorpi împotriva proteinei care se aglutinează atunci când sunt amestecate cu probe care conțin cistatină C și dispersează lumina la o intensitate proporțională cu concentrația analitului.
Intervalul de referință pentru concentrația serică de cistatină C la adulți cu metoda nefelometrică utilizată este de 0,51 până la 0,95 mg/L. Concentrațiile de proteină C-reactivă de înaltă sensibilitate au fost, de asemenea, determinate prin imunoanaliză. Rata de filtrare glomerulară a fost estimată cu ecuația MDRD.
Episoadele analizate
Complicațiile cardiovasculare analizate au inclus mortalitatea intraspitalicească, mortalitatea din toate cauzele în timpul urmăririi, dezvoltarea unui nou infarct miocardic, definit ca durere toracică sau durere anginală echivalentă cu modificări ECG, sau markerii de necroză tumorală crescuți în primele 24 de ore de la spitalizare (au fost excluși pacienții cu markeri crescuți după proceduri intervenționale coronariene) și dezvoltarea insuficienței cardiace în timpul spitalizării sau urmăririi.
Supravegherea clinică
Supravegherea medie a fost de 186 (SD, 110; mediana, 156) zile, timp în care au fost înregistrate toate evenimentele clinice ale pacienților. Urmărirea a fost realizată prin contact telefonic, în ambulatoriu și prin examinarea fișelor medicale ale pacienților din spital.
Analiză statistică
Toate informațiile au fost înregistrate prospectiv într-o bază de date creată cu Microsoft Office Access 2003 SP2. Analizele statistice au fost efectuate cu SPSS (Statistical Package for the Social Sciences), versiunea 12.0. Variabilele categorice sau dihotomice sunt exprimate ca valori absolute și procente și au fost comparate cu testul Pearson χ2. Variabilele continue cu o distribuție normală sunt descrise ca medie (SD), iar testul t Student a fost utilizat pentru comparațiile între grupuri. Variabilele care nu au prezentat o distribuție gaussiană au fost comparate cu testul U Mann-Whitney.
Corectul de corelație al lui Spearman a fost utilizat pentru a evalua corelațiile concentrației de cistatină C cu proteina C reactivă de înaltă sensibilitate și rata de filtrare glomerulară. O analiză de regresie logistică a fost utilizată pentru a evalua rolul independent al factorilor clinici și de laborator în ceea ce privește cistatina C pentru prezicerea apariției complicațiilor cardiovasculare în timpul spitalizării, incluzând variabilele semnificative în analiza univariată. Sunt prezentate odds ratio-urile ajustate și intervalele de încredere (IC) de 95%. Curbele de supraviețuire Kaplan-Meier în timpul urmăririi au fost construite și comparate cu ajutorul testului long-rank.
Pentru a efectua o analiză descriptivă a populației studiate, unele variabile cantitative au fost clasificate în intervale: rata de filtrare glomerulară (>90, 90-60, 55% și 0,95 și
O valoare P mai mică de 0,05 a fost considerată semnificativă din punct de vedere statistic.
REZULTATE
În perioada mai 2006 – iulie 2007, au fost incluși în studiu 203 pacienți spitalizați cu un diagnostic de SCA cu risc ridicat. Vârsta medie a fost de 66,6 (13,16) ani. Din totalul acestora, 62,1% dintre pacienți (n=126) au prezentat un SCA fără supradenivelare de segment ST și 37,9% (n=77), un SCA cu supradenivelare de segment ST. Caracteristicile de bază ale populației studiate sunt descrise în tabelul 1.
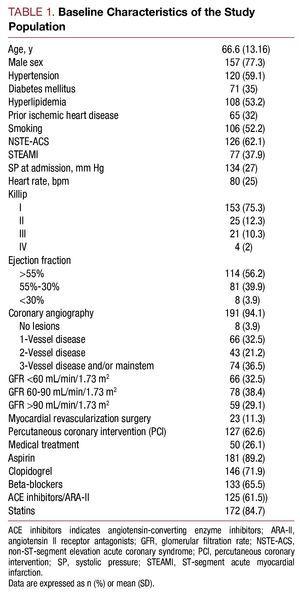
Concentrația mediană de cistatină C a fost de 1,01 (interval, 0,83-1,35) mg/L, creatinina plasmatică la prima analiză efectuată a fost de 1 (0.9-1,3) mg/L, rata de filtrare glomerulară a fost de 72,4 (49,12-93,73) ml/min/1,73 m2, iar proteina C reactivă de înaltă sensibilitate a fost de 1,37 (0,46-5,02) mg/L. Filtrarea glomerulară la momentul spitalizării a fost 2 la 32,5% dintre pacienți, iar cistatina C serică a fost >0,95 mg/L la 113 (55,7%) pacienți.
Pacienții cu valori mai mari ale cistatinei C au prezentat un profil clinic mai slab, au fost mai în vârstă, au avut o prevalență ridicată a hipertensiunii arteriale, o clasă Killip mai proastă la momentul spitalizării, o boală coronariană mai severă la coronarografie și valori mai mari ale creatininei plasmatice și ale proteinei C reactive (tabelul 2).
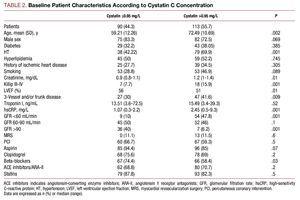
Nu au existat diferențe semnificative între cele 2 grupuri de cistatină C în ceea ce privește intervenția coronariană efectuată; rezultatul angiografic final a dus la o rată de succes similară și fără complicații semnificative (3,27% pentru pacienții cu cistatină C ≤0,95 și 4,09% în celălalt grup). Analiza tratamentului farmacologic a arătat o utilizare substanțial mai mare a beta-blocantelor și a aspirinei în grupul cu cistatină C ≤0,95 (tabelul 2).
Valorile serice ale cistatinei C au prezentat o corelație mai mare cu rata de filtrare glomerulară estimată (r=-0,655; P=,001) (figura 1) decât cu microalbuminuria (r=0,302, P=,01) și o corelație mai mică cu proteina C reactivă (r=0,29; P=,01).
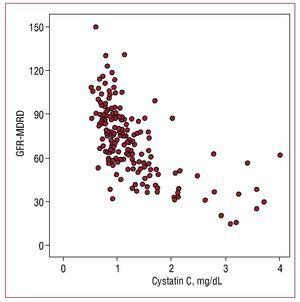
Figura 1. Corelația dintre valorile cistatinei C și rata de filtrare glomerulară estimată cu formula MDRD (GFR-MDRD).
În grupul de pacienți cu valori ale cistatinei C >0,95, 6,5% au prezentat rate de filtrare glomerulară normale și 46%, rate de filtrare glomerulară între 60 și 90 ml/min/1,73 m2. În plus, 10% dintre pacienții care au prezentat disfuncție renală cu o rată de filtrare de 2 au avut valori ale cistatinei C
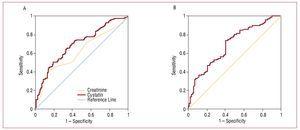
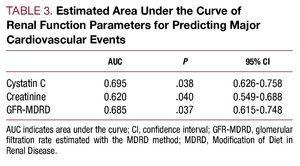
Figura 2. A, ROC-uri ale cistatinei C și creatininei în raport cu apariția complicațiilor cardiovasculare (insuficiență cardiacă, infarct și deces cardiovascular). B, curba ROC a ratei de filtrare glomerulară estimată cu ajutorul MDRD în raport cu apariția complicațiilor cardiovasculare (insuficiență cardiacă, infarct și deces cardiovascular).
Staționarea în spital a durat o medie de 9 (6-19) zile. De la momentul internării și până la finalizarea urmăririi studiului, 56 (27,58%) pacienți din eșantionul global au dezvoltat insuficiență cardiacă, cei mai mulți dintre ei în grupul cu valori crescute ale cistatinei C (45 de pacienți). Mortalitatea intraspitalicească a fost semnificativ mai mare în grupul cu valori crescute ale cistatinei C (17,6% față de 3,3%; P=.001), iar aceste diferențe au persistat în timpul urmăririi (figura 3, tabelul 4).
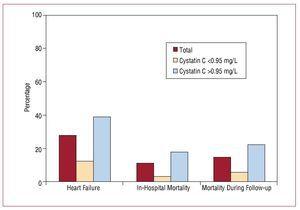
Figura 3. Asocierea dintre cistatina C 0,95 mg/L și apariția evenimentelor cardiovasculare intraspitalicești.

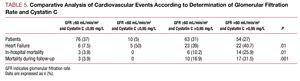
În analiza univariată, nu a fost observată nicio asociere între complicațiile cardiovasculare și tipul de SCA, hiperlipidemia sau concentrația maximă de TpI, dar s-a constatat o asociere cu restul factorilor de risc cardiovascular: numărul de vase afectate, fracția de ejecție, markerii funcției renale, cistatina C și proteina C reactivă de înaltă sensibilitate. Când au fost analizate rezultatele de la pacienții cu o rată de filtrare glomerulară de >60 ml/min/1,73 m2, am constatat că pacienții cu cistatină C >0.95 mg/L au prezentat o rată semnificativ mai mare de complicații cardiovasculare decât pacienții cu filtrare glomerulară >60 și cistatină C 60 și cistatină C
Supraviețuirea estimată fără evenimente (adică fără insuficiență cardiacă, infarct miocardic sau deces) în urma unei urmăriri medii de 186 zile a fost semnificativ mai mare în grupul de pacienți cu valori ale cistatinei ≤0.95 mg/L: 75% față de 44% (P=.02) (Figura 4).

Figura 4. Curbele Kaplan-Meier pentru estimarea probabilității de supraviețuire fără evenimente cardiovasculare majore, în funcție de valoarea cistatinei C.
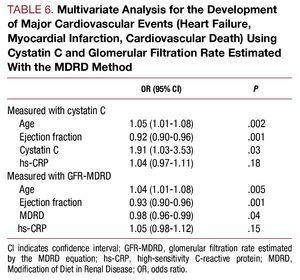
Analiza multivariată a identificat vârsta, fracția de ejecție și concentrația de cistatină C ca factori predictivi independenți ai complicațiilor cardiovasculare în timpul spitalizării (tabelul 6).
DISCUȚII
Rezultatele studiului de față indică faptul că valorile crescute ale cistatinei C prezic apariția insuficienței cardiace în timpul spitalizării, a infarctului miocardic și a decesului cardiovascular la pacienții cu SCA cu risc ridicat, independent de alți factori de risc clasici. În plus, valoarea plasmatică a cistatinei C poate avea o capacitate mai mare de stratificare a pacienților cu risc ridicat de complicații cardiovasculare în timpul spitalizării decât alte metode de evaluare a funcției renale. Am constatat că nivelul ridicat al cistatinei C a fost asociat cu un prognostic cardiovascular mai prost chiar și în grupul de pacienți cu filtrare glomerulară normală. După cunoștințele noastre, acesta este primul raport al acestei asocieri, care credem că ar putea avea implicații pentru stratificarea riscului în această populație de pacienți.
În ultimii ani, mai multe articole au descris o asociere strânsă între disfuncția renală și complicațiile cardiovasculare în timpul urmăririi pacienților cu cardiopatie ischemică acută și cronică, precum și alte prezentări clinice de boală cardiovasculară, în special insuficiența cardiacă.1,10-12 O reducere a filtrării glomerulare sub 60 ml/min este legată de o creștere semnificativă a riscului de deces, infarct miocardic și accident vascular cerebral, atât la pacienții cu sau fără boală cardiovasculară anterioară.13 În mod specific, această relație a fost descrisă la pacienții cu SCA cu supradenivelare a segmentului ST și la cei fără.10,13-15 În studiul VALIANT16 (pacienți cu disfuncție ventriculară și insuficiență cardiacă în urma infarctului miocardic cu supradenivelare a segmentului ST), deteriorarea funcției renale (evaluată cu ajutorul ratei de filtrare glomerulară) a fost asociată cu o creștere a mortalității și a complicațiilor cardiovasculare în timpul urmăririi. Rezultate similare au fost raportate pentru populațiile de pacienți incluse în studiile SAVE (disfuncție ventriculară postinfarct), HOPE (pacienți cu un risc cardiovascular ridicat, majoritatea cu cardiopatie ischemică cronică) și PEACE (pacienți cu cardiopatie ischemică cronică). În aceste studii, relația dintre disfuncția renală și prognosticul a fost observată pentru scăderea ratei de filtrare glomerulară, precum și pentru excreția urinară de albumină.16-19
După cum s-a menționat mai sus, a fost descrisă o relație directă în două direcții între disfuncția renală și bolile cardiovasculare. Insuficiența renală cronică favorizează dezvoltarea hipertensiunii arteriale și a dislipidemiei și promovează activarea sistemului renină-angiotensinaldosteron. Acești factori, împreună cu creșterea mediatorilor inflamatori, par să contribuie la o producție mai mare de radicali liberi, care intervin în procesul aterosclerotic și în leziunile cardiovasculare. În plus, alterările metabolismului mineral (creșterea promotorilor și scăderea inhibitorilor calcifierii) favorizează depunerile de calciu în vasele coronariene.20,21 În fine, la pacienții cu disfuncție renală a fost descrisă o utilizare mai puțin intensă a intervențiilor terapeutice cu beneficii clinice și prognostice recunoscute. În mod specific, la cei cu SCA, tratamentul mai puțin agresiv și întârzierile mai mari în efectuarea procedurilor coronariene intervenționale, precum și utilizarea mai redusă a IIb/IIIa, a blocantelor axei reninangiotensină-aldosteron, a betablocantelor, a statinelor și a agenților antiplachetarieni pot contribui la prognosticul mai slab descris la această populație de pacienți.22
În practica clinică zilnică, evaluarea funcției renale se bazează, de obicei, pe determinări ale creatininei serice și estimări ale ratei de filtrare glomerulară folosind formulele Cockcroft-Gault sau MDRD. Ambele aceste metode prezintă mai multe limitări, multe dintre acestea derivând din factorii care afectează producția de creatinină, cum ar fi vârsta, sexul feminin, caracteristicile legate de rasă, dieta și evoluția bolilor cronice.
Aceste ecuații au fost evaluate recent la pacienții cu insuficiență cardiacă și comparate cu NT-proBNP, un marker prognostic. Informația prognostică oferită de NT-proBNP s-a dovedit a fi superioară celei a funcției renale estimate prin formula MDRD.23
Cistatina C posedă caracteristici moleculare și metabolice care fac din concentrațiile plasmatice ale acestei proteine un bun marker biologic pentru estimarea funcției renale; alterările funcționale mici sunt detectate cu o sensibilitate mai mare decât parametrii convenționali utilizați în acest scop.24 Acest lucru poate justifica faptul că în grupul de pacienți cu concentrații serice de cistatină C peste limita superioară normală, 15% prezentau o rată de filtrare glomerulară normală; determinarea cistatinei C poate fi utilă pentru identificarea pacienților cu o stare preclinică de boală renală.6
Rezultatele obținute în studiul de față sunt, într-o anumită măsură, în concordanță cu rezultatele raportate care indică faptul că cistatina C este un predictor independent al complicațiilor cardiovasculare la pacienții cu boală coronariană.25-27 Mai mult, datele noastre pot extinde acest concept pentru a include pacienții cu o rată de filtrare glomerulară normală. Jernberg et al26 au analizat relația dintre valorile plasmatice ale cistatinei C și prognosticul la un grup de pacienți spitalizați pentru SCA fără supradenivelare de segment ST și au raportat o asociere semnificativă între valorile cistatinei C și mortalitate. De asemenea, a fost descris faptul că concentrațiile ridicate de cistatină C sunt asociate cu un risc crescut de deces, complicații cardiovasculare și incidența insuficienței cardiace la pacienții ambulatoriali cu boală coronariană cronică.24 La persoanele în vârstă fără boală renală manifestă, cistatina C este un marker de risc pentru deces, boală cardiovasculară și boală renală cronică.6 În studiul actual, am constatat că pacienții cu niveluri ridicate de cistatină C aveau un profil de risc mai slab; cu toate acestea, nivelul relativ scăzut al proteinei C reactive a fost surprinzător. Credem că acest lucru poate fi explicat prin cinetica proteinei, care are un spectru specific, caracterizat, în care valoarea sa depinde de momentul în care este prelevată proba (vârful apare la 49 de ore de la debutul simptomelor, iar un vârf mai întârziat este observat în infarctul miocardic acut cu supradenivelare de segment ST); în studiul nostru, probele au fost prelevate în primele 24 de ore de la spitalizare.28 Complicațiile cardiovasculare care au afectat pacienții din studiul nostru diferă de cele publicate în registrele recente29 , iar acest lucru se poate datora faptului că au fost incluși pacienți cu risc foarte ridicat și cu o incidență mai mare a complicațiilor. În registrul MASCARA, publicat recent, doar 50% dintre pacienții incluși fuseseră internați inițial într-o secție de terapie intensivă sau cardiacă, în timp ce toți pacienții noștri proveneau dintr-o secție de terapie intensivă cardiacă, fapt care implică, fără îndoială, o anumită părtinire de selecție. Cu toate acestea, grupul de pacienți cu nivel ridicat de cistatină C a cuprins o populație cu un profil de risc și un număr de complicații cardiovasculare semnificativ mai mare decât restul pacienților. Studiul de față contribuie la stabilirea unei mai mari precizii în aceste asocieri, oferind primul raport conform căruia nivelurile ridicate de cistatină C în primele ore de spitalizare pentru un SCA cu risc ridicat reprezintă un predictor independent al complicațiilor cardiovasculare intraspitalicești. Mai mult, asocierea dintre cistatina C și un risc de complicații cardiovasculare este mai mare decât cea a altor parametri utilizați pe scară largă pentru estimarea funcției renale și se menține chiar și în grupul de pacienți cu filtrare glomerulară normală. În prezent, nu se știe cu exactitate dacă capacitatea de a prezice un risc mai mare de complicații provine din faptul că cistatina C este un marker mai bun al funcției renale decât alți parametri obișnuiți (creatinina serică și rata de filtrare glomerulară) sau dacă există și alți factori, în afară de filtrarea glomerulară, care afectează concentrația de cistatină C și care ar putea fi direct legați de riscul cardiovascular. În această ordine de idei, a fost descrisă o corelație pozitivă a valorilor plasmatice ale proteinei C reactive și ale fibrinogenului cu concentrațiile ridicate de cistatină C și cu prezența bolii cardiovasculare.30 În studiul PRIME (Prospective Epidemiological Study of Myocardial Infarction), a fost investigată asocierea dintre cistatina C și dezvoltarea infarctului miocardic acut moarte cardiacă și angină pectorală la pacienții fără boală coronariană. După ajustarea pentru factorii de risc cardiovascular comuni, nivelul plasmatic al cistatinei C a fost asociat în mod semnificativ cu dezvoltarea primei complicații coronariene de origine ischemică. În opinia autorilor, scăderea ratei de filtrare glomerulară nu ar justifica valorile mai mari ale cistatinei C prezentate de cazuri în raport cu martorii și au propus că inflamația ar putea fi la originea relației dintre cistatina C și riscul de boală cardiovasculară.31,32 În concordanță cu aceste date, rezultatele noastre au arătat o corelație pozitivă între cistatina C și proteina C reactivă de înaltă sensibilitate (r=0,2), care este, de asemenea, un predictor independent al complicațiilor cardiovasculare, și oferă dovezi suplimentare pentru a justifica prezența unor relații directe între boala renală, inflamație și boala cardiovasculară.
Printre principalele limitări ale studiului prezentat, trebuie subliniat faptul că rezultatele se referă doar la pacienții cu SCA de risc înalt spitalizați într-o unitate de terapie intensivă cardiacă, majoritatea tratați agresiv cu coronarografie precoce. Pe de altă parte, aceste caracteristici trebuie evidențiate, deoarece există puține informații despre această populație specifică, la care cistatina C a fost măsurată la admiterea în spital. În aproape toate studiile publicate nu este indicat momentul determinărilor și, cel puțin la pacienții cu SCA, concentrațiile plasmatice de cistatină C pot fi influențate de perioada de timp scursă de la eveniment și de intervențiile diagnostice și terapeutice efectuate. Limitarea unei urmăriri scurte împiedică extinderea observațiilor noastre pe termen mediu sau lung. Cu toate acestea, constatările noastre oferă o posibilitate de a îmbunătăți stratificarea riscului la pacienții spitalizați pentru SCA cu risc ridicat, ceea ce va fi util pentru a decide terapia, precum și pentru a stabili diagnosticul.
CONCLUZII
Determinarea cistatinei C în momentul spitalizării la pacienții cu SCA cu risc ridicat poate fi un bun instrument clinic pentru stratificarea riscului cardiovascular. Determinarea acestei proteine ar completa informațiile furnizate de alte metode de evaluare a funcției renale și, pe lângă implicațiile diagnostice, ar putea fi utilă pentru identificarea grupului cu cel mai mare risc. Ar putea fi necesar să se acorde o atenție deosebită îndeplinirii recomandărilor cuprinse în ghidurile de practică clinică la această populație. Mai mult, cistatina C ar putea contribui cu informații importante pentru stratificarea pacienților cu SCA cu risc ridicat și funcție renală conservată. Ar putea fi necesare studii suplimentare cu o urmărire mai lungă pentru a defini cu mai multă precizie rolul cistatinei C în SCA.
ABREVIERI
ACS: sindrom coronarian acut
MDRD: Modification of Diet in Renal Disease
TpI: troponină I
.
