Când un gaz în curgere constantă trece printr-o constricție, de exemplu, printr-un orificiu sau o supapă, acesta suferă, în mod normal, o schimbare de temperatură. Acest lucru se datorează în parte schimbărilor de energie cinetică, dar mai există o altă parte la care contribuie non-idealitatea gazului. În cazul în care conductele din amonte și din aval sunt suficient de mari pentru ca energia cinetică să fie neglijabilă în aceste stații, temperaturile din amonte și din aval sunt măsurate suficient de departe de perturbația creată de constricție, iar sistemul este adiabatic; efectul măsurat se datorează doar neidealității. Din prima lege a termodinamicii, un astfel de proces este izenthalpic și se poate defini în mod util un coeficient Joule-Thomson ca fiind:
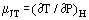
ca o măsură a modificării temperaturii care rezultă dintr-o scădere a presiunii prin constricție.
Pentru majoritatea gazelor reale în jurul condițiilor ambiante, μ este pozitiv – adică temperatura scade pe măsură ce trece prin constricție. Pentru hidrogen și heliu, este negativ și temperatura crește. La temperaturi mai ridicate, pentru majoritatea gazelor, μ scade și poate deveni chiar negativ, μ poate deveni negativ și prin aplicarea presiunii, chiar și la temperatura ambiantă, dar în mod normal sunt necesare presiuni de peste 200 bar pentru a realiza acest lucru.
.
