Colectarea insectelor este un hobby interesant pentru mulți, dar este, de asemenea, foarte util în cercetarea științifică. Această postare va explica cum se colectează și se conservă insectele și va arăta cum ar trebui să fie fixate.
Colectarea insectelor se poate face în orice moment, deși acestea sunt prezente mai ales în timpul primăverii, până toamna târziu. Vara este probabil cea mai bună perioadă, deoarece insectele sunt cele mai abundente. Zilele calde și însorite vor avea probabil cele mai multe insecte prezente, însă ar fi înțelept să verificați de-a lungul diferitelor perioade și condiții meteorologice, deoarece diferite insecte vor apărea în momente diferite. Pe timp de noapte, luminile de pe stradă și cele de pe verandă sunt un loc excelent pentru a căuta. Așternuturile de frunze și plantele sunt susceptibile de a găzdui insecte și există, de asemenea, multe insecte nocturne care stau departe de lumini.
Echipament de colectare:
- Plasă de insecte – Acestea pot fi cumpărate sau confecționate. Ar trebui să fie făcute din plasă, care este cusută pe o pânză de muselină sau pânză care se înfășoară în jurul sârmei. De acolo, insecta poate fi transferată într-un borcan, fie introducând borcanul în plasă, fie ținând insecta de torace.
-

Borcanul meu de ucidere. PC: Colton Weaver Jar de ucidere – Cel mai bine este să aveți 2-3 borcane de mai multe forme și mărimi. Ideal ar fi ca acestea să fie cu dop, însă acest lucru poate depinde. Acestea ar trebui să fie etichetate vizibil cu mențiunea „POISON”. În borcan se adaugă ghips sau bumbac pentru a reține agentul ucigaș. Borror, Delong și Triplehorn recomandă cianura, însă poate fi folosit și acetatul de etil, care este semnificativ mai sigur. Se poate folosi, de asemenea, tetraclorură de carbon sau cloroform.
- Căsuțe de pilule cu șervețele
- Plicuri, sau hârtie pentru a le confecționa – Utile pentru depozitarea temporară. Acestea pot fi ușor de construit pe teren și vă vor păstra specimenele relativ în siguranță.
- Viale umplute cu lichid conservant
- Forceps
- Lentile de mână
- Aspirator – Acestea captează insectele mici în fiole folosind respirația dumneavoastră. De obicei, acestea au o plasă pentru a vă împiedica să respirați insecta.
- Umbrelă sau foaie de bătut – O foaie sau o umbrelă este plasată sub o plantă, care este apoi bătută sau scuturată astfel încât insectele mici să cadă pe foaie.
- Cerneală – Gunoiul de frunze poate fi cernut încet pe o pânză albă sau pe carton, iar apoi insectele găsite pot fi aspirate.
- Capcane – Există multe tipuri de capcane. O pâlnie Berlese are o pâlnie cu un ecran și un bec în partea de sus, cu alcool în partea de jos. Insectele sunt atrase apoi cad în borcanul ucigaș. O capcană luminoasă poate fi eficientă pentru unele insecte și poate fi la fel de simplă ca o lumină deasupra agentului ucigaș sau o capcană în care insectele se așează și pot fi colectate cu mâna. Capcanele cu capcană pot fi utilizate pentru gândaci de carii sau alte insecte care nu zboară și sunt simple cutii de conserve cu momeală la fund. Insectele cad în ele și apoi nu pot scăpa. O capcană simplă ar putea fi doar o soluție de zahăr răspândită pe o suprafață.
- Lampă frontală
- Cuțit cu teacă
Manipularea capturii: Multe insecte cu corpul moale pot fi introduse direct în alcool izopropilic sau etilic de 70-90%. Aceasta include larvele și nimfele multor specii, precum și unele insecte mai mici. Insectele cu corp dur trebuie puse în borcanul de ucidere. Durata depinde de insectă, precum și de agentul de ucidere, și poate varia de la câteva minute la câteva ore. Când insecta este moartă, aceasta trebuie îndepărtată cât mai repede posibil pentru a preveni o decolorare suplimentară. Acestea pot fi păstrate în cutii de pastile sau în plicurile de hârtie descrise mai sus.
Relaxare: Dacă nu puteți să fixați și să întindeți imediat un specimen, acesta se va usca probabil. Când se află în această stare, este destul de fragil și se va rupe dacă încercați să îl aranjați. Pentru a remedia acest lucru, puteți folosi fie o cameră de relaxare, fie un lichid de relaxare, fie puteți fierbe insecta în apă (însă acest lucru o poate deteriora).
Camerele de relaxare sunt recipiente cu nisip sau pânză umedă în interior. În mod ideal, ar trebui să se adauge acid carbolic pentru a preveni orice mucegai. După o zi sau două ar trebui să puteți manipula din nou specimenul.
Lichidul de relaxare poate fi făcut din diferite amestecuri și, de obicei, se lasă insecta în el timp de câteva minute. Un amestec, cunoscut adesea sub numele de lichidul lui Barber, este enumerat mai jos:
| Alcool etilic 95% | 50 cm3 |
| Apă | 50cm3 |
| Ethyl acetat | 20cm3 |
| Benzen | 7cm3 |
O altă metodă care poate fi folosită este injectarea apei de la robinet. Aceasta funcționează la multe lepidoptere. Folosind un ac de calibru 20-25, injectați apă în torace, sub aripă, până la umplerea completă a acestuia. După 5-20 de minute, insecta dvs. ar trebui să fie relaxată.
Prezervare în lichid: Acest lucru poate fi folosit pe multe insecte cu corpul moale (cum ar fi mayflies, stoneflies, caddisflies, etc.), care nu pot fi fixate decât dacă sunt uscate așa cum s-a menționat mai sus. Este, de asemenea, utilă pentru specimene foarte mici care urmează să fie studiate pe lame de microscop, precum și pentru larvele și nimfele de insecte. Artropodele care nu sunt insecte ar trebui, de asemenea, să fie conservate în acest mod.
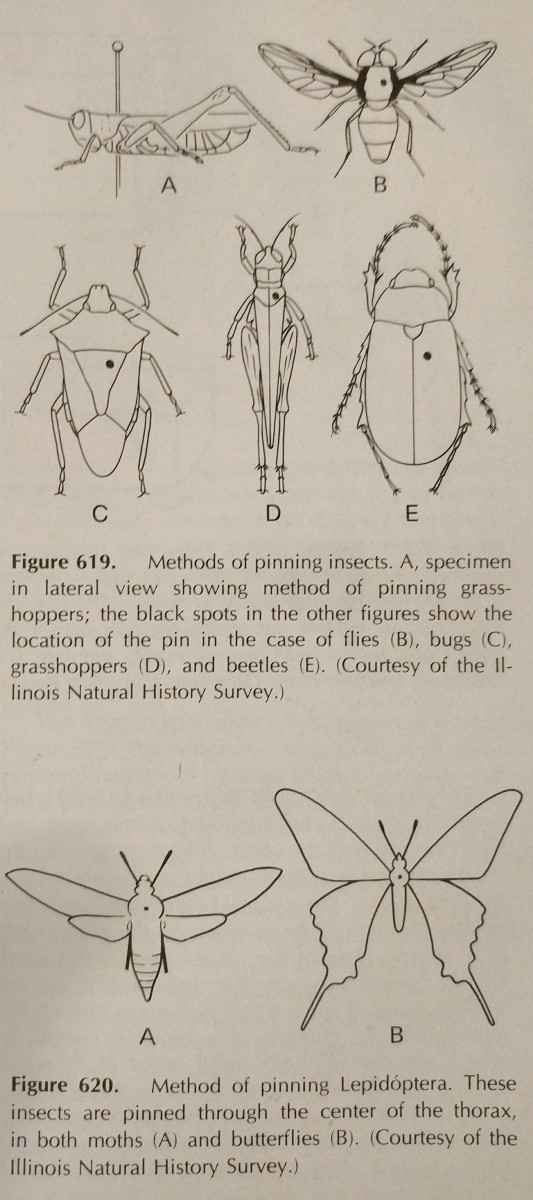
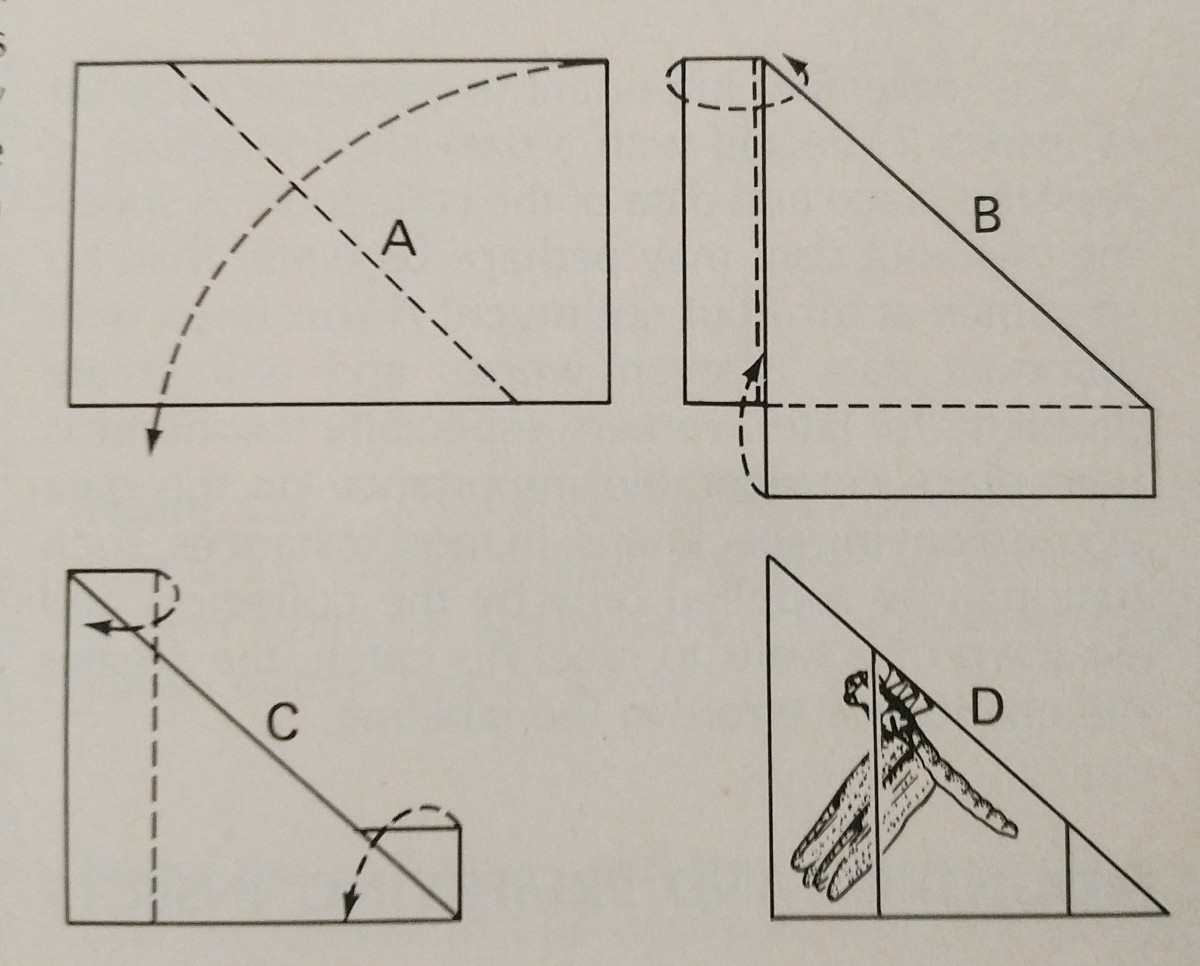
Înfigeți: Acesta este cel mai simplu mod de a conserva o insectă cu corp dur. Culorile se estompează adesea atunci când insecta se usucă, însă acest lucru este dificil de evitat. Ar trebui să se folosească ace speciale pentru insecte, care sunt mai lungi și nu ruginesc. Acestea sunt disponibile în mărimile 00-7, însă cele mai mici pot fi mai puțin aplicabile. Comenzi diferite ar trebui să fie fixate cu ace în zone diferite, ceea ce este ilustrat. Picioarele ar trebui să fie extinse, la fel ca și aripile. Adesea, albinele vor avea limba întinsă pentru o identificare mai ușoară.
Este mai bine ca toate speciile dintr-o colecție să fie fixate cu ace la distanțe uniforme. Aproximativ 25 mm deasupra vârfului este ideal, iar distanțele uniforme pot fi atinse cu ușurință prin utilizarea unui bloc de prindere, care este pur și simplu un bloc de lemn cu găuri făcute la diferite adâncimi.
Îndepărtarea unei insecte ține foarte mult de practică. Folosirea unei planșe de împrăștiere face sarcina mult mai ușoară,
iar existența unor ace și benzi de hârtie suplimentare este esențială. Acele pot fi folosite pentru a se deplasa în jurul membrelor și aripilor.
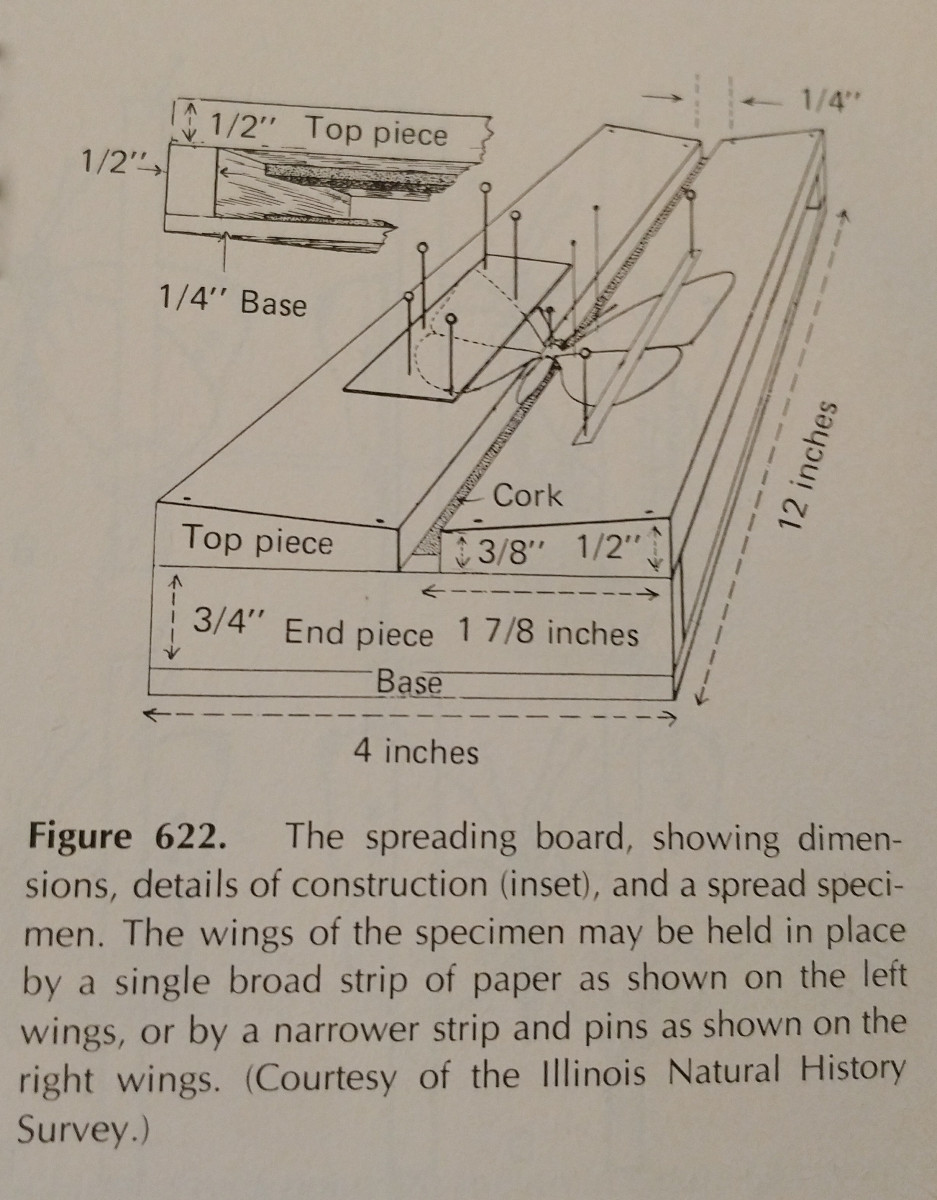
În mod obișnuit, presiunea trebuie aplicată pe vena marginală anterioară a aripii, în special la Lepidoptere. Marginea posterioară a aripilor unei lepidoptere ar trebui să fie în unghi drept cu toracele acesteia, iar aripile posterioare în sus, astfel încât să nu existe un spațiu între ele și aripile anterioare, așa cum este ilustrat. Este  important să fiți foarte atenți și să folosiți forceps pentru a manipula insectele. Ele sunt foarte fragile și, adesea, solzii și antena pot fi desprinse cu ușurință. Se pot folosi benzi de hârtie și ace pentru a fixa aripile, iar apoi acestea vor rămâne în poziție după ce se usucă.
important să fiți foarte atenți și să folosiți forceps pentru a manipula insectele. Ele sunt foarte fragile și, adesea, solzii și antena pot fi desprinse cu ușurință. Se pot folosi benzi de hârtie și ace pentru a fixa aripile, iar apoi acestea vor rămâne în poziție după ce se usucă.
Insectele mici au nevoie de puțină ingeniozitate pentru a fi montate și pot fi lipite pe vârfuri de carton, ace mici sau pe lame microscopice. Pur și simplu prindeți vârful de carton, puneți o cantitate mică de lipici pe el, apoi lipiți insecta.
Secare: Multe insecte fixate cu ace pot fi uscate la aer într-un loc cald și uscat. Moliile mai mari pot avea nevoie de o cameră de uscare cu unul sau mai multe becuri de lumină în interior, iar pentru unele specimene mari poate fi nevoie chiar de îndepărtarea organelor din abdomen. Nu există un timp definitiv necesar pentru ca un specimen să se usuce, însă acest lucru va veni odată cu experiența.
Insectele cu corpul moale pot fi liofilizate sau uscate în vid și apoi fixate cu ace, pentru a crea un specimen nefragilizat și nedecolorat. În mod obișnuit, acestea s-ar zbârci, însă acest pas le face suficient de uscate pentru a rămâne pe un ac.
În mod obișnuit se folosește o soluție de alcool etilic. Unele comune sunt enumerate mai jos.
| Soluția lui Hood | |
| 70-.80% alcool etilic | 95 cm3 |
| Glicerină | 5 cm3 |
| Soluția lui Kahle | |
| 95%. Alcool etilic | 30 cm3 |
| Formaldehidă | 12 cm3 |
| Acid acetic glacial | 4 cm3 |
| Apă | 60 cm3 |
| Soluție alcoolică Bouin’s | |
| 80% alcool etilic | 150 cm3 |
| Formaldehidă | 60 cm3 |
| Acid acetic glacial | 15 cm3 |
| Acid pitric | 1g |
Dacă tot suntem la capitolul soluții, acetatul de etil poate fi adesea ineficient asupra larvelor, așa că iată agenți ucigași care sunt suficienți:
| amestec de KAD | |
| 95% alcool etilic | 70-.100 cm3 |
| Kerosen (se reduce pentru larvele cu corpul moale, cum ar fi viermii) | 10 cm3 |
| Acid acetic glacial | 20 cm3 |
| Dioxan | 10 cm3 |
| amestec de XA | |
| 95% acetat de etil | 50 cm3 |
| Xilenă | 50 cm3 |
Ambele metode ar trebui să dureze 1/2 – 4 ore. Toți agenții de ucidere cunoscuți elimină culoarea, în special verdele, permite și roșul.
În mod normal, specimenele conservate trebuie inspectate o dată sau de două ori pe an, în cazul în care s-a evaporat vreun lichid. În caz afirmativ, acesta trebuie înlocuit.
Montarea pe lame de microscop: Există două tipuri de monturi pentru microscop: permanente și temporare. Acestea folosesc medii de montaj diferite, iar la monturile temporare, de obicei, după montaj, specimenele sunt readuse în conservant, unde pot fi păstrate pe termen nelimitat. Monturile permanente sunt montate o singură dată și apoi nu mai pot fi îndepărtate, însă pot rezista destul de mult timp, chiar și câțiva ani.
Multe insecte cu corpul moale pot fi puse direct în mediul de montaj, însă unele trebuie să fie curățate mai întâi într-un lichid special. Principalele soluții utilizate în acest scop sunt KOH și soluția Nesbitt. Acest proces implică adesea înmuierea insectei timp de câteva ore până la mai multe zile atunci când se face la rece, deși se poate face mai repede folosind căldură și KOH.
Specimenele mici pot fi montate pe o lamelă normală, în timp ce cele mai mari pot avea nevoie de o lamelă în depresiune sau de un suport pentru sticla de acoperire.
Mediile folosite pentru montări temporare pe lamelă includ apa, alcoolul, glicerina și jeleul de glicerină. Apa și alcoolul pot rezista doar câteva minute înainte de a se evapora, așa că glicerina este în general folosită dacă specimenele doresc să fie studiate pentru o perioadă de timp prelungită.
Acesta încheie acest post, precum și secțiunea de conservare a lui Borror, Delong și Triplehorn. Cea mai mare parte a restului de muncă pentru acest SOS va consta în compilarea documentelor și a diapozitivelor mele, precum și în a mă asigura că diagramele de flux și protocolul meu sunt toate în ordine.
.
