 Open Access Article
Open Access Article Acest articol cu acces liber este licențiat sub licența
Acest articol cu acces liber este licențiat sub licența
Creative Commons Attribution 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc și Lei Tao *a
*a
aKey Laboratory of Bioorganic Phosphorus Chemistry & Chemical Biology (Ministry of Education), Department of Chemistry, Tsinghua University, Beijing 100084, P. R. China. E-mail: [email protected]
bThe State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, R. P. Chineză
cCollege of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, R. P. Chineză. China
dCancer Institute & Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
Primul publicat la 27 martie 2017
Derivații de polietilenglicol (PEG) au fost utilizați pe scară largă în cercetările legate de biotehnologie. Cu toate acestea, oligomerii PEG (cu diferite greutăți moleculare) sau monomerii pe bază de PEG (cu diferite grupe terminale ale lanțului) au de fapt proprietăți chimice și fizice diferite, ceea ce ar putea duce la o potențială toxicitate. În această lucrare, citotoxicitatea unei serii de derivați PEG (oligomeri și monomeri) a fost măsurată folosind drept celule model celule umane de cancer de col uterin (HeLa) și o linie celulară de fibroblaste derivate de la șoareci (L929). Majoritatea oligomerilor PEG sunt siguri pentru ambele tipuri de celule, cu excepția trietilenglicolului (TEG), care este toxic la concentrații ridicate pentru celulele L929. Pe de altă parte, monomerii pe bază de PEG, inclusiv poli(etilen glicol) metil eter acrilat (mPEGA) și poli(etilen glicol) metil eter metacrilat (mPEGMA), au prezentat o citotoxicitate evidentă. Ulterior, acești derivați toxici ai PEG au fost studiați pentru a descoperi diferitele mecanisme ale toxicității lor. Această cercetare actuală a evaluat citotoxicitatea derivaților PEG și a evidențiat pericolul potențial al biomaterialelor „sigure”, ceea ce ar putea oferi o referință utilă pentru persoanele care vor utiliza derivații PEG în viitoarele cercetări biomedicale.
Introducere
Polietilenglicolul (PEG) a fost aplicat pe scară largă în diverse domenii medicale datorită proprietăților sale remarcabile, cum ar fi siguranța satisfăcătoare, biocompatibilitatea, hidrofilicitatea etc. De exemplu, PEG a fost utilizat în unele laxative aprobate de Food and Drug Administration datorită capacității sale excelente de reținere a umidității și de lubrifiere.1-3 Într-un alt exemplu, modificarea medicamentelor/proteinelor cu PEG (PEGilare) poate îmbunătăți în mod eficient solubilitatea lor în apă și timpul de înjumătățire în circulație a medicamentelor,4,5 ceea ce duce la creșterea siguranței și a efectelor terapeutice. De fapt, PEGilarea devine una dintre cele mai atractive biotehnologii și obține un succes uriaș în cercetarea fundamentală și pe piață.6-11 Până în prezent, mulți derivați de PEG au fost utilizați ca materii prime excelente pentru a sintetiza o serie de noi materiale polimerice pentru bioaplicații.12 De exemplu, un PEG liniar a fost modificat ca PEG difuncționalizat (DF-PEG), care ar putea fi utilizat pentru a genera rapid un hidrogel autovindecător interesant.13,14 Unii oligomeri PEG au fost utilizați pentru a modifica suprafața nanoparticulelor anorganice pentru a îmbunătăți solubilitatea în apă și a reduce toxicitatea acestor materiale anorganice.15-17 Unii monomeri comerciali pe bază de PEG, cum ar fi acrilatul de poli(etilen glicol) metil eter (mPEGA) și metacrilatul de poli(etilen glicol) metil eter (mPEGMA), au fost utilizați pentru a pregăti polimeri ramificați pentru conjugarea ulterioară a proteinelor, autoasamblarea, administrarea de medicamente etc.18-27
Deși PEG este considerat în mod normal ca fiind aproape netoxic, cercetătorii au observat unele probleme de siguranță ale PEG cu greutăți moleculare mici. Smyth et al. au raportat toxicitatea orală cronică a oligomerului PEG (Mn ∼ 200) la șobolani28,29 , rezultatele adverse au fost observate și la maimuțe30 , sugerând potențiale probleme de siguranță ale acestor materiale „sigure”. Prin urmare, având în vedere utilizarea pe scară largă a derivaților PEG în domeniile de cercetare, studiul sistematic al citotoxicității acestor oligomeri PEG și monomeri pe bază de PEG este necesar și important pentru aplicarea lor ulterioară în domenii legate de biologie (Schema 1).
În lucrarea de față, a fost evaluată citotoxicitatea unor oligomeri de PEG (cu diferite greutăți moleculare) și a unor monomeri comerciali pe bază de PEG (cu diferite grupe terminale ale lanțului) față de celulele umane de cancer de col uterin (HeLa) și față de o linie celulară de fibroblaste derivate de la șoareci (L929). A fost observată citotoxicitatea dependentă de greutatea moleculară a oligomerilor de PEG, iar mecanismele diferite de citotoxicitate ale oligomerilor de PEG și ale monomerilor pe bază de PEG au fost dezvăluite pentru prima dată. Aceste informații despre citotoxicitatea derivaților PEG ar putea fi referințe valoroase pentru cei care aleg PEG ca materii prime și proiectează căi de purificare pentru a pregăti materiale biocompatibile pe bază de PEG pentru aplicații biomedicale ulterioare.
Materiale și metode
2.1 Produse chimice
Trietilenglicol (TEG, 97%, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), poli(etilenglicol) metil eter acrilat 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), poli(etilen glicol) metil eter metacrilat 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) și poli(etilen glicol) metil eter metacrilat 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) au fost utilizate direct, fără purificare suplimentară.
Cele de cancer de col uterin uman (HeLa) și o linie celulară de fibroblaste derivate de la șoareci (L929) au fost achiziționate de la American type culture collection (ATCC). Mediu Dulbecco’s modified eagle medium (DMEM, Corning-Cellgro), Phosphate Buffered Saline (PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), ser fetal bovin (FBS, Gibco), mediu de cultură Roswell Park Memorial Institute 1640 (RPMI 1640 culture medium, Gibco), soluție de penicilină-streptomicină (Gibco), tripsină-EDTA (Gibco, 0.25%), 4-(3-(3-(2-metoxi-4-nitrofenil)-2-(4-nitrofenil)-2H-tetrazol-3-ium-5-il)benzen-1,3-disulfonat (CCK-8, Beyotime), diacetat de 2,7-diclorodihidrofluoresceină (DCFH-DA, Beyotime), glutation oxidat (GSSG, Beyotime), nicotinamidă adenină dinucleotidă fosfat (NADPH, Beyotime), 5,5′-ditiobis-(acid 2-nitrobenzoic) (DTNB, Beyotime), diacetat de fluoresceină (FDA, Sigma) și iodură de propidiu (PI, 94%, Sigma) au fost utilizate așa cum au fost achiziționate.
2.2 Cultura celulară
Cultura celulară a fost menținută într-un incubator la 37 °C cu 5% CO2, mediul de cultură a fost schimbat la fiecare una sau două zile pentru menținerea creșterii exponențiale a celulelor. Celulele HeLa au fost derivate din celule de cancer de col uterin și au fost cultivate în mediu DMEM suplimentat cu 10% ser fetal de bovine (FBS) și 1% penicilină și streptomicină. Celulele L929 au provenit de la șoareci și au fost cultivate în mediu RPMI 1640 suplimentat cu 10% ser fetal bovin (FBS) și 1% penicilină și streptomicină.
2.3 Analiza citotoxicității
Rezultatele au fost prezentate sub formă de medie ± abatere standard (SD), iar valorile concentrației maxime de inhibiție la jumătate 50% (IC50) a derivaților PEG au fost calculate cu ajutorul SPSS 15.0.
Conform lucrărilor noastre anterioare,32,33 diacetatul de fluoresceină (FDA) și iodura de propidiu (PI) ar putea fi utilizate ca o metodă rapidă și convenabilă de colorare dublă pentru a observa viabilitatea celulară. Celulele L929 au fost însămânțate într-o placă cu 24 de godeuri la o densitate de ∼5 × 104 celule pe ml. După atașare, celulele au fost spălate cu PBS și cultivate cu diferite concentrații de derivați PEG în mediu de cultură timp de 24 h. Apoi, mediul a fost îndepărtat, iar celulele au fost spălate cu PBS. Ulterior, s-a adăugat o soluție mixtă PBS-FDA-PI (FDA: 3 μg mL-1; PI: 3 μg mL-1), iar placa cu 24 de godeuri a fost incubată la 37 °C timp de 15 min. S-a utilizat un microscop cu fluorescență (Leica Germania) pentru a observa celulele vii și moarte sub filtre de excitație cu trecere de bandă de 450-490 nm și, respectiv, 515-560 nm (I3 și N2.1) (lampă cu mercur de 100 W).
În rezumat, celulele L929 au fost însămânțate într-o placă cu 24 de godeuri și incubate în 0,5 ml de mediu de cultură cu diferite concentrații de TEG (A, A′) timp de 1 h (Fig. 1), godeurile A1-A6 au fost utilizate pentru a măsura cantitatea totală de glutation (GSH + GSSG), în timp ce godeurile A′1-A′6 au fost utilizate pentru a măsura cantitatea de glutation oxidat (GSSG) în prezența TEG. După 1 h, celulele au fost colectate prin digestie cu tripsină și centrifugare (1000 rpm, 5 min). Apoi, s-a adăugat o soluție de eliminare a proteinelor în volum triplu (50 mg mL-1) pentru a elimina proteinele zgomotoase. După trei cicluri rapide de congelare-dezghețare în azot lichid și într-o baie de apă la 37 °C, suspensiile au fost plasate într-un frigider (4 °C) timp de 5 min, iar probele de supranatant celular au fost obținute după centrifugare (10 000 rpm, 10 min). Probele din godeurile A1-A6 au fost utilizate pentru a măsura nivelul total de glutation (GSH + GSSG). S-a adăugat soluție de NADPH (0,5 mg mL-1) pentru a reduce tot glutationul la GSH, apoi, s-a folosit 5,5′-ditiobis-(acid 2-nitrobenzoic) (DTNB) pentru a oxida GSH, absorbția modificată la 405 nm a fost înregistrată cu un cititor de microplăci (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Probele din godeurile A′1-A′6 au fost utilizate pentru a măsura nivelul de glutation oxidat (GSSG). Prin utilizarea soluției de îndepărtare a GSH, în soluția de probă a rămas doar GSSG. Probele au fost analizate prin aceeași metodă ca mai sus pentru a măsura nivelul de GSSG. Cantitatea totală de glutation și cantitatea de glutation oxidat au fost colectate pentru a calcula nivelul de glutation redus, în timp ce nivelul de GSH al celulelor din mediul de cultură pur a fost utilizat ca martor. Rezultatele au fost prezentate ca medie ± SD.
000 rpm, 10 min). Probele din godeurile A1-A6 au fost utilizate pentru a măsura nivelul total de glutation (GSH + GSSG). S-a adăugat soluție de NADPH (0,5 mg mL-1) pentru a reduce tot glutationul la GSH, apoi, s-a folosit 5,5′-ditiobis-(acid 2-nitrobenzoic) (DTNB) pentru a oxida GSH, absorbția modificată la 405 nm a fost înregistrată cu un cititor de microplăci (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Probele din godeurile A′1-A′6 au fost utilizate pentru a măsura nivelul de glutation oxidat (GSSG). Prin utilizarea soluției de îndepărtare a GSH, în soluția de probă a rămas doar GSSG. Probele au fost analizate prin aceeași metodă ca mai sus pentru a măsura nivelul de GSSG. Cantitatea totală de glutation și cantitatea de glutation oxidat au fost colectate pentru a calcula nivelul de glutation redus, în timp ce nivelul de GSH al celulelor din mediul de cultură pur a fost utilizat ca martor. Rezultatele au fost prezentate ca medie ± SD.
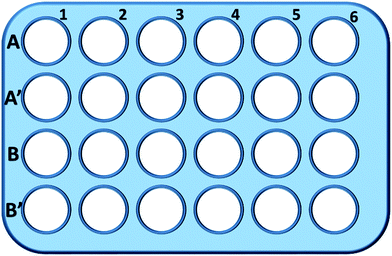
Casele din linia B și B′ au fost utilizate pentru a testa cantitatea totală de GSH și, respectiv, GSSG în prezența mPEGA-480, prin aceeași procedură.
Rezultate și discuții
3.1 Studiul viabilității celulare
Când a fost utilizată celula HeLa (un model de celule canceroase) (Fig. 2A), citotoxicitatea tuturor oligomerilor PEG la concentrații mici (≤5 mg mL-1) a putut fi neglijată. Odată cu creșterea concentrației (≥10 mg mL-1), s-a observat citotoxicitatea dependentă de greutatea moleculară a probelor de PEG. Trietilenglicolul (TEG) a prezentat o citotoxicitate evidentă peste 10 mg mL-1 (p < 0,05; contrast cu orice alt oligomer atunci când concentrația este mai mare de 5 mg mL-1), iar valoarea IC50 a TEG pentru celulele HeLa a fost calculată ca fiind de 19,8 mg mL-1. Între timp, alți oligomeri PEG (Mn ∼ 400-4000) au prezentat, de asemenea, o citotoxicitate minusculă.
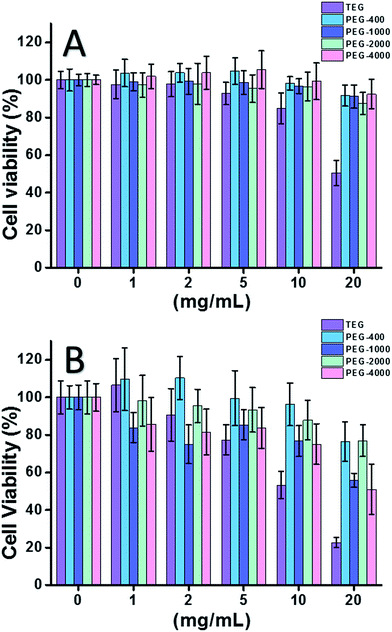
A fost evaluată, de asemenea, citotoxicitatea oligomerilor de PEG pentru celulele L929 (un model de celule normale) (Fig. 2B). Viabilitatea celulară a scăzut odată cu creșterea concentrației de PEG, așa cum era de așteptat. În afară de TEG, unii oligomeri de PEG (PEG-1000, PEG-4000), care sunt siguri pentru celulele HeLa, au prezentat, de asemenea, citotoxicitate detectabilă, valorile IC50 ale TEG, PEG-1000 și PEG-4000 au fost calculate ca fiind de 12,4, 22,5 și, respectiv, 20,0 mg mL-1 pentru celulele L929, indicând, de asemenea, citotoxicitatea dependentă de greutatea moleculară a oligomerilor de PEG.
Rezultatele de mai sus au sugerat că celulele HeLa au o toleranță mai bună la oligomerii PEG decât celulele L929, datorită vitalității tenace a celulelor canceroase, iar TEG-ul are o citotoxicitate mult mai mare decât alți oligomeri PEG cu greutăți moleculare mai mari (p < 0,05; contrast cu orice alt oligomer atunci când concentrația este mai mare de 5 mg mL-1). Se remarcă faptul că cercetarea actuală a demonstrat citotoxicitatea moderată a PEG-1000 și PEG-4000 față de celulele L929, iar PEG-400 și PEG-2000 sunt aproape lipsite de citotoxicitate, ceea ce este diferit de impresia comună conform căreia PEG-urile cu greutate moleculară mare ar trebui să fie mai biocompatibile decât omologii lor cu greutate moleculară mică. Deși motivul citotoxicității PEG-urilor nu este încă clar, PEG-400 și PEG-2000 par a fi alegeri mai bune pentru cei care doresc să sintetizeze materiale biocompatibile.
Când a fost testat mPEGMA-500, viabilitatea celulară atât a celulelor HeLa, cât și a celulelor L929 a scăzut odată cu creșterea concentrației de mPEGMA-500 (Fig. 3A) și nu s-a observat nicio diferență aparentă între cele două tipuri de celule. Valorile IC50 ale mPEGMA-500 sunt de 4,7 mg mL-1 pentru celulele HeLa și de 5,3 mg mL-1 pentru celulele L929 după 24 de ore de cultură, ceea ce indică o citotoxicitate mai semnificativă a mPEGMA-500 decât oligomerii de PEG menționați mai sus și implică faptul că grupele terminale ale lanțului derivaților de PEG sunt esențiale pentru toxicitatea acestora. Atunci când mPEGMA-950, un alt metacrilat pe bază de PEG cu aceeași grupare de capăt de lanț, dar cu o greutate moleculară mai mare, a fost testat prin aceeași procedură (Fig. 3B), a fost observată o citotoxicitate mult mai mică a mPEGMA-950 pentru celulele HeLa sau L929 (p < 0,05; când concentrația este mai mare de 2 mg mL-1), valorile IC50 ale mPEGMA-950 sunt de 20,8 mg mL-1 pentru celulele HeLa și de 21,5 mg mL-1 pentru celulele L929.7 mg mL-1 la celulele L929 după 24 h de cultură, demonstrând, de asemenea, citotoxicitatea dependentă de greutatea moleculară a metacrilatului pe bază de PEG.
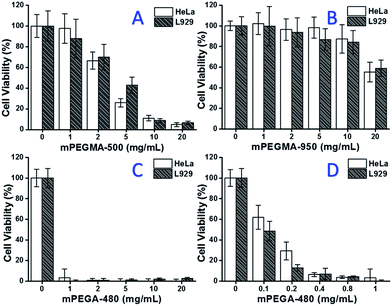
În plus, a fost testat și acrilatul pe bază de PEG mPEGA-480. Deși diferența dintre mPEGA-480 și mPEGMA-500 este doar o grupare metil la capătul lanțului, mPEGA-480 a prezentat citotoxicitate acută (Fig. 3C). Mai mult de 95% din celule și-au pierdut viabilitatea chiar și cu 1 mg mL-1 mPEGA-480 în mediul de cultură. Astfel, trebuie efectuate experimente suplimentare cu concentrații mai mici pentru a determina citotoxicitatea sa (Fig. 3D), iar valorile IC50 ale mPEGA-480 au fost calculate ca fiind de 0,2 mg mL-1 la celulele HeLa și de 0,1 mg mL-1 la celulele L929 după 24 h de cultură.
Experimentele de viabilitate celulară au confirmat faptul că atât grupările terminale ale lanțului, cât și greutatea moleculară sunt elemente de influență importante pentru citotoxicitatea derivaților PEG, iar monomerii pe bază de PEG au prezentat o citotoxicitate mult mai vizibilă în comparație cu oligomerii PEG.
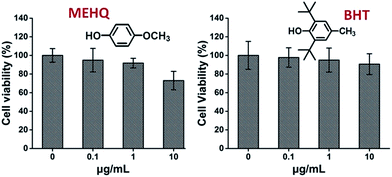
Între timp, a fost evaluată, de asemenea, citotoxicitatea inhibitorilor din monomerii pe bază de PEG, eterul metilic de hidrochinonă (MEHQ, 100 ppm în mPEGA) și butilhidroxitoluenul butilat (BHT, 300 ppm în mPEGMA) (Fig. 4), iar celulele L929 au păstrat o viabilitate ridicată (≥90%) la o concentrație scăzută de inhibitori (≤1 μg mL-1). Există 0,1 μg mL-1 de MEHQ în 1 mg mL-1 de mPEGA-480 și 3 μg mL-1 de BHT în 10 mg mL-1 de mPEGA-500, în timp ce mPEG-480 și mPEGMA-500 au demonstrat citotoxicitate evidentă la aceste concentrații. Prin urmare, urmele de inhibitori din monomerii pe bază de PEG par să aibă o influență neglijabilă asupra citotoxicității monomerilor.
3.2 Observarea morfologiei celulare
Observarea la microscopul optic a fost utilizată pentru a evalua direct citotoxicitatea derivaților PEG la celulele L929. Imaginile optice ale celulelor L929 expuse la 20 mg mL-1 TEG și 0,1 mg mL-1 mPEGA timp de 24 h au fost prezentate în Fig. 5A și, respectiv, B.
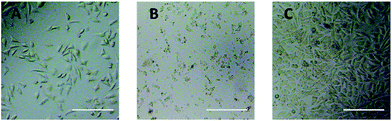
După incubarea cu 20 mg mL-1 TEG timp de 24 h, celulele și-au păstrat morfologia similară (Fig. 5A) cu cea a grupului de control (Fig. 5C, celule în mediu de cultură pur), dar numărul de celule a scăzut dramatic, indicând citotoxicitatea TEG la concentrație mare, care a dus la moartea și detașarea ulterioară a celulelor de pe fundul microplăcii. Fig. 5B a arătat morfologia celulelor L929 după incubarea cu 0,1 mg mL-1 mPEGA-480. Aproape toate celulele și-au pierdut morfologia normală, sugerând citotoxicitatea acută a mPEGA-480 chiar și la o concentrație atât de mică.
În plus, celulele au fost colorate și cu fluoresceină. Dubla colorare FDA/PI este o procedură rapidă, simplă și simultană de observare a celulelor vii și moarte.43 FDA poate pătrunde în celulele complete și se poate acumula în celule, prin urmare, membrana celulară completă este necesară pentru a preveni scurgerea fluoresceinei din celulă. În schimb, PI nu poate trece prin membrana celulară intactă, dar poate colora nucleul celulelor moarte prin trecerea prin membrana celulară deteriorată. După cum arată Fig. 6, celulele L929 incubate cu 20 mg mL-1 TEG au mai puține celule viabile după colorarea cu FDA (Fig. 6b) în comparație cu martorul (Fig. 6a), iar după colorarea cu PI se pot observa mai multe celule moarte (Fig. 6b). 6b′), identic cu rezultatul prin observare prin microscopie optică. citotoxicitatea acută a mPEGA-480 a fost, de asemenea, observată după procedura de colorare dublă FDA/PI, niciun semnal verde nu a putut fi identificat după incubarea celulelor cu 0,1 mg mL-1 mPEG-480 timp de 24 h (Fig. 6c și c′′).
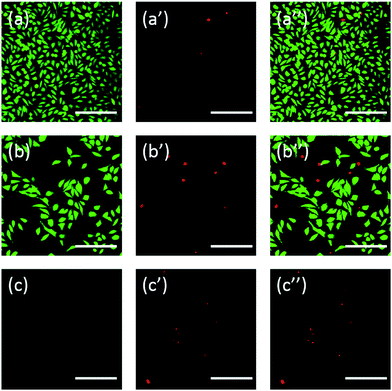
Atât imaginile optice, cât și cele fluorescente au demonstrat în mod intuitiv citotoxicitatea acestor derivați PEG, susținând și mai mult concluzia obținută prin testele CCK-8. Se observă că mPEGA-480 a părut mai toxic prin testul de dublă colorare FDA/PI, ceea ce se atribuie faptului că dubla colorare FDA/PI distinge caracterul complet al membranei celulelor vii/morți, în timp ce testul CCK-8 detectează activitatea dehidrogenazei din mitocondrii, sugerând că colorarea FDA/PI este un supliment excelent al testului CCK-8 pentru a oferi mai multe detalii despre starea celulelor.
3.3 Studiul mecanismului
Conform experimentelor de viabilitate celulară, au fost calculate și rezumate valorile IC50 ale oligomerilor PEG și ale monomerilor pe bază de PEG pentru celulele HeLa și L929 după 24 h de cultură (tabelul 1), sugerând că monomerii pe bază de PEG sunt mult mai toxici pentru celule decât oligomerii PEG, iar mPEGA are cea mai mare citotoxicitate. Prin urmare, generarea de ROS și scăderea GSH în celule, două mecanisme principale de citotoxicitate, au fost analizate pentru a cerceta motivul posibil al citotoxicității.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| Celule HeLa | 19.8 | 32.5 | 36.2 | 38.2 | 29.6 | 4.7 | 20.8 | 0.2 |
| L929 cells | 12.4 | 24.7 | 22,5 | 28,7 | 20,0 | 5,3 | 21,7 | 0,1 |
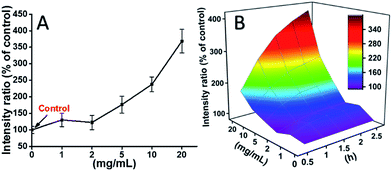
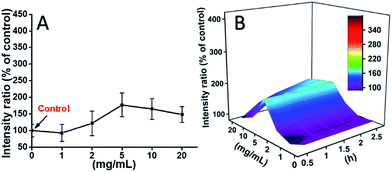
Celele L929 au fost incubate cu TEG, iar nivelurile de ROS la diferite momente de timp (0, 0,5, 1,0, 1,5, 2 h) au fost detectate în conformitate cu rapoartele noastre anterioare și prezentate în Fig. 7. Ca exemplu, nivelurile ROS după incubarea cu diferite concentrații de TEG timp de 2 h au fost prezentate în Fig. 7A. Se poate observa în mod clar că nivelurile ROS s-au menținut stabile cu o concentrație scăzută de TEG (≤2 mg mL-1), dar au crescut semnificativ atunci când concentrația de TEG este mai mare de 2 mg mL-1, în concordanță cu rezultatul experimentului de viabilitate celulară din Fig. 2B. În mod similar, figurile nivelului ROS în funcție de concentrația de TEG la diferite momente de timp au fost desenate și îmbinate pentru a obține o hartă 3D (Fig. 7B). Nivelurile maxime de ROS au fost găsite la 2 h cu 20 mg mL-1 TEG, a fost detectat un nivel de ROS crescut cu aproximativ 400% față de control (nivel ROS = 100), rezultând cea mai strălucitoare intensitate de fluorescență. Aceste rezultate sugerează că generarea de ROS este mecanismul posibil al citotoxicității TEG, iar nivelul ridicat de ROS indus de TEG ar putea fi principalul motiv al apoptozei celulare.
Au fost testate, de asemenea, nivelurile de ROS induse de mPEGA-480 după 2 h (Fig. 8A). Diferit de TEG, mPEGA nu a provocat creșterea rapidă a ROS în celule, doar ∼170% creștere ROS în comparație cu controlul a fost observată ca fiind maximă. Nivelul 3D ROS în funcție de timpul mPEGA & (Fig. 8B) a arătat nivelul ROS indus de mPEGA-480 ca un val, iar creasta a apărut la o concentrație moderată de mPEGA (5 mg mL-1), nu se poate observa o generare semnificativă de ROS, ceea ce sugerează că generarea de ROS ar putea contribui doar parțial la citotoxicitatea mPEGA-480.
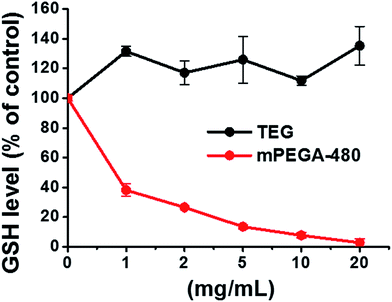
Grupul tiol reducător din GSH este o importantă sursă anti-oxidare în organisme. Un posibil mecanism pentru citotoxicitatea mPEGA-480 este atribuit de acesta reacției de adiție Michael dintre grupul tiol și legătura vinilică, care duce la ruperea echilibrului redox intracelular și la apoptoza celulară. Cercetările anterioare au sugerat că adiția Michael dintre tiol și acrilat este mult mai rapidă decât cea dintre tiol și metacrilat52 , ceea ce ar putea fi o cauză rezonabilă pentru citotoxicitatea acută diferită dintre mPEGA-480 și mPEGMA-500.
Concluzii
A fost evaluată pentru prima dată citotoxicitatea oligomerilor de PEG și a monomerilor pe bază de PEG pentru celulele HeLa și L929. A fost confirmată citotoxicitatea dependentă de concentrație a oligomerilor PEG și a monomerilor pe bază de PEG și a fost prezentată ca valori IC50 pentru celulele HeLa și L929. PEG-400, PEG-2000 par aproape necitotoxice în cercetarea actuală. PEG-1000, PEG-4000 și mPEGMA-950 au prezentat o citotoxicitate moderată, în special la concentrații ridicate. TEG și mPEGMA-500 au prezentat citotoxicitate semnificativă, iar mPEGA-480 a prezentat citotoxicitate acută. În plus, tipurile de celule influențează, de asemenea, rezultatele studiului de citotoxicitate, celulele HeLa sunt mai robuste decât celulele L929 pentru a tolera derivații PEG. Aceste rezultate despre citotoxicitatea derivaților PEG sunt preliminare, dar fundamentale pentru viitoarea lor aplicație biomedicală, mai multe informații despre răspunsul și comportamentul celulelor la alți derivați PEG vor fi investigate în continuare.
Recunoștințe
Această cercetare a fost susținută de Fundația Națională de Știință din China (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein și G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan și J. L. Herrera, Am. J. Gastroenterol., 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper și M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang și D. I. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun și H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris și R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese și G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley și J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill și W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner și W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann și A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li și Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao și Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng și Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad și S. J. Lippard, Proc. Natl. acad. Sci. U. S. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan și D. Dixon, Gold Bull., 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li și Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao și Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo și H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka și H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya și C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander și P. Caliceti, Bioconjugate Chem., 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang și K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao și K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh și E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu și W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter și C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter și C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice și S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki și M. Watanabe, Anal. Commun., 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei și X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, Y. Zhang, X. Zhang, L. Tao, S. Li și Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang și J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller și C. A. Thorne, Anal. Biochem, 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode și S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown și A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta și S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han și W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. S. Alconcel și H. D. Maynard, Chem. Commun., 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake și L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang și P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones și J. A. Senft, J. Histochem. Cytochem, 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim și I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka și M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu și H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li și J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, H. Jung, J.-K. Lee, J. S. Kim și M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate și H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch și W. J. Stark, Toxicol. Lett., 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser și P. Wick, Toxicol. Lett., 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer și D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
.
