Circulația uterină este extrem de sensibilă la stimularea estrogenică, răspunzând cu un grad de vasodilatație care nu are egal în niciun alt organ al corpului la niciun alt stimul.2 În timpul ciclului ovarian, apar modele repetitive de UBF care reflectă efectul secreției de estrogen și efectele modulatoare ale progesteronului. Aceste modele ciclice sunt demonstrate cel mai dramatic la animalele cu faze scurte ale ciclului preovulator, cum ar fi vaca, scroafa și oaia, și sunt ilustrate în figura 1 cu nivelurile periferice de estrogen și progesteron.3, 4, 5 După concepție la aceste specii, modelele UBF sunt similare cu cele de la animalele care nu sunt gestante până când intervine interdigitația țesuturilor materne și fetale între 17 și 28 de zile mai târziu; apoi, există o creștere definitivă și progresivă a UBF care continuă până la sarcina la termen. Deoarece eroziunea endometrului de către trofoblastul fetal are loc mult mai devreme după concepție la primate, este rezonabil să presupunem că UBF crește mai devreme la aceste specii, deși astfel de răspunsuri nu au fost niciodată observate. Modelele generale ale UBF totale, UBF pe unitatea de greutate a uterului și a conținutului acestuia, fracțiunea de UBF care alimentează placenta și greutatea fetală pe parcursul sarcinii ovine sunt ilustrate în figura 2. Perioada cuprinsă între 17 și 70 de zile de gestație este asociată cu cele mai rapide modificări ale UBF și PBF și corespunde cu momentul placentației definitive la această specie. Prin mecanisme incomplet înțelese, vasele de sânge care alimentează placenta se dilată progresiv în această perioadă, provocând simultan o creștere absolută a UBF total și o deviere a acestui sânge de la țesuturile neplacentare la cele placentare.* Odată cu maturizarea ulterioară a placentei, fracțiunea de UBF care alimentează placenta și cantitatea absolută de PBF cresc, dar la rate mai apropiate de cele ale creșterii fetale; astfel, în ultima jumătate a sarcinii, UBF pe unitatea de greutate a uterului și a conținutului său este practic constantă. În aceeași perioadă, cantitatea de oxigen extrasă din fiecare mililitru de sânge este constantă și, prin urmare, cantitatea de oxigen furnizată per greutate dată a uterului gravid este, de asemenea, constantă.6 Studiile corelative efectuate la femei indică modele homeostatice similare între 10 și 40 de săptămâni de gestație și un consum de oxigen similar (aproximativ 10 ml/kg).7 Deoarece femeile furnizează aceeași cantitate de oxigen la rate UBF mai mici decât cele ale oilor (~150 față de ~270 ml/kg), rezultă că placenta umană este mai eficientă în această privință. Astfel, pentru fetuși cu greutate similară, este necesară o cantitate mai mică de UBF absolută și sarcina sarcinii asupra inimii este diminuată.
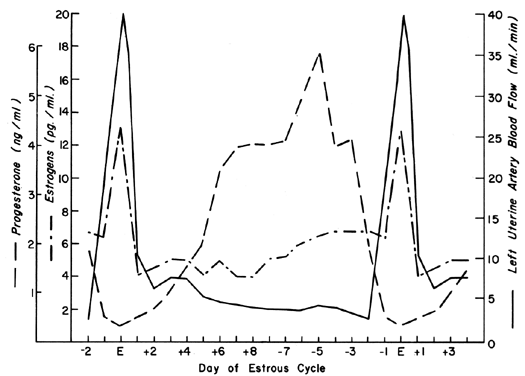 Fig. 1. Modelul fluxului sanguin uterin unilateral în timpul ciclului estral ovine ilustrat cu nivelurile serice raportate de estrogeni și progesteron. (Adaptat din Greiss FC, Jr, Anderson SG: Am J Obstet Gynecol 103:629, 1969; Yuthasastrakosol P et al: J Reprod Fertil 43:57, 1975.)
Fig. 1. Modelul fluxului sanguin uterin unilateral în timpul ciclului estral ovine ilustrat cu nivelurile serice raportate de estrogeni și progesteron. (Adaptat din Greiss FC, Jr, Anderson SG: Am J Obstet Gynecol 103:629, 1969; Yuthasastrakosol P et al: J Reprod Fertil 43:57, 1975.)
 Fig. 2. Modele longitudinale ale fluxului sanguin uterin și distribuția acestuia în timpul sarcinii ovine.
Fig. 2. Modele longitudinale ale fluxului sanguin uterin și distribuția acestuia în timpul sarcinii ovine.
Modificările în PBF sunt realizate printr-o vasodilatație tot mai mare a vaselor de sânge care alimentează placenta pe tot parcursul gestației. Cu toate acestea, la un moment dat, în timpul celui de-al doilea și al treilea trimestru, practic nu mai poate avea loc o vasodilatație acută a acestor vase. Prin urmare, pentru a menține o livrare constantă de oxigen în timpul episoadelor de PBF redus, trebuie să aibă loc o extracție crescută de oxigen (Fig. 3). Pe baza datelor raportate, s-ar părea că limita extracției crescute este dublă. Astfel, PBF trebuie să fie redus cu mai mult de 50% înainte ca aportul de oxigen să fie diminuat. Aceste considerații presupun că rata de PBF homeostatică a fost optimă înainte de reducerea debitului. Știm, totuși, că nivelurile homeostatice pot fi suboptime fie subacut, ca în cazul toxemiei, fie cronic, ca în cazul nefropatiilor. În astfel de cazuri, factorul de siguranță, adică procentul în care PBF poate fi redus înainte ca livrarea de oxigen să fie compromisă, este redus. Acest lucru trebuie să fie întotdeauna luat în considerare atunci când se evaluează efectul unui stimul acut asupra fătului.
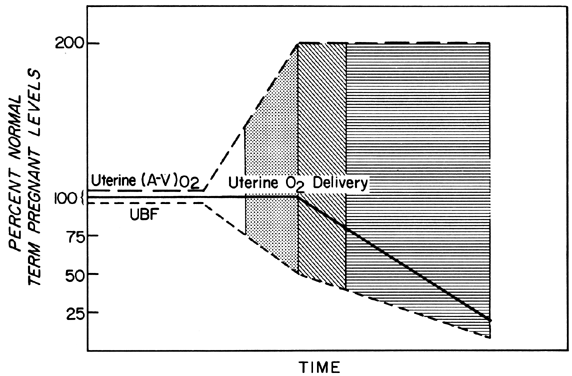 Fig. 3. Modificări ale extracției arteriovenoase uterine de oxigen – (A-V)02 – ca răspuns la reducerile fluxului sanguin uterin în timpul celei de-a doua jumătăți a gestației ovine. Deoarece (A-V)02 poate fi dublată, livrarea uterină de 02 se va menține la niveluri homeostatice până când fluxul sanguin uterin este redus cu mai mult de 50%. Zonele clare, punctate și căptușite indică grade ipotetice de rezervă fetală atunci când sunt definite în funcție de fluxul sanguin placentar optim și sunt utilizate pentru a indica niveluri similare de rezervă fetală în ilustrațiile ulterioare. (Adaptat după Huckabee WE, Metcalfe J, Prystowsky H et al: Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
Fig. 3. Modificări ale extracției arteriovenoase uterine de oxigen – (A-V)02 – ca răspuns la reducerile fluxului sanguin uterin în timpul celei de-a doua jumătăți a gestației ovine. Deoarece (A-V)02 poate fi dublată, livrarea uterină de 02 se va menține la niveluri homeostatice până când fluxul sanguin uterin este redus cu mai mult de 50%. Zonele clare, punctate și căptușite indică grade ipotetice de rezervă fetală atunci când sunt definite în funcție de fluxul sanguin placentar optim și sunt utilizate pentru a indica niveluri similare de rezervă fetală în ilustrațiile ulterioare. (Adaptat după Huckabee WE, Metcalfe J, Prystowsky H et al: Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
*La om și la primatele subumane, arteriolele spiralate care vor alimenta spațiul intervilos (aproximativ una per cotiledon placentar) își pierd conexiunile capilare și se dilată de aproximativ zece ori ca urmare a înlocuirii pereților vaselor de către trofoblast. Acest proces se poate extinde până la sau sub joncțiunea mioendometrială, transformând literalmente arteriolele spirale în artere spirale. Sângele care curge prin aceste vase de sânge modificate în spațiul intervilos cuprinde PBF.
La specia ovină, în starea de nongraviditate sunt prezente multiple zone discrete de endometru numite caruncule. În timpul sarcinii, interdigitația țesuturilor fetale și materne are loc în aceste caruncule, care se măresc pentru a deveni cotiledoane placentare individuale. Sângele care circulă în aceste zone cuprinde în mod colectiv PBF. Deși vasele de sânge arteriale cotiledonare se dilată semnificativ, acestea nu conțin elemente trofoblastice, transferul materno-fetal se face printr-o interfață capilar-capilară și nu există un spațiu intervilos.
Răspunsurile dinamice ale circulației uterine
Vasele sanguine ale uterului nongravid răspund în mod similar cu cele ale oricărui alt organ muscular, cu excepția reactivității lor unice la stimularea estrogenică, a răspunsului lor la agenții anestezici locali și, posibil, a răspunsului lor la prostaglandine (tabelul 1). În timpul sarcinii, vasele de sânge care alimentează placenta se dilată progresiv, atingând o stare în care se poate produce o dilatare acută minimă sau nu se mai poate produce nicio dilatare acută.24 Prin urmare, stimulii care evocă vasodilatația în uterul care nu este însărcinat sunt ineficienți după ce a avut loc placentarea definitivă. Cu toate acestea, vasele placentare își păstrează capacitatea de vasoconstricție ca în starea de non-graviditate. Deoarece PBF reprezintă aproximativ 80% până la 90% din UBF total la sarcina la termen, răspunsurile vasculare uterine totale vor apărea ca fiind cele ale vaselor placentare. Acest aspect este adesea interpretat greșit și trebuie reținut faptul că răspunsurile vaselor neplacentare sunt aceleași indiferent dacă există sau nu sarcină.
TABELUL 1. Răspunsurile vasculaturii uterine non-gravide*
|
Vasoconstricție |
Vasodilatație |
|
|
α-Stimulare adrenergică |
β-Stimulare adrenergică |
|
|
(dopamină, epinefrina, |
(izoproterenol, epinefrină)8,9,16 |
|
|
norepinefrina)8,9,10 |
Acetilcolină și agenți parasimpaticomimetici23 |
|
|
Simpaticomimetic agenți11 |
Adenosine17 |
|
|
(medicamente vasopresoare) |
Bradikinină17,18 |
|
|
Hipoxemie(severă)12 |
Cianură19 |
|
|
Agenți anestezici locali |
Substanțe estrogene |
|
|
(administrare intraarterială)13,14 |
(efect întârziat, dar prelungit)2 |
|
|
Nicotina |
Glucozamina |
|
|
(mediere α-adrenergică)15 |
(? efect osmotic)21 |
|
|
Hipoxemie (ușoară)12 |
||
|
Ischemie19 |
||
|
Nitroglicerină19 |
||
|
Prostaglandine E1, E2, și I18,22 |
||
|
Polipeptidul intestinal vasoactiv20 |
* Dilatarea marcată a vaselor de sânge care alimentează placenta și distribuția preponderentă a fluxului sanguin uterin către placentă obliterează răspunsurile gravidei; prin urmare, efectele stimulentelor vasodilatatoare în timpul sarcinii sunt controversate. Atunci când sunt testate, răspunsurile vasculare non-placentare sunt similare cu răspunsurile non-gravidei.
Structura hemocentrică a placentei umane adaugă un factor unic la cei care controlează în mod normal fluxul sanguin în alte paturi vasculare. Adică, sângele traversează arterele spirale pentru a intra în spațiul intervilan mlăștinos, perfuzează vilozitățile fetale și apoi revine în circulația generală prin numeroase vene colectoare din placa bazală. Practic, sângele părăsește canalele vasculare normale pentru a circula într-un nou spațiu extravascular grefat pe uter pe toată durata sarcinii. Deoarece spațiul intervilos se află în cavitatea uterină și deoarece placenta este o structură flexibilă, presiunea generată de contracția miometrului va fi transmisă în mod egal în cavitatea amniotică și în spațiul intervilos. Astfel, un factor străin de controlul vascular obișnuit, activitatea miometrului, poate modifica presiunea din spațiul intervilos și poate influența PBF prin efectele sale asupra presiunii de perfuzie. O reprezentare schematică a fluxului sanguin către țesuturile neplacentare și către un singur cotiledon este prezentată în figura 4, împreună cu formulele relevante pentru controlul fiecăruia. Trebuie remarcat faptul că aceste formule sunt doar aplicații ale legii lui Ohm la aceste situații cardiovasculare individuale.
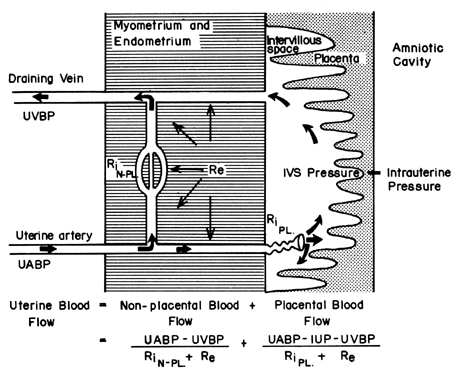 Figura 4. Circulațiile nonplacentară și placentară și factorii care afectează fiecare dintre ele în uterul primatelor. Relația dintre acești factori și fluxul sanguin distributiv este definită în ecuația alăturată. UABP, tensiunea arterială uterină; UVBP, tensiunea arterială venoasă uterină; Re, rezistența vasculară extrinsecă; RiN-PL și RiPL, rezistența vasculară intrinsecă cauzată de reactivitățile arteriolelor neplacentară și, respectiv, placentară.(Din Greiss FC, Jr: MCV/Q, 8:52, 1972.)
Figura 4. Circulațiile nonplacentară și placentară și factorii care afectează fiecare dintre ele în uterul primatelor. Relația dintre acești factori și fluxul sanguin distributiv este definită în ecuația alăturată. UABP, tensiunea arterială uterină; UVBP, tensiunea arterială venoasă uterină; Re, rezistența vasculară extrinsecă; RiN-PL și RiPL, rezistența vasculară intrinsecă cauzată de reactivitățile arteriolelor neplacentară și, respectiv, placentară.(Din Greiss FC, Jr: MCV/Q, 8:52, 1972.)
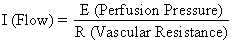
Presiunea de perfuzie care livrează sângele către țesuturile neplacentare este diferența dintre presiunea arterială și cea venoasă uterină. Cu toate acestea, presiunea de perfuzie care livrează sânge în spațiul intervilos este diferența dintre presiunea sanguină arterială uterină și presiunea din spațiul intervilos. Aceasta din urmă este cel mai bine aproximată de presiunea lichidului amniotic (IUP). Într-un organ muscular, factorii de rezistență vor include rezistența datorată reactivității mușchilor netezi vasculari, sau rezistența intrinsecă (Ri), și apăsarea impusă vaselor de sânge pe măsură ce traversează miometrul în contracție, sau rezistența extrinsecă (Re). Ar trebui să fie evident atunci că contracțiile uterine pot afecta PBF prin două mecanisme: prin creșterea Re și prin reducerea presiunii de perfuzie placentară.
În practica clinică, trei caracteristici majore ale controlului vascular placentar sunt importante. Acestea includ relația dintre presiunea de perfuzie și debit, răspunsurile arterelor spirale la stimulii vasoactivi și efectele contracțiilor miometriale. În plus, trebuie apreciate efectele unice ale agenților anestezici locali.
Relația presiune-flux
Când se observă modificări ale UBF secundare reducerilor presiunii de perfuzie în timpul quiescenței miomato-triale, se poate dezvolta o relație în linie dreaptă cu o pantă de unu (Fig. 5). Acest lucru reflectă natura larg dilatată a vasculaturii placentare și indică faptul că PBF va scădea aproape identic proporțional cu scăderea presiunii de perfuzie. Deoarece presiunea venoasă uterină este destul de constantă în majoritatea circumstanțelor, modificările presiunii sanguine sistemice (MBP) pot fi utilizate pentru a aproxima modificările PBF. Adică, o scădere de 25% a presiunii arteriale medii ar trebui să provoace o scădere de 25% a PBF. Cu toate acestea, astfel de măsurători ar trebui făcute în poziția de decubit lateral, deoarece s-a demonstrat că numai presiunea uterului gravid asupra aortei scade presiunea sanguină în zona pelviană sub cea observată la nivelul arterei brahiale.
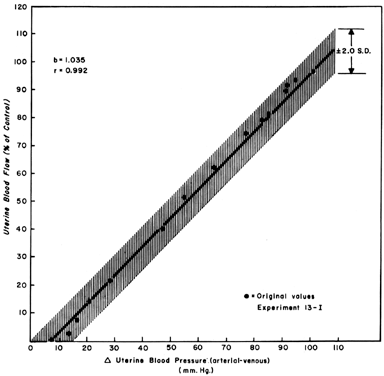 Fig. 5. Linia de regresie presiune-debit determinată din datele proporționale grupate la oile gestante la termen. Deoarece relația este liniară, debitul sanguin uterin va varia cu și proporțional cu orice modificare a presiunii de perfuzie. (Din Greiss FC, Jr: Am J Obstet Gynecol 96:41, 1966.)
Fig. 5. Linia de regresie presiune-debit determinată din datele proporționale grupate la oile gestante la termen. Deoarece relația este liniară, debitul sanguin uterin va varia cu și proporțional cu orice modificare a presiunii de perfuzie. (Din Greiss FC, Jr: Am J Obstet Gynecol 96:41, 1966.)
Răspunsuri la stimuli vasoactivi
Din moment ce arterele spiralate se apropie de dilatarea maximă în stare de repaus, agenții sau stimulii vasodilatatori au un efect redus sau nu au niciun efect, chiar dacă sunt prezenți receptori pentru astfel de agenți. Cu toate acestea, mușchii netezi ai acestor vase sunt extrem de sensibili la agenții sau stimulii vasoconstrictori, mai mult decât majoritatea celorlalte paturi vasculare periferice (Fig. 6). Aceasta înseamnă că, deși MPB poate crește ca răspuns la stimularea cu un medicament vasopresor cu acțiune periferică, cum ar fi fenilefrina, creșterea proporțională a rezistenței vasculare placentare (Ri) este ATÂT de mult mai mare încât efectul net este o scădere marcantă a PBF. Astfel de diferențe de sensibilitate vasoconstrictoare trebuie să fie luate în considerare ori de câte ori este indicat un medicament vasopresor. Utilizarea unui medicament cu acțiune mai centrală, cum ar fi efedrina, deși cauzează o cantitate mică de vasoconstricție placentară, va duce la o îmbunătățire proporțional mai mare a MBP cu o creștere absolută a PBF.
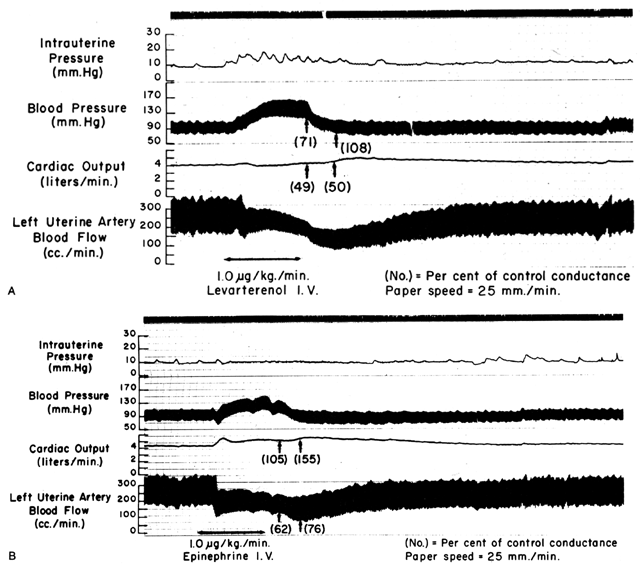 Fig. 6. Înregistrări originale care arată efectele tratamentului intravenos cu ( A) levarterenol (norepinefrină) și ( B) epinefrină asupra tensiunii arteriale materne, debitului cardiac și fluxului sanguin uterin la o ovină gravidă la termen. Modificările proporționale față de nivelurile de control ale conductanței sistemice și uterine (reciproca rezistenței) au fost inserate în paranteze. Rețineți că scăderea conductanței uterine (creșterea rezistenței) o depășește pe cea a conductanței sistemice cu alți agenți. (Din Greiss FC, Jr: Obstet Gynecol 21:295, 1963. Courtesy of Harper & Row, Publishers.)
Fig. 6. Înregistrări originale care arată efectele tratamentului intravenos cu ( A) levarterenol (norepinefrină) și ( B) epinefrină asupra tensiunii arteriale materne, debitului cardiac și fluxului sanguin uterin la o ovină gravidă la termen. Modificările proporționale față de nivelurile de control ale conductanței sistemice și uterine (reciproca rezistenței) au fost inserate în paranteze. Rețineți că scăderea conductanței uterine (creșterea rezistenței) o depășește pe cea a conductanței sistemice cu alți agenți. (Din Greiss FC, Jr: Obstet Gynecol 21:295, 1963. Courtesy of Harper & Row, Publishers.)
Contracții miometriale
Actând prin cele două mecanisme discutate mai sus, creșterea Re și scăderea presiunii de perfuzie, contracțiile miometriale scad PBF în proporție directă cu intensitatea și durata fiecărei contracții. Relația este atât de precisă încât o trasare a presiunii intrauterine este aproape o imagine inversă exactă a PBF (Fig. 7). Creșterea frecvenței contracțiilor scade PBF pe parcursul unei unități de timp date prin scăderea duratei diastolei miometriale, acel moment în care PBF se află la niveluri homeostatice. În plus, în cazul în care tonusul de intercontracție este ridicat, așa cum se întâmplă în cazul unei rupturi de placentă, PBF intercontracțional va fi redus proporțional. Studiile radioangiografice la primate subumane și la femei arată că, în timpul acmeului contracțiilor miometriale de intensitate medie, PBF încetează.25 Este evident, așadar, că travaliul este în mod inerent stresant pentru făt, deoarece cantitatea medie de PBF care perfuzează vilozitățile fetale pe o anumită perioadă de timp scade progresiv pe măsură ce frecvența și intensitatea contracțiilor uterine cresc.
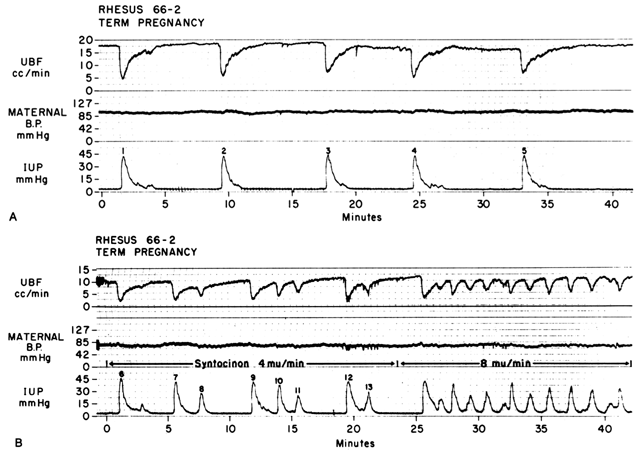 Fig. 7. A. Relația dintre fluxul sanguin uterin (UBF) și contracțiile uterine în timpul travaliului spontan la o maimuță rhesus. Observați relația inversă a imaginii, scăderi bruște ale UBF la debutul contracțiilor și recuperarea mai lentă a UBF de la nivelurile bazale. UBF a recăpătat nivelurile bazale numai în timpul tonusului „normal”. B. Efectul frecvenței crescute a contracțiilor asupra UBF produs de stimularea cu oxitocină a travaliului spontan prezentat în A. Observați că durata fazelor de tonus normal este diminuată. Rata UBF atinsă între contracții depinde de intensitatea contracției precedente și de durata fazei de tonus normal. După contracțiile 7 și 12, recuperarea fluxului a fost incompletă deoarece contracția următoare a avut loc fără o fază de tonus normal. (Din Greiss FC, Jr, Anderson SG: Clin Obstet Gynecol 11:96, 1968. Courtesy of Harper & Row, Publishers.)
Fig. 7. A. Relația dintre fluxul sanguin uterin (UBF) și contracțiile uterine în timpul travaliului spontan la o maimuță rhesus. Observați relația inversă a imaginii, scăderi bruște ale UBF la debutul contracțiilor și recuperarea mai lentă a UBF de la nivelurile bazale. UBF a recăpătat nivelurile bazale numai în timpul tonusului „normal”. B. Efectul frecvenței crescute a contracțiilor asupra UBF produs de stimularea cu oxitocină a travaliului spontan prezentat în A. Observați că durata fazelor de tonus normal este diminuată. Rata UBF atinsă între contracții depinde de intensitatea contracției precedente și de durata fazei de tonus normal. După contracțiile 7 și 12, recuperarea fluxului a fost incompletă deoarece contracția următoare a avut loc fără o fază de tonus normal. (Din Greiss FC, Jr, Anderson SG: Clin Obstet Gynecol 11:96, 1968. Courtesy of Harper & Row, Publishers.)
Agenți anestezici locali
Aceste medicamente pot exercita efecte asupra unui pat vascular în mod direct, ca după o injectare intravasculară involuntară, și indirect, ca urmare a paraliziei nervilor autonomi care mențin tonusul vascular normal. În majoritatea organelor, injecțiile intravasculare nu au efecte semnificative asupra rezistenței vasculare. Cu toate acestea, vascularizațiile uterină și placentară răspund la astfel de stimuli cu o vasoconstricție semnificativă. În plus, miometrul este stimulat în mod variabil de astfel de medicamente (Fig. 8). Singure sau împreună, aceste răspunsuri diminuează PBF. În urma anesteziei de bloc paracervical administrate în timpul travaliului, poate apărea o bradicardie fetală întârziată. Cea mai bună ipoteză pentru a explica răspunsul fetal este că agenții anestezici locali sunt injectați în apropierea arterelor uterine și că, datorită penetrării lor excelente, traversează pereții arteriali pentru a-și produce efectele uterine scăzând PBF și provocând hipoxie fetală.
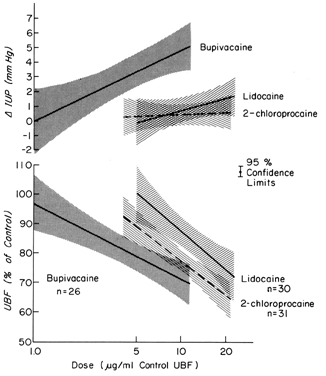 Fig. 8. Relațiile doză-răspuns ale agenților anestezici locali administrați direct în artera uterină cu conductanța vasculară uterină și presiunea intrauterină în timpul gestației ovine. Nivelurile dozelor efective se încadrează în intervalele observate la fetuși în timpul bradicardiei după anestezia blocului paracervical. (Din Fishburne JI, Jr et al: Responses of the gravidine uterine vasculature to arterial levels of local anesthetic agents. Am J Obstet Gynecol 133:753, 1979. Prin amabilitatea The C. V. Mosby Company.)
Fig. 8. Relațiile doză-răspuns ale agenților anestezici locali administrați direct în artera uterină cu conductanța vasculară uterină și presiunea intrauterină în timpul gestației ovine. Nivelurile dozelor efective se încadrează în intervalele observate la fetuși în timpul bradicardiei după anestezia blocului paracervical. (Din Fishburne JI, Jr et al: Responses of the gravidine uterine vasculature to arterial levels of local anesthetic agents. Am J Obstet Gynecol 133:753, 1979. Prin amabilitatea The C. V. Mosby Company.)
.
