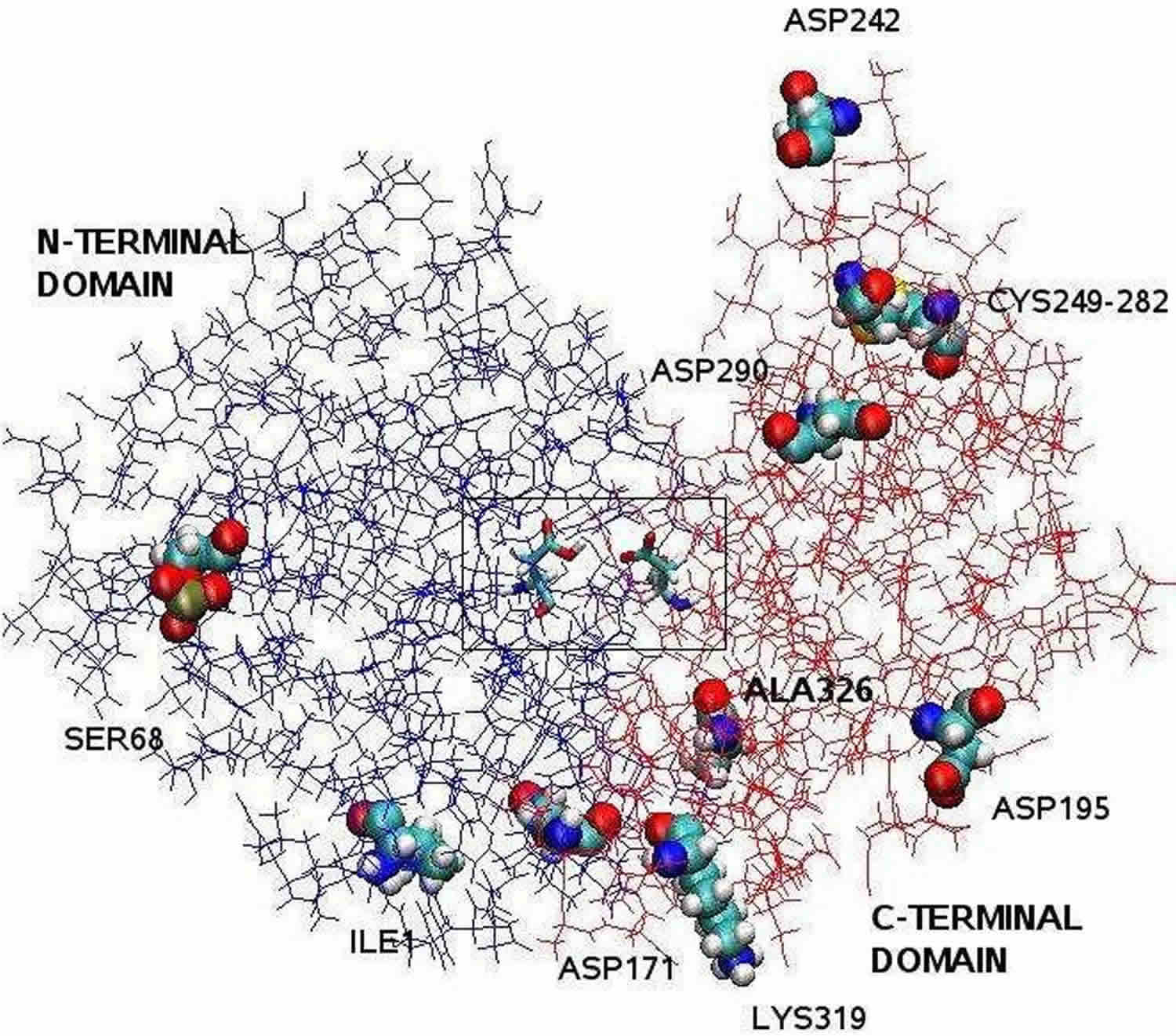
 Nota de subsol: Structura pepsinei clarificată prin cristalografie cu raze X este bilobă, cu o fantă mare a situsului activ între cei doi lobi. Reziduurile 1 – 175 formează domeniul N-terminal, în timp ce reziduurile 176 – 326 constituie domeniul C-terminal. Două aspartatite din centrul fantei, Asp32 și Asp215, funcționează ca reziduuri catalitice. Situl catalitic, format din Asp32 și Asp215, este situat în centrul fantei. Reziduurile de aminoacizi încărcați situate pe suprafața proteinei sunt: Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (cel N-terminal), Ala326 (cel C-terminal). Ser68 fosforilat este complet expus la solvent, iar puntea disulfură dintre Cys 249 și Cys 282 este situată pe suprafața proteinei.
Nota de subsol: Structura pepsinei clarificată prin cristalografie cu raze X este bilobă, cu o fantă mare a situsului activ între cei doi lobi. Reziduurile 1 – 175 formează domeniul N-terminal, în timp ce reziduurile 176 – 326 constituie domeniul C-terminal. Două aspartatite din centrul fantei, Asp32 și Asp215, funcționează ca reziduuri catalitice. Situl catalitic, format din Asp32 și Asp215, este situat în centrul fantei. Reziduurile de aminoacizi încărcați situate pe suprafața proteinei sunt: Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (cel N-terminal), Ala326 (cel C-terminal). Ser68 fosforilat este complet expus la solvent, iar puntea disulfură dintre Cys 249 și Cys 282 este situată pe suprafața proteinei.
Pepsina, fiind o protează aspartică, are un pH optim foarte scăzut. Kondjoyan, Daudin și Santé-Lhoutellier 9) au studiat digestibilitatea proteinelor miofibrilare și au constatat o activitate maximă a pepsinei la un pH în jur de 2. Pletschke, Naudé și Oelofsen 10) au studiat hidroliza hemoglobinei de către pepsina porcină și de struț și au constatat, de asemenea, un pH optim de 2,0 pentru activitatea pepsinei. Odată activată de pH <4,5, enzima pepsină este ușor denaturată de un pH mai mare de 7,0, constituind proprietăți care determină caracteristicile pepsinei 11).
În contrast cu influența pH-ului, efectul forței ionice asupra activității enzimatice este mai puțin discutat. Lucrările anterioare ale lui Dale și White 12) au arătat că mărirea tăriei ionice scade clar viteza de reacție a ribonucleazei pancreatice imobilizate, în timp ce Butré, Wierenga și Gruppen 13) au studiat hidroliza enzimatică a izolatului proteic din zer de către alcalaza și neutraza și au constatat, de asemenea, că prezența 0.5M NaCl a scăzut rata de hidroliză.
Sunt cunoscuți doi inhibitori naturali puternici ai pepsinei: pepstatina, o pentapeptidă din Streptomyces, și un inhibitor proteic unic din Ascaris. Pepsina suferă, de asemenea, o inhibiție de feedback; un produs al digestiei proteinelor încetinește reacția prin inhibarea pepsinei 14).
Unde se produce pepsina?
Celele șefului secretă pepsină sub forma unui precursor enzimatic inactiv numit pepsinogen. Când pepsinogenul intră în contact cu acidul clorhidric din celulele parietale, se descompune rapid, formând pepsină 15). Pepsina începe digestia aproape tuturor tipurilor de proteine alimentare în polipeptide. Această enzimă este cea mai activă într-un mediu acid, care este furnizat de acidul clorhidric din sucul gastric.
Figura 2. Celulele stomacale (glandele gastrice)
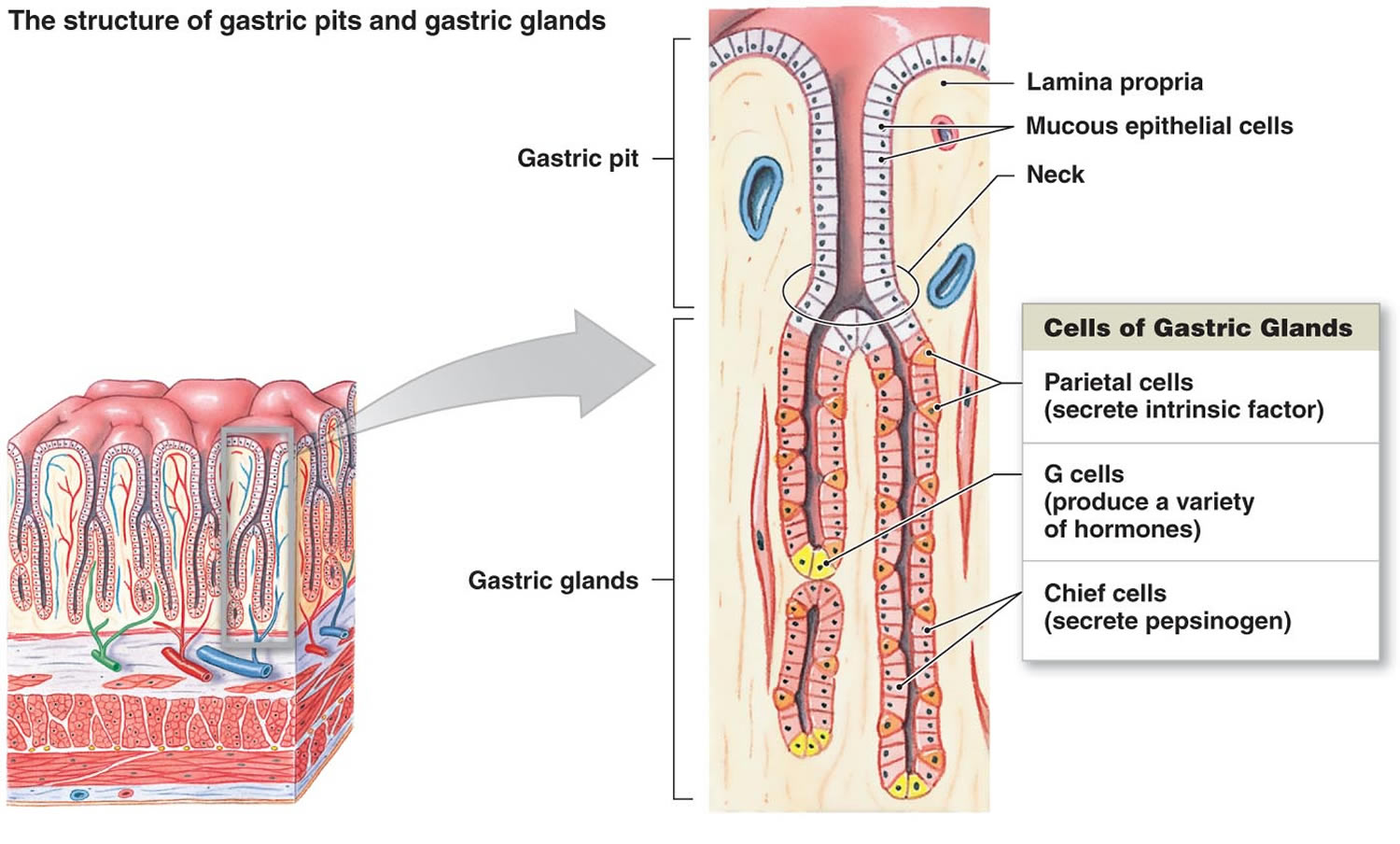 Nota de subsol: Căptușeala stomacului. Glandele gastrice includ celulele mucoase, celulele parietale și celulele șefului. Mucoasa stomacului este împânzită de gropi gastrice care reprezintă deschiderile glandelor gastrice.
Nota de subsol: Căptușeala stomacului. Glandele gastrice includ celulele mucoase, celulele parietale și celulele șefului. Mucoasa stomacului este împânzită de gropi gastrice care reprezintă deschiderile glandelor gastrice.
Ce face pepsina?
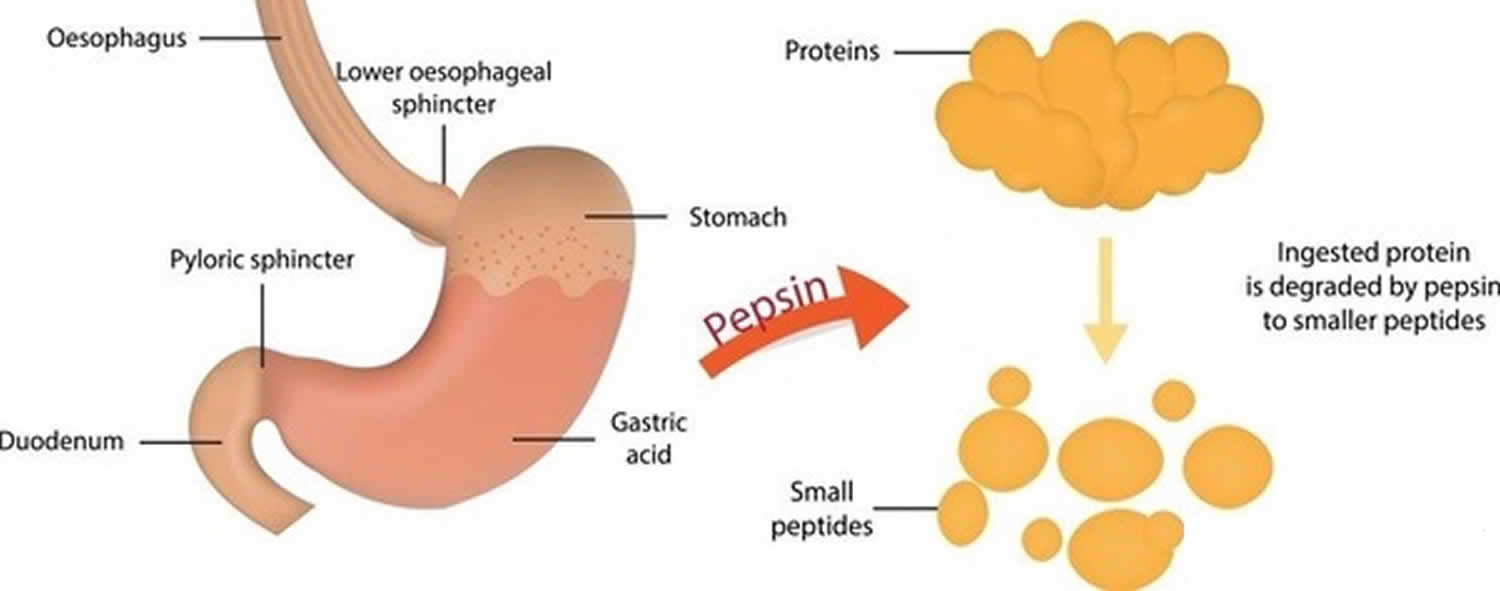
Pepsina formată din pepsinogen (forma inactivă a pepsinei) în prezența acidului clorhidric, digeră aproape toate tipurile de proteine alimentare în polipeptide (compuși proteici mai mici). Pepsina digeră proteinele în acidul gastric puternic. Pepsina este optimizată pentru digestia alimentelor în mediul acid al stomacului și este prima protează pe care proteinele alimentare o întâlnesc în tractul digestiv. Pepsina este cea mai activă în medii acide între 37 °C și 42 °C 16).
Specificitatea pepsinei (adică probabilitatea de scindare a legăturilor peptidice de către pepsină) este influențată în principal de reziduurile de aminoacizi din pozițiile P1 și P1′, în timp ce reziduurile de aminoacizi din alte subsite pot juca, de asemenea, un rol. În general, pepsina preferă să cliveze după fenilalanină, leucină și metionină, în timp ce rareori clivează după histidină, lizină, prolină și arginină 17). Reziduurile aromatice tirozină, triptofan și fenilalanină sunt favorizate la poziția P1′. Prolina este puternic defavorizată în poziția P2, P2′ și P3′, în timp ce histidina, lizina și arginina sunt defavorizate în poziția P3. Pozițiile P4 și P4′ au o influență redusă 18).
Figura 3. Funcția pepsinei
.
