Den vanliga långa formen av det periodiska systemet är utformad för att betona elektronkonfigurationer. Eftersom det är de yttersta (valens)elektronerna som i första hand är inblandade i kemiska interaktioner mellan atomer, är den sista elektronen som läggs till en atom i uppbyggnadsprocessen av mycket större intresse för en kemist än den första. Denna sista elektron kallas den särskiljande elektronen eftersom den skiljer en atom från den omedelbart föregående i det periodiska systemet. Den typ av underskal (s, p, d, f) som den särskiljande elektronen placeras i är mycket nära relaterad till ett grundämnes kemiska beteende och ger upphov till den klassificering som visas av färgkodningen på det periodiska systemet som ses här. De representativa grundämnena är de där den särskiljande elektronen går in i ans- eller p-subskalet. De flesta grundämnen vars kemi och valens vi hittills har diskuterat hör till denna kategori. Många av de representativa grundämnenas kemiska egenskaper kan förklaras med hjälp av Lewisdiagram. Det vill säga, de representativa grundämnenas valenser kan förutsägas på grundval av det antal valenselektroner de har, eller utifrån det antal elektroner som skulle behöva läggas till för att uppnå samma elektronkonfiguration som en atom av en ädelgas. För representativa grundämnen är antalet valenceelektroner detsamma som den periodiska gruppens nummer, och det antal som krävs för att matcha nästa ädelgaskonfiguration är 8 minus gruppnumret. Detta stämmer överens med de valensregler som härleds från det periodiska systemet och resulterar i formler för klorider av det första dussinet grundämnen som visar den periodiska variationen av valens.
| Element | Atomvikt | Vätgasföreningar | Syrgasföreningar | Syrgasföreningar | Klorföreningar |
|---|---|---|---|---|---|
| Vätgas | 1.01 | H2 | H2O, H2O2 | HCl | |
| Helium | 4.00 | Inte bildat | Inte bildat | Inte bildat | |
| Litium | 6.94 | LiH | Li2O, Li2O2 | LiCl | |
| Beryllium | 9.01 | BeH2 | BeO | BeCl2 | |
| Boron | 10.81 | B2H6 | B2O3 | BCl3 | |
| Kolmon | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 | |
| Skväve | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 | |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 | |
| Fluor | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 | |
| Neon | 20.18 | Inte bildat | Inte bildat | Inte bildat | |
| Natrium | 22.99 | NaH | Na2O, Na2O2 | NaCl | |
| Magnesium | 24.31 | MgH2 | MgO | MgCl2 |
De tre första horisontella raderna eller perioderna i det moderna periodiska systemet består helt av representativa grundämnen. I den första perioden finns de särskiljande elektronerna för H och He i 1s-subskalet. Genom den andra perioden har Li och Be särskiljande elektroner i 2s-subskalet, och elektroner läggs till 2p-subskalet i atomerna från B till Ne. Under den tredje perioden fylls 3s-subskalet för Na och Mg, och därmed Al, Si, P, S, Cl och Ar. I allmänhet kommer den särskiljande elektronen för de representativa grundämnena att befinna sig i ett ns eller np-underskal. Värdet på n, det huvudsakliga kvantantalet för den särskiljande elektronen, kan snabbt bestämmas genom att räkna nedåt från toppen av det periodiska systemet. Jod är till exempel ett representativt grundämne i den femte perioden. Därför måste den särskiljande elektronen inta antingen 5s eller 5p subshell. Eftersom I finns på den högra sidan av tabellen är 5p det korrekta valet.
När det huvudsakliga kvantantalet är tre eller fler, är även underskal av d-typ möjliga. Övergångsämnena eller övergångsmetallerna är de grundämnen vars särskiljande elektron finns i en d-orbital. De första exemplen på övergångsmetaller (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) återfinns i den fjärde perioden även om den särskiljande elektronen i varje fall är en 3d-elektron och tillhör det tredje skalet. Denna hiatus beror, som vi redan har sett, på att 4s har lägre energi än 3d. 4s orbital börjar alltså fyllas upp och börjar den fjärde perioden innan någon av 3d orbitalerna kan bli ockuperad.
Figur \(\PageIndex{1}\) jämför sannolikhetsfördelningarna för en 4s och en 3d elektron i en V atom. Även om 4s-elektronmolnet i genomsnitt ligger längre från kärnan än 3d-molnet, finns en liten del av 4s-elektrontätheten mycket nära kärnan där den knappt är avskärmad från den totala kärnladdningen +23. Det är den mycket starka attraktionskraften hos denna lilla del av den totala 4s-elektrontätheten som sänker 4s-elektronens energi under 3d-elektronens.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
Det faktum att 4s-elektronmolnet är mer omfattande än 3d-elektronmolnet har ett viktigt inflytande på övergångselementens kemi. När en atom som V (figur \(\PageIndex{1}\) ) interagerar med en annan atom är det 4s elektronerna som sträcker sig längst bort från kärnan som först kommer i kontakt med den andra atomen. Därför är 4s elektronerna ofta viktigare än 3d-elektronerna när det gäller att bestämma valens och formlerna för föreningar. 3d-elektronerna är ”begravda” under ytan på atomerna i övergångsmetallerna. Att lägga till ytterligare en 3d-elektron har betydligt mindre effekt på deras kemiska egenskaper än vad det gjorde att lägga till ytterligare en 3s eller 3p-elektron i fallet med de representativa grundämnena. Därför sker det en långsam men stadig övergång i egenskaperna från ett övergångselement till ett annat. Lägg till exempel märke till att alla övergångsmetaller utom Sc bildar klorider, MCl2, där metallen har valensen 2. Exempel på detta är TiCl2, VCl2, CrCl2 och så vidare. Detta kan ses i tabellen som finns högst upp på denna sida. Valensen 2 motsvarar de två 4s valenselektronerna.
Varje övergångsmetall uppvisar även andra valenser där en eller flera 3d-elektroner också är inblandade. Till exempel har V (vanadin) i vissa föreningar en valens på 2 (VO, VCl2), i andra en valens på 3 (V2O3, VCl3), i ytterligare andra en valens på 4 (VO2, VCl4) och i minst ett fall (V2O5) en valens på 5. Övergångsmetallernas kemi är mer komplicerad och en större variation av formler för övergångsmetallföreningar är möjlig på grund av denna varierande valens. I vissa fall fungerar elektroner i d-underskalet som valenselektroner, medan de i andra fall inte gör det. Även om 3d-elektronmolnen inte sträcker sig längre bort från kärnan än 3s och 3p (och därmed inte utgör ytterligare ett skal som 4selektronerna gör), är de grundligt avskärmade från kärnans laddning och agerar därför ofta som valenceelektroner. Detta Jekyll och Hyde-beteende hos 3d-elektronerna gör livet mer komplicerat (och ofta mycket mer intressant) för kemister som studerar övergångselementen.
| Z | Element | Konfiguration | |
|---|---|---|---|
| 1 | H | 1s 1 | |
| 2 | He | 1s 2 | |
| 3 | Li | 2s 1 | 4 | Be | 2s 2 |
| 5 | B | 2s 2 2p1 | |
| 6 | C | 2s 2 2p2 | |
| 7 | N | 2s 2 2p3 | |
| 8 | 0 | 2s 2 2p4 | |
| 9 | F | 2s 2 2p5 | |
| 10 | Ne | 2s 2 2p6 | |
| 11 | Na | 3s 1 | |
| 12 | Mg | 3s 2 | |
| 13 | Al | 3s 2 3p1 | |
| 14 | Si | 3s 2 3p2 | |
| 15 | P | 3s 2 3p3 | |
| 16 | S | 3s 2 3p4 | |
| 17 | Cl | 3s 2 3p5 | |
| 18 | Ar | 3s 2 3p6 | |
| 19 | K | 4s 1 | |
| 20 | Ca | 4s 2 | 21 | Sc | 3d 1 4s 2 |
| 22 | Ti | 3d 2 4s 2 | |
| 23 | V | 3d 3 4s 2 | |
| 24 | Cr | 3d 5 4s 1 | |
| 25 | Mn | 3d 5 4s 2 | |
| 26 | Fe | 3d 6 4s 2 | |
| 27 | Co | 3d 7 4s 2 | |
| 28 | Ni | 3d 8 4s 2 | |
| 29 | Cu | 3d 10 4s 1 | 30 | Zn | 3d 10 4s 2 |
| 31 | Ga | 3d 10 4s 2 4p 1 | |
| 32 | Ge | 3d 10 4s 2 4p 2 | |
| 33 | As | 3d 10 4s 2 4p 3 | |
| 34 | Se | 3d 10 4s 2 4p 4 | 35 | Br | 3d 10 4s 2 4p 5 |
| 36 | Kr | 3d 10 4s 2 4p 6 | |
| 37 | Rb | 5s 1 | |
| 38 | Sr | 5s 2 | |
| 39 | Y | 4d 1 5s 2 | |
| 40 | Zr | 4d 2 5s 2 | |
| 41 | Nb | 4d 4 5s 1 | |
| 42 | Mo | 4d 5 5s 1 | |
| 43 | Tc | 4d 5 5s 2 | |
| 44 | Ru | 4d 7 5s 1 | |
| 45 | Rh | 4d 8 5s 1 | |
| 46 | Pd | 4d 10 | |
| 47 | Ag | 4d 10 5s 1 | |
| 48 | Cd | 4d 10 5s 2 | |
| 49 | In | 4d 10 5s 2 5p 1 | |
| 50 | Sn | 4d 10 5s 2 5p 2 | |
| 51 | Sb | 4d 10 5s 2 5p 3 | |
| 52 | Te | 4d 10 5s 2 5p 4 | |
| 53 | I | 4d 10 5s 2 5p 5 | |
| 54 | Xe | 4d 10 5s 2 5p 6 | |
| 55 | Cs | 6s 1 | |
| 56 | Ba | 6s 2 | |
| 57 | 57 | La | 5d 1 6s 2 | 58 | Ce | 4f 1 5d 1 6s 2 |
| 59 | Pr | 4f 3 6s 2 | |
| 60 | Nd | 4f 4 6s 2 | |
| 61 | Pm | 4f 5 6s 2 | |
| 62 | Sm | 4f 6 6s 2 | |
| 63 | Eu | 4f 7 6s 2 | |
| 64 | Gd | 4f 7 5d 1 6s 2 | 65 | Tb | 4f 9 6s 2 |
| 66 | Dy | 4f 10 6s 2 | |
| 67 | Ho | 4f 11 6s 2 | |
| 68 | Er | 4f 12 6s 2 | |
| 69 | Tm | 4f 13 6s 2 | |
| 70 | Yb | 4f 14 6s 2 | |
| 71 | Lu | 4f 14 5d 1 6s 2 | 72 | Hf | 4f 14 5d 2 6s 2 |
| 73 | Ta | 4f 14 5d 3 6s 2 | |
| 74 | W | 4f 14 5d 4 6s 2 | |
| 75 | Re | 4f 14 5d 5 6s 2 | |
| 76 | 0s | 4f 14 5d 6 6s 2 | 77 | Ir | 4f 14 5d 7 6s 2 |
| 78 | Pt | 4f 14 5d 9 6s 1 | |
| 79 | Au | 4f 14 5d 10 6s 1 | |
| 80 | Hg | 4f 14 5d 10 6s 2 | |
| 81 | Tl | 4f 14 5d 10 6s 2 6p1 | |
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 | |
| 83 | Bi | 4f 14 5d 10 6s 2 6p 3 | |
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 | |
| 85 | At | 4f 14 5d 10 6s 2 6p 5 | |
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 | |
| 87 | Fr | 7s 1 | |
| 88 | Ra | 7s 2 | |
| 89 | Ac | 6d 1 7s 2 | |
| 90 | Th | 6d 2 7s 2 | |
| 91 | Pa | 5f 2 6d 1 7s 2 | |
| 92 | U | 5f 3 6d 1 7s 2 | |
| 93 | Np | 5f 4 6d 1 7s 2 | |
| 94 | Pu | 5f 6 7s 2 | |
| 95 | Am | 5f 7 7s 2 | |
| 96 | Cm | 5f 7 6d 1 s 2 | |
| 97 | Bk | 5f 9 s 2 | 98 | Cf | 5f 10 s 2 |
| 99 | Es | 5f 11 s 2 | |
| 100 | Fm | 5f 12 s 2 | |
| 101 | Md | 5f 13 s 2 | |
| 102 | No | 5f 14 s 2 | |
| 103 | Lr | 5f 14 6d 1 s 2 | |
| 104 | Rf | 5f 14 6d 2 s 2 |
Den tredje stora kategorin grundämnen uppstår när den särskiljande elektronen upptar ett f-underskal. Det första exemplet förekommer i fallet med lantanoiderna (grundämnen med atomnummer mellan 57 och 71). lantanoiderna har den allmänna elektronkonfigurationen
4d104f i5s25p65d0 eller 16s2
där i är ett tal mellan 0 och 14. I uppbyggnadsprocessen för lantanoiderna läggs alltså elektroner till ett underskal (4f) vars huvudsakliga kvanttal är två mindre än det för den yttersta orbitalen (6s). Tillägg av ytterligare en elektron till ett inre skal som är så djupt nedgrävt som 4f har liten eller ingen effekt på de kemiska egenskaperna hos dessa grundämnen. Alla är ganska lika lantan (La) och skulle kunna passa in på exakt samma plats i det periodiska systemet som La. De lantanoida grundämnena är så lika varandra att det krävs särskilda tekniker för att skilja dem åt. Därför framställdes inte ens ungefärligt rena prover av de flesta av dem förrän på 1870-talet. Efter grundämnet aktinium (Ac) följer en serie atomer där 5f-underskalet är fyllande. Aktinoiderna är något mindre lika Ac än vad lantanoiderna är La eftersom vissa undantag från den vanliga ordningen för fyllningsorbitalerna förekommer i fallet med Th, Pa och U (tabell \(\PageIndex{1}\) ).
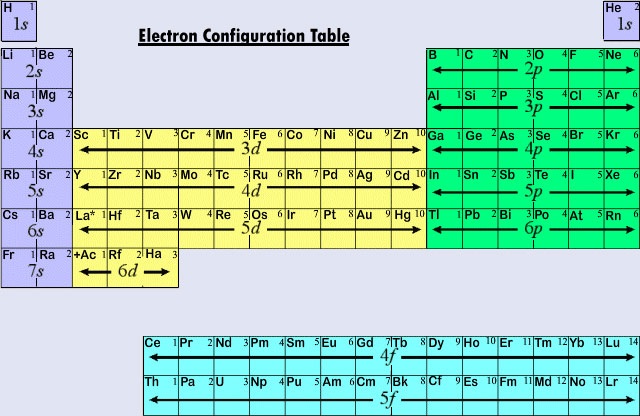
Och eftersom lantanoiderna och de flesta av aktinoiderna uppför sig kemiskt som om de borde passa in i grupp IIIB i det periodiska systemet (där Lu och Lr återfinns), har båda grupperna separerats från resten av tabellen och placerats tillsammans i ett block nedan. Tillsammans kallas lantanoiderna och aktinoiderna för inre övergångselement eftersom de f underskal som fylls ligger så djupt i den återstående elektroniska strukturen hos deras atomer.
Figur \(\PageIndex{2}\) sammanfattar i vilken typ av underskal som den särskiljande elektronen finns för atomer av grundämnen i olika regioner av det periodiska systemet. Denna sammanfattande information gör det relativt enkelt att använda det periodiska systemet för att få fram elektronkonfigurationer, vilket följande exempel visar.
Exempel \(\PageIndex{1}\): Elektronkonfiguration
Få fram elektronkonfigurationen för (a) Nb; (b) Pr.
Lösning
a) Nb, grundämne nummer 41, återfinns i den femte perioden och i ett område av det periodiska systemet där ett d-underskal fyller (den andra övergångsserien). Om man rör sig bakåt (mot lägre atomnummer) genom det periodiska systemet är den närmaste ädelgasen Kr, och därför använder vi Kr-kärnan:
Nb _____
Nästkommande grundämne efter 36K är 37Rb i vilket 5s-subskalet fylls. Om vi flyttar oss till höger ytterligare ett utrymme kommer vi till 38Sr som har ett 5s2-par. Hittills har vi Nb _____ 5s2 för Nb-konfigurationen. Vi flyttar oss nu längre till höger in i 4d-subskalområdet i det periodiska systemet och räknar över tre utrymmen (Y, Zr, Nb) för att nå Nb. Den totala elektronkonfigurationen är alltså Nb 4d35s2 (Observera att det huvudsakliga kvantantalet i d-subskalet är 4 – en mindre än periodens tal. Om man tittar på tabellen över elektronkonfigurationer bör man också notera att Nb är ett undantag från de typiska reglerna för fyllning av orbitalerna) b) Ett liknande förfarande följs för Pr, grundämne nummer 59. Om man går bakåt i tabellen är den närmaste ädelgasen Xe, och därför använder vi Xe-kärnan. Om vi räknar framåt igen motsvarar Cs och Ba 6s2. Därefter motsvarar La, Ce och Pr ytterligare tre elektroner i 4f-subskalet. Konfigurationen är alltså Pr…4f36s2
En punkt till måste betonas om förhållandet mellan elektronkonfiguration och det periodiska systemet. Atomer av grundämnen i samma vertikala kolumn i det periodiska systemet har liknande elektronkonfigurationer. Tänk till exempel på de alkalisk-jordiska grundämnena (grupp IIA). Med hjälp av våra regler för att härleda elektronkonfigurationer (exempel 1) har vi
| Element | Elektronkonfiguration | Lewisdiagram |
|---|---|---|
| Be | 2s2 | Be: |
| Mg | 3s2 | Mg: |
| Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr: |
| Ba | 6s2 | Ba: |
| Ra | 7s2 | Ra: |
Därmed korrelerar de likheter i kemiskt beteende och valens som tidigare noterats för dessa grundämnen med likheterna i deras yttersta elektronmoln. Sådana likheter förklarar framgången för Mendelejevs förutsägelser om egenskaperna hos oupptäckta grundämnen.
Kontributer och tillskrivningar
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff och Adam Hahn.
