Lärandemål
- Beskriv komponenterna som är involverade i en muskelsammandragning
- Förklara hur musklerna drar ihop sig och slappnar av
- Beskriv den glidande filamentmodellen för muskelkontraktion
Händelseförloppet som resulterar i sammandragningen av en enskild muskelfiber börjar med en signal – neurotransmittorn, ACh- från det motorneuron som nerverar den fibern. Fiberns lokala membran kommer att depolarisera när positivt laddade natriumjoner (Na+) tränger in, vilket utlöser en aktionspotential som sprider sig till resten av membranet kommer att depolarisera, inklusive T-tubuli. Detta utlöser frisättning av kalciumjoner (Ca++) från lagringen i det sarkoplasmatiska retikulumet (SR). Ca++ initierar sedan en kontraktion som upprätthålls av ATP (figur 1). Så länge Ca++-jonerna finns kvar i sarkoplasman för att binda till troponin, som håller aktinbindningsställena ”oskyddade”, och så länge ATP finns tillgängligt för att driva korsbrocyklingarna och myosinets dragning av aktinsträngarna, kommer muskelfibern att fortsätta att förkorta sig till en anatomisk gräns.

Figur 1. Kontraktion av en muskelfiber. En tvärbro bildas mellan aktin och myosinhuvudena som utlöser kontraktion. Så länge Ca++-joner finns kvar i sarkoplasman för att binda till troponin och så länge ATP finns tillgängligt fortsätter muskelfibern att förkorta sig.
Muskelkontraktionen upphör vanligtvis när signaleringen från motorneuronen upphör, vilket repolariserar sarkolemma och T-tubuli och stänger de spänningsstyrda kalciumkanalerna i SR. Ca++-joner pumpas sedan tillbaka in i SR, vilket får tropomyosinet att åter skölda (eller åter täcka) bindningsställena på aktinsträngarna. En muskel kan också sluta kontrahera när ATP tar slut och den blir trött (figur 2).

Figur 2. Relaxation av en muskelfiber. Ca++-joner pumpas tillbaka in i SR, vilket får tropomyosinet att åter skölda bindningsställena på aktinsträngarna. En muskel kan också sluta kontrahera när ATP tar slut och den blir trött.
De molekylära händelserna vid förkortning av muskelfibrer sker inom fiberns sarkomerer (se figur 3). Kontraktionen av en strimmad muskelfiber sker när sarkomererna, som är linjärt anordnade inom myofibrillerna, förkortas när myosinhuvudena drar i aktinfilamenten.
Regionen där tjocka och tunna filament överlappar varandra har ett tätt utseende, eftersom det finns lite utrymme mellan filamenten. Detta område där tunna och tjocka filament överlappar varandra är mycket viktigt för muskelkontraktionen, eftersom det är där filamentrörelsen börjar. Tunna filament, som är förankrade i sina ändar av Z-skivorna, sträcker sig inte helt in i det centrala området som endast innehåller tjocka filament, som är förankrade i sina baser vid en punkt som kallas M-linjen. En myofibrill består av många sarkomerer som löper längs dess längd; således drar myofibrillerna och muskelcellerna ihop sig när sarkomererna drar ihop sig.
The Sliding Filament Model of Contraction
När det signaleras av ett motorneuron drar en skelettmuskelfiber ihop sig när de tunna filamenten dras och sedan glider förbi de tjocka filamenten i fiberns sarkomerer. Denna process är känd som den glidande filamentmodellen för muskelkontraktion (figur 3). Glidningen kan endast ske när myosinbindningsställen på aktinfilamenten exponeras genom en serie steg som börjar med att Ca++ tränger in i sarkoplasman.

Figur 3. Modellen med glidande filament för muskelkontraktion. När en sarkomer drar ihop sig flyttas Z-linjerna närmare varandra och I-bandet blir mindre. A-bandet förblir lika brett. Vid full kontraktion överlappar de tunna och tjocka filamenten varandra.
Tropomyosin är ett protein som slingrar sig runt aktinfilamentets kedjor och täcker myosinbindningsställena för att förhindra att aktin binder till myosin. Tropomyosin binder till troponin för att bilda ett troponin-tropomyosinkomplex. Troponin-tropomyosinkomplexet hindrar myosinets ”huvuden” från att binda till de aktiva platserna på aktinmikrofilamenten. Troponin har också en bindningsplats för Ca++-joner.
För att initiera muskelkontraktion måste tropomyosin exponera myosinbindningsstället på en aktinfilament för att möjliggöra korsbrobildning mellan aktin- och myosinmikrofilamenten. Det första steget i kontraktionsprocessen är att Ca++ binder till troponin så att tropomyosin kan glida bort från bindningsställena på aktinsträngarna. Detta gör det möjligt för myosinhuvudena att binda till dessa exponerade bindningsställen och bilda korsbryggor. De tunna filamenten dras sedan av myosinhuvudena för att glida förbi de tjocka filamenten mot sarkomerens centrum. Men varje huvud kan bara dra en mycket kort sträcka innan det har nått sin gräns och måste ”spännas om” innan det kan dra igen, ett steg som kräver ATP.
ATP och muskelkontraktion
För att tunna filament ska kunna fortsätta att glida förbi tjocka filament under muskelkontraktionen måste myosinhuvudena dra i aktinet vid bindningsställena, lossna, spänna om, fästa vid fler bindningsställen, dra, lossna, spänna om, osv. Denna upprepade rörelse kallas korsbrocykeln. Denna rörelse av myosinhuvudena liknar årorna när en person ror en båt: Roddarnas paddel (myosinhuvudena) drar, lyfts upp ur vattnet (lossnar), placeras på nytt (återkopplas) och sänks sedan ner igen för att dra (figur 4). Varje cykel kräver energi, och den åtgärd som myosinhuvudena i sarkomerena utför för att upprepade gånger dra i de tunna filamenten kräver också energi, som tillhandahålls av ATP.
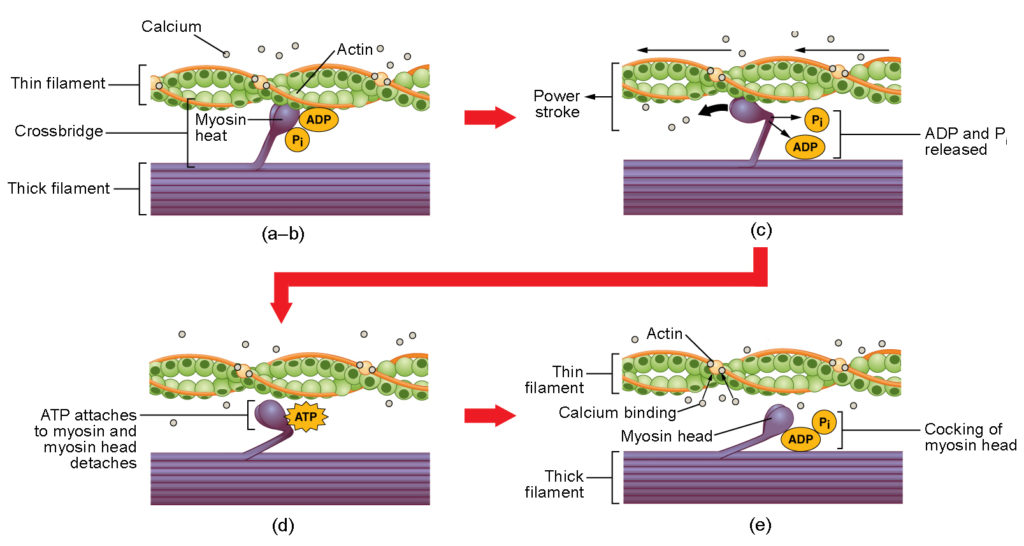
Figur 4. Skelettmuskulaturens kontraktion. (a) Den aktiva platsen på aktin exponeras när kalcium binder till troponin. (b) Myosinhuvudet attraheras av aktin och myosin binder aktin vid sin aktinbindande plats och bildar korsbron. (c) Under kraftslaget frigörs det fosfat som genererades i den föregående kontraktionscykeln. Detta resulterar i att myosinhuvudet svänger mot sarkomerens centrum, varefter den bundna ADP- och fosfatgruppen frigörs. (d) En ny ATP-molekyl fäster vid myosinhuvudet, vilket gör att korsbron lossnar. (e) Myosinhuvudet hydrolyserar ATP till ADP och fosfat, vilket återför myosinet till den spända positionen.
Korsbrobildning sker när myosinhuvudet fäster vid aktinet medan adenosindifosfat (ADP) och oorganiskt fosfat (Pi) fortfarande är bundna till myosinet (figur 4a,b). Pi frigörs sedan, vilket gör att myosinet bildar en starkare fästning vid aktinet, varefter myosinhuvudet rör sig mot M-linjen och drar med sig aktinet. När aktinet dras med rör sig filamenten cirka 10 nm mot M-linjen. Denna rörelse kallas kraftslaget, eftersom rörelsen av den tunna filamenten sker i detta steg (figur 4c). I avsaknad av ATP kommer myosinhuvudet inte att lossna från aktin.
En del av myosinhuvudet fäster vid bindningsstället på aktinet, men huvudet har ett annat bindningsställe för ATP. ATP-bindningen gör att myosinhuvudet lossnar från aktinet (figur 4d). Efter att detta inträffat omvandlas ATP till ADP och Pi av myosinets inneboende ATPasaktivitet. Den energi som frigörs under ATP-hydrolysen förändrar myosinhuvudets vinkel till ett spänt läge (figur 4e). Myosinhuvudet är nu i position för ytterligare rörelse.
När myosinhuvudet är spänt befinner sig myosin i en energirik konfiguration. Denna energi förbrukas när myosinhuvudet rör sig genom kraftslaget, och i slutet av kraftslaget befinner sig myosinhuvudet i ett lågenergiläge. Efter kraftslaget frigörs ADP, men den bildade korsbryggan är fortfarande på plats och aktin och myosin är bundna till varandra. Så länge ATP finns tillgängligt fäster det lätt vid myosin, tvärbrocykeln kan återkomma och muskelkontraktionen kan fortsätta.
Bemärk att varje tjock filament av ungefär 300 myosinmolekyler har flera myosinhuvuden, och många tvärbroar bildas och bryts kontinuerligt under muskelkontraktionen. Multiplicera detta med alla sarkomerer i en myofibrill, alla myofibriller i en muskelfiber och alla muskelfibrer i en skelettmuskel, och du kan förstå varför det behövs så mycket energi (ATP) för att hålla skelettmusklerna igång. Det är faktiskt förlusten av ATP som leder till den rigor mortis som observeras strax efter att någon dör. Eftersom ingen ytterligare ATP-produktion är möjlig finns det ingen ATP tillgänglig för myosinhuvudena att lossna från aktinbindningsställena, så korsbryggorna förblir på plats, vilket orsakar stelheten i skelettmuskulaturen.
Källor till ATP
ATP levererar energin för att muskelsammandragning ska kunna äga rum. Förutom sin direkta roll i korsbrocykeln ger ATP också energi till Ca++-pumparna med aktiv transport i SR. Muskelkontraktion sker inte utan tillräckliga mängder ATP. Mängden ATP som lagras i muskeln är mycket liten och räcker bara till för att driva några sekunders sammandragningar. Eftersom ATP bryts ner måste det därför regenereras och ersättas snabbt för att möjliggöra en långvarig sammandragning. Det finns tre mekanismer genom vilka ATP kan regenereras: kreatinfosfatmetabolism, anaerob glykolys, fermentation och aerob andning.
Kreatinfosfat är en molekyl som kan lagra energi i sina fosfatbindningar. I en vilande muskel överför överskott av ATP sin energi till kreatin och producerar ADP och kreatinfosfat. Detta fungerar som en energireserv som kan användas för att snabbt skapa mer ATP. När muskeln börjar dra ihop sig och behöver energi överför kreatinfosfat sitt fosfat tillbaka till ADP för att bilda ATP och kreatin. Denna reaktion katalyseras av enzymet kreatinkinas och sker mycket snabbt, vilket innebär att ATP från kreatinfosfat ger kraft åt de första sekunderna av muskelkontraktionen. Kreatinfosfat kan dock bara ge energi i ungefär 15 sekunder, varefter en annan energikälla måste användas (figur 5).

Figur 5. Muskelmetabolism. En del ATP lagras i en vilande muskel. När kontraktionen börjar förbrukas det på några sekunder. Mer ATP genereras från kreatinfosfat i cirka 15 sekunder.
När det ATP som produceras av kreatinfosfat är uttömt övergår musklerna till glykolys som ATP-källa. Glykolysen är en anaerob (icke syreberoende) process som bryter ner glukos (socker) för att producera ATP. glykolysen kan dock inte generera ATP lika snabbt som kreatinfosfat. Övergången till glykolysen resulterar därför i en långsammare ATP-tillgång för muskeln. Det socker som används i glykolysen kan komma från blodglukos eller genom att metabolisera glykogen som lagras i muskeln. Vid nedbrytningen av en glukosmolekyl bildas två ATP och två molekyler pyruvsyra, som kan användas i aerob andning eller när syrehalten är låg omvandlas till mjölksyra (figur 6).

Figur 6. Glykolys och aerob andning. Varje glukosmolekyl producerar två ATP och två molekyler pyruvsyra, som kan användas i aerob respiration eller omvandlas till mjölksyra. Om syre saknas omvandlas pyruvsyra till mjölksyra, vilket kan bidra till muskeltrötthet. Detta inträffar under ansträngande träning när stora mängder energi behövs men syre inte kan levereras tillräckligt till musklerna.
Om syre finns tillgängligt används pyruvsyra i aerob andning. Om syre inte finns tillgängligt omvandlas dock pyrubrinsyra till mjölksyra, vilket kan bidra till muskeltrötthet. Denna omvandling möjliggör återvinning av enzymet NAD+ från NADH, vilket behövs för att glykolysen ska kunna fortsätta. Detta inträffar under ansträngande träning när stora mängder energi behövs men syre inte kan tillföras musklerna i tillräcklig utsträckning. Glykolysen i sig kan inte upprätthållas särskilt länge (cirka 1 minuts muskelaktivitet), men den är användbar för att underlätta korta utbrott med hög intensitet. Detta beror på att glykolysen inte utnyttjar glukos särskilt effektivt och ger en nettovinst på två ATP per glukosmolekyl och slutprodukten mjölksyra, som kan bidra till muskeltrötthet när den ackumuleras.
Aerob andning är nedbrytningen av glukos eller andra näringsämnen i närvaro av syre (O2) för att producera koldioxid, vatten och ATP. Ungefär 95 procent av den ATP som krävs för vilande eller måttligt aktiva muskler tillhandahålls av aerob andning, som sker i mitokondrier. Insatserna för aerob andning omfattar glukos som cirkulerar i blodomloppet, pyrubrinsyra och fettsyror. Aerob andning är mycket effektivare än anaerob glykolys och producerar cirka 36 ATP per glukosmolekyl jämfört med fyra från glykolysen. Den aeroba andningen kan dock inte upprätthållas utan en stadig tillförsel av O2 till skelettmuskeln och är mycket långsammare (figur 7). För att kompensera detta lagrar musklerna en liten mängd överskott av syre i proteiner som kallas myoglobin, vilket ger effektivare muskelkontraktioner och mindre trötthet. Aerob träning ökar också cirkulationssystemets effektivitet så att O2 kan tillföras musklerna under längre perioder.

Figur 7. Cellulär andning. Aerob andning är nedbrytningen av glukos i närvaro av syre (O2) för att producera koldioxid, vatten och ATP. Ungefär 95 procent av den ATP som krävs för vilande eller måttligt aktiva muskler tillhandahålls av aerob andning, som sker i mitokondrier.
Muskeltrötthet uppstår när en muskel inte längre kan dra ihop sig som svar på signaler från nervsystemet. De exakta orsakerna till muskeltrötthet är inte helt kända, även om vissa faktorer har korrelerats med den minskade muskelkontraktion som sker vid trötthet. ATP behövs för normal muskelsammandragning, och när ATP-reserverna minskar kan muskelfunktionen försämras. Detta kan vara en större faktor vid korta, intensiva muskelprestationer än vid långvariga ansträngningar med lägre intensitet. Uppbyggnad av mjölksyra kan sänka det intracellulära pH-värdet, vilket påverkar enzym- och proteinaktiviteten. Obalans i Na+- och K+-nivåerna till följd av membrandepolarisering kan störa Ca++-flödet ut ur SR. Långa perioder av ihållande träning kan skada SR och sarkolemma, vilket resulterar i försämrad Ca++-reglering.
Intensiv muskelaktivitet resulterar i en syrgasskuld, vilket är den mängd syre som behövs för att kompensera för ATP som produceras utan syre under muskelkontraktionen. Syre behövs för att återställa ATP- och kreatinfosfatnivåerna, omvandla mjölksyra till pyruvsyra och, i levern, för att omvandla mjölksyra till glukos eller glykogen. Andra system som används under träning kräver också syre, och alla dessa kombinerade processer resulterar i den ökade andningsfrekvens som uppstår efter träning. Tills syrgasskulden har uppfyllts är syreintaget förhöjt, även efter att träningen har upphört.
Relaxering av en skelettmuskel
Relaxering av skelettmuskelfibrer, och i slutändan skelettmuskeln, börjar med motorneuronet, som slutar att släppa ut sin kemiska signal, ACh, i synapsen vid NMJ. Muskelfibrerna repolariseras, vilket stänger portarna i SR där Ca++ frigjordes. ATP-drivna pumpar flyttar Ca++ från sarkoplasman tillbaka till SR. Detta leder till att aktinbindningsställena på de tunna filamenten ”återförsäkras”. Utan förmågan att bilda korsbryggor mellan de tunna och tjocka filamenten förlorar muskelfibern sin spänning och slappnar av.
Muskelstyrka
Antalet skelettmuskelfibrer i en viss muskel är genetiskt bestämt och förändras inte. Muskelstyrkan är direkt relaterad till mängden myofibriller och sarkomerer i varje fiber. Faktorer, såsom hormoner och stress (och konstgjorda anabola steroider), som verkar på muskeln kan öka produktionen av sarkomerer och myofibriller inom muskelfibrerna, en förändring som kallas hypertrofi, vilket resulterar i ökad massa och bulk i en skelettmuskel. På samma sätt resulterar minskad användning av en skelettmuskel i atrofi, där antalet sarkomerer och myofibriller försvinner (men inte antalet muskelfibrer). Det är vanligt att en gipsad lem visar förtvinade muskler när gipset tas bort, och vissa sjukdomar, som polio, visar förtvinade muskler.
Sjukdomar i muskelsystemet
Duchenne muskeldystrofi (DMD) är en progressiv försvagning av skelettmuskulaturen. Det är en av flera sjukdomar som tillsammans kallas ”muskeldystrofi”. DMD orsakas av en brist på proteinet dystrofin, som hjälper de tunna filamenten i myofibrillerna att binda till sarkolemman. Utan tillräckligt med dystrofin leder muskelsammandragningar till att sarkolemman slits sönder, vilket orsakar ett inflöde av Ca++ och leder till cellskador och nedbrytning av muskelfibrerna. Med tiden, när muskelskadorna ackumuleras, förloras muskelmassa och större funktionsnedsättningar utvecklas.
DMD är en ärftlig sjukdom som orsakas av en onormal X-kromosom. Den drabbar främst män och diagnostiseras vanligen i tidig barndom. DMD visar sig vanligtvis först som svårigheter med balans och rörelse och utvecklas sedan till en oförmåga att gå. Det fortsätter att utvecklas uppåt i kroppen från de nedre extremiteterna till överkroppen, där det påverkar de muskler som ansvarar för andning och cirkulation. I slutändan leder det till döden på grund av andningssvikt, och de drabbade lever vanligtvis inte längre än till 20-årsåldern.
Då DMD orsakas av en mutation i genen som kodar för dystrofin trodde man att införandet av friska myoblaster hos patienterna skulle kunna vara en effektiv behandling. Myoblaster är de embryonala celler som ansvarar för muskelutvecklingen, och i idealfallet skulle de bära friska gener som kunde producera det dystrofin som behövs för normal muskelsammandragning. Detta tillvägagångssätt har i stort sett misslyckats hos människor. Ett nytt tillvägagångssätt har bestått i att försöka öka muskelns produktion av utrofin, ett protein som liknar dystrofin och som kanske kan ta över dystrofins roll och förhindra att cellskador uppstår.
Självkontrollfrågor
Tävla nedanstående frågesport för att kontrollera din förståelse av Muskelfibrernas sammandragning och avslappning:
