A: AMINO ACIDS
BIOCHEMISTRY – DR. JAKUBOWSKI
Senaste uppdatering: 02/27/16
Lärandemål/mål för kapitel 2A: Efter lektionen och denna läsning kommer eleverna att kunna
- uppge laddningen på aminosyrans sidokedjor med hjälp av Henderson Hasselbach-ekvationen och den ungefärliga laddningen genom inspektion vid ett givet pH
- rita mekanismer och identifiera produkter för reaktionen av nukleofila sidokedjor Lys och Cys med vanliga kemiska modifikationsmedel och utvidga denna förståelse till reaktioner av His.
- ritar mekanismer för disulfidutbytesreaktioner för sulfhydryls och använder dem och oxidationstal för att förklara redoxreaktioner av cystein/cystin.
A7. Cystinkemi
Två cystein-sidokedjor kan interagera kovalent i ett protein för att producera en disulfid. Precis som HOOH (väteperoxid) är mer oxiderad än HOH (O i H2O2 har oxidationstalet 1- medan O i H2O har oxidationstalet 2-) är RSSR den oxiderade formen (S-oxidationstal 1-) och RSH den reducerade formen (S-oxidationstal 2-) av tioler. Deras oxidationstal är analoga eftersom O och S båda ingår i grupp 6 i det periodiska systemet och båda är mer elektronegativa än C.
En snabb genomgång av redoxreaktioner och oxidationstal.
Figur: DISULFID – CYSTIN – REAKTIONER
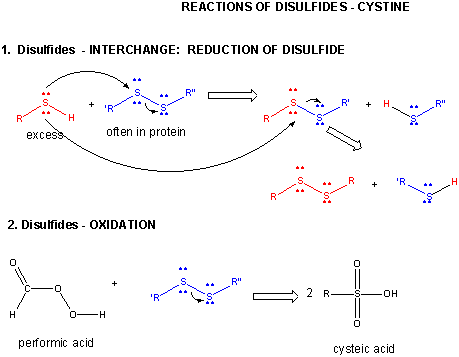
När ett protein veckas kan två Cys-sidokedjor närma sig varandra och bilda en disulfidbindning inom kedjan. På samma sätt kan två Cys-sidokedjor på separata proteiner närma sig varandra och bilda en disulfidbindning mellan kedjorna. Sådana disulfider måste klyvas och kedjorna separeras innan man kan analysera proteinets sekvens. Disulfiden i proteinet kan klyvas med hjälp av reduktionsmedel som beta-mercaptoetanol, ditiotreitol, tris(2-carboxyetyl)fosfin (TCEP) eller oxiderande medel som ytterligare oxiderar disulfiden till separata cysteinsyror.
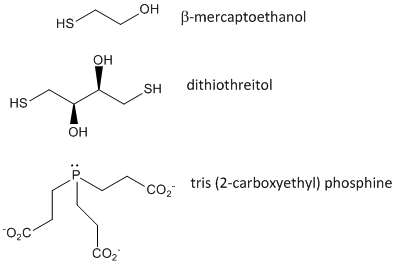
Figur: Disulfidoxiderande medel – b-mercaptoetanol, dithiothreitol och fosfiner
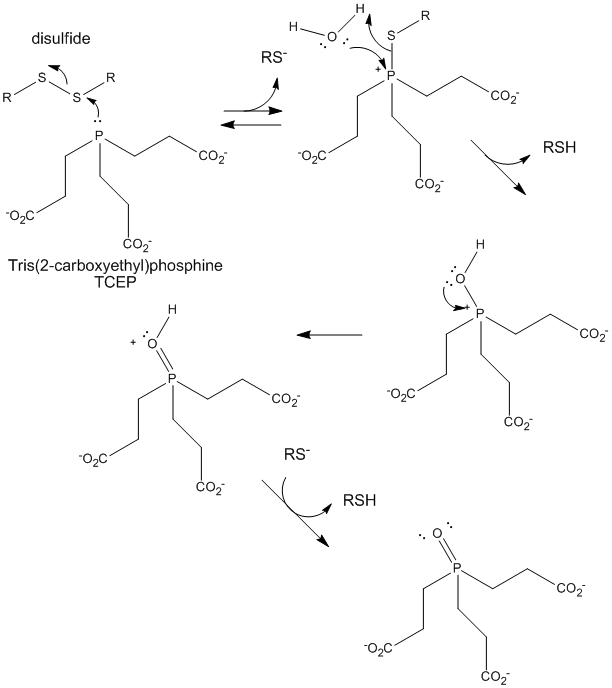
Figur: TCEP-reduktion av disulfider
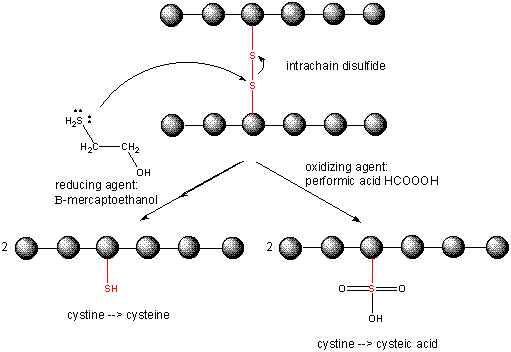
Cellernas insida hålls i en reducerad miljö genom närvaron av många ”reducerande” medel, såsom tripeptiden g-glu-cys-gly (glutathion). Därför innehåller intracellulära proteiner vanligen inte disulfider, som är rikligt förekommande i extracellulära proteiner (t.ex. de som finns i blodet) eller i vissa organeller, t.ex. det endoplasmatiska retikulumet och det mitokondriella intermembranutrymmet, där disulfiderc kan introduceras.
Figur:
Lösning av disulfidbindningar i proteiner
Cysteinets redoxkemi
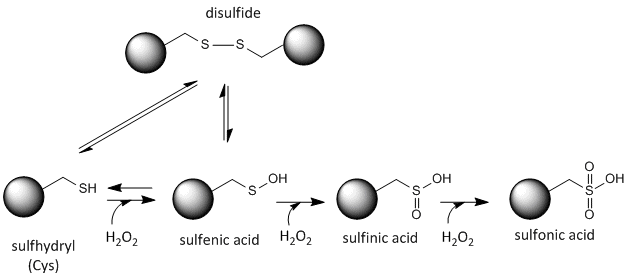
Svavlet i cystein är redoxaktivt och kan därför existera i en mängd olika tillstånd, beroende på den lokala redoxmiljön och närvaron av oxiderande och reducerande ämnen. Ett potent oxidationsmedel som kan tillverkas i celler är väteperoxid, vilket kan leda till mer drastiska och irreversibla kemiska modifieringar av Cys-sidekedjorna. Om ett reaktivt Cys är viktigt för proteinets funktion kan proteinets funktion moduleras (ibland reversibelt, ibland irreversibelt) med olika oxidationsmedel, vilket visas i figuren nedan.
Figur:Redoxtillstånd för cystein
Navigation
Return toChapter 2A: Amino Acid Sections
Return toBiochemistry Online Table of Contents
Archiverad version av helaChapter 2A: Amino Acids
