 Open Access Article
Open Access Article Denna Open Access Article är licensierad under en
Denna Open Access Article är licensierad under en
Creative Commons Attribution 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc och Lei Tao *a
*a
aNyckellaboratorium för biologisk organisk fosforkemi & Kemisk biologi (Utbildningsdepartementet), Kemiavdelningen, Tsinghua University, Beijing 100084, Kina. E-post: [email protected]
bThe State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, P. R. China
College of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. China
College of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. China China
dCancer Institute & Hospital, Peking Union Medical College & Chinese Academy of Medical Science, Beijing 100021, P. R. China
Först publicerat den 27 mars 2017
Polyetylenglykol (PEG)-derivat har använts i stor utsträckning inom biorelaterad forskning. PEG-oligomerer (med olika molekylvikter) eller PEG-baserade monomerer (med olika kedjeändgrupper) har dock faktiskt olika kemiska och fysiska egenskaper, vilket kan leda till potentiell toxicitet. I detta arbete har cytotoxiciteten hos en serie PEG-derivat (oligomerer och monomerer) mätts med hjälp av mänskliga livmoderhalscancerceller (HeLa) och en cellinje av fibroblaster från möss (L929) som modellceller. De flesta PEG-oligomerer är säkra för båda typerna av celler utom trietylenglykol (TEG), som i höga koncentrationer är giftigt för L929-celler. Å andra sidan visade PEG-baserade monomerer, inklusive poly(etylenglykol)metyleterakrylat (mPEGA) och poly(etylenglykol)metyletermetakrylat (mPEGMA), uppenbar cytotoxicitet. Därefter har dessa giftiga PEG-derivat studerats för att avslöja de olika mekanismerna bakom deras toxicitet. Denna aktuella forskning utvärderade PEG-derivatens cytotoxicitet och pekade på den potentiella faran med ”säkra” biomaterial, vilket kan erbjuda en användbar referens för människor som vill använda PEG-derivaten i framtida biomedicinsk forskning.
Introduktion
Polyetylenglykol (PEG) har tillämpats i stor utsträckning inom olika medicinska områden på grund av dess enastående egenskaper, t.ex. tillfredsställande säkerhet, biokompatibilitet, hydrofilicitet osv. PEG har till exempel använts i vissa av Food and Drug Administration godkända laxermedel på grund av dess utmärkta fukthållande och smörjförmåga.1-3 Ett annat exempel är att modifiering av läkemedel/proteiner med PEG (PEGylering) effektivt kan förbättra deras vattenlöslighet och cirkulationshalveringstid för läkemedel4,5 , vilket resulterar i ökad säkerhet och behandlingseffekter. PEGylering är faktiskt på väg att bli en av de mest attraktiva bioteknologierna och har nått stora framgångar inom grundforskningen och på marknaden.6-11 Vid det här laget har många PEG-derivat använts som utmärkta utgångsmaterial för att syntetisera ett antal nya polymera material för biotillämpningar.12 Till exempel har en linjär PEG modifierats som en difunktionaliserad PEG (DF-PEG), som skulle kunna användas för att snabbt generera en intressant självläkande hydrogel.13,14 Vissa PEG-oligomerer har använts för att modifiera ytan på oorganiska nanopartiklar för att förbättra vattenlösligheten och minska toxiciteten hos dessa oorganiska material.15-17 Vissa kommersiella PEG-baserade monomerer såsom poly(etylenglykol)metyleterakrylat (mPEGA) och poly(etylenglykol)metyletermetakrylat (mPEGMA) har använts för att framställa förgrenade polymerer för efterföljande proteinkonjugering, självmontering, läkemedelstillförsel etc.18-27
Och även om PEG normalt sett betraktas som nästan icke-toxiskt har forskare noterat vissa osäkra problem med PEG med låga molekylvikter. Smyth et al. rapporterade kronisk oral toxicitet av PEG-oligomer (Mn ∼ 200) hos råttor,28,29 negativa resultat har också observerats hos apor,30 vilket tyder på potentiella säkerhetsproblem med dessa ”säkra” material. Med tanke på den breda användningen av PEG-derivat inom forskningsområden är därför en systematisk cytotoxicitetsstudie av dessa PEG-oligomerer och PEG-baserade monomerer nödvändig och viktig för deras fortsatta användning inom biorelaterade områden (schema 1).
I det aktuella arbetet utvärderades cytotoxiciteten hos vissa PEG-oligomerer (med olika molekylvikter) och kommersiella PEG-baserade monomerer (med olika kedjeändgrupper) för humana livmoderhalscancerceller (HeLa) och en cellinje av fibroblast som härstammar från möss (L929). Den molekylviktberoende cytotoxiciteten hos PEG-oligomerer har observerats, och de olika cytotoxicitetsmekanismerna hos PEG-oligomerer och PEG-baserade monomerer avslöjades för första gången. Denna cytotoxicitetsinformation om PEG-derivat kan vara värdefulla referenser för människor som väljer PEG som utgångsmaterial och utformar reningsvägar för att framställa biokompatibla PEG-baserade material för ytterligare biomedicinska tillämpningar.
Material och metoder
2.1 Kemikalier
Trietylenglykol (TEG, 97 %, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), poly(etylenglykol)metyleterakrylat 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), poly(etylenglykol)metyletermetakrylat 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) och poly(etylenglykol)metyletermetakrylat 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) användes direkt utan ytterligare rening.
Humana livmoderhalscancerceller (HeLa) och en cellinje av fibroblaster från möss (L929) förvärvades från American type culture collection (ATCC). Dulbecco’s modified eagle medium (DMEM, Corning-Cellgro), fosfatbuffrad saltlösning (PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), serum från fetalt nötkreatur (FBS, Gibco), Roswell Park Memorial Institute 1640 kulturmedium (RPMI 1640 kulturmedium, Gibco), penicillin-streptomycinlösning (Gibco), trypsin-EDTA (Gibco, 0.25 %), 4-(3-(2-metoxi-4-nitrofenyl)-2-(4-nitrofenyl)-2H-tetrazol-3-ium-5-yl)bensen-1,3-disulfonat (CCK-8, Beyotime), 2,7-diklordihydrofluoresceindiacetat (DCFH-DA, Beyotime), oxiderad glutation (GSSG, Beyotime), nicotinamide adenin dinukleotidfosfat (NADPH, Beyotime), 5,5′-dithiobis-(2-nitrobenzoesyra) (DTNB, Beyotime), fluoresceindiacetat (FDA, Sigma) och propidiumjodid (PI, 94 %, Sigma) användes som inköpta.
2.2 Cellkultur
Cellkulturen upprätthölls i en 37 °C inkubator med 5 % CO2, odlingsmediet byttes varannan eller varannan dag för att upprätthålla cellernas exponentiella tillväxt. HeLa-cellerna härstammade från livmoderhalscancerceller och odlades i DMEM-medium kompletterat med 10 % fetalt bovint serum (FBS) och 1 % penicillin och streptomycin. L929-celler härrörde från möss och odlades i RPMI 1640-medium kompletterat med 10 % fetalt bovint serum (FBS) och 1 % penicillin och streptomycin.
2.3 Analys av cytotoxicitet
Resultaten presenterades som medelvärde ± standardavvikelse (SD), och de halva maximala hämmande koncentrationerna 50% (IC50) för PEG-derivaten beräknades med SPSS 15.0.
I enlighet med vårt tidigare arbete32,33 kunde fluoresceindiacetat (FDA) och propidiumjodid (PI) användas som en snabb och bekväm dubbelfärgningsmetod för att observera cellviabiliteten. L929-celler såddes i en 24-hålsplatta med en densitet på ∼5 × 104 celler per mL. Efter fastsättning tvättades cellerna med PBS och odlades med olika koncentrationer av PEG-derivat i odlingsmedium i 24 timmar. En blandad lösning av PBS-FDA-PI (FDA: 3 μg mL-1; PI: 3 μg mL-1) tillsattes därefter och 24-hålsplattan inkuberades vid 37 °C i 15 minuter. Ett fluorescensmikroskop (Leica Germany) användes för att observera de levande och döda cellerna under 450-490 nm respektive 515-560 nm bandpass excitationsfilter (I3 och N2.1) (100 W kvicksilverlampa).
Kortfattat: L929-celler såddes i en 24-hålsplatta och inkuberades i 0,5 ml kulturmedium med olika koncentrationer av TEG (A, A′) i 1 timme (fig. 1), A1-A6 brunnar användes för att mäta den totala mängden glutation (GSH + GSSG) medan A′1-A′6 brunnar användes för att mäta mängden oxiderad glutation (GSSG) i närvaro av TEG. Efter 1 timme samlades cellerna upp genom trypsinspjälkning och centrifugering (1000 rpm, 5 min). Därefter tillsattes tredubbla volymen proteinborttagningslösning (50 mg mL-1) för att avlägsna de brusande proteinerna. Efter tre snabba frysnings- och upptiningscykler i flytande kväve och ett vattenbad vid 37 °C placerades suspensionen i ett kylskåp (4 °C) i 5 minuter, och proverna av cellsupernatanten erhölls efter centrifugering (10 000 rpm, 10 min). Prover från brunnarna A1-A6 användes för att mäta den totala glutationen (GSH + GSSG). NADPH-lösning (0,5 mg mL-1) tillsattes för att reducera all glutathion till GSH, därefter användes 5,5′-dithiobis-(2-nitrobenzoesyra) (DTNB) för att oxidera GSH, den förändrade absorbansen vid 405 nm registrerades med en mikroplattläsare (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Prover från A′1-A′6-brunnar användes för att mäta nivån av oxiderat glutation (GSSG). Genom att använda GSH-removerlösningen lämnades endast GSSG kvar i provlösningen. Proverna analyserades med samma metod som ovan för att mäta GSSG-nivån. Den totala mängden glutation och mängden oxiderad glutation samlades in för att beräkna nivån av reducerad glutation medan GSH-nivån hos celler i rent odlingsmedium användes som kontroll. Resultaten presenterades som medelvärde ± SD.
000 rpm, 10 min). Prover från brunnarna A1-A6 användes för att mäta den totala glutationen (GSH + GSSG). NADPH-lösning (0,5 mg mL-1) tillsattes för att reducera all glutathion till GSH, därefter användes 5,5′-dithiobis-(2-nitrobenzoesyra) (DTNB) för att oxidera GSH, den förändrade absorbansen vid 405 nm registrerades med en mikroplattläsare (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Prover från A′1-A′6-brunnar användes för att mäta nivån av oxiderat glutation (GSSG). Genom att använda GSH-removerlösningen lämnades endast GSSG kvar i provlösningen. Proverna analyserades med samma metod som ovan för att mäta GSSG-nivån. Den totala mängden glutation och mängden oxiderad glutation samlades in för att beräkna nivån av reducerad glutation medan GSH-nivån hos celler i rent odlingsmedium användes som kontroll. Resultaten presenterades som medelvärde ± SD.
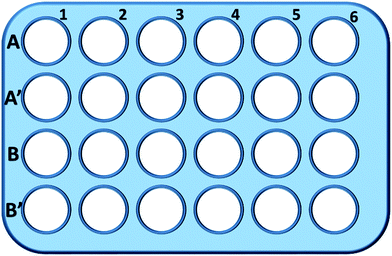
Vällar i linje B och B′ användes för att testa den totala mängden GSH respektive GSSG i närvaro av mPEGA-480 genom samma förfarande.
Resultat och diskussion
3.1 Cellviabilitetsstudie
När HeLa-cellen (en modell för cancerceller) användes (fig. 2A) kunde cytotoxiciteten hos alla PEG-oligomerer vid låga koncentrationer (≤5 mg mL-1) försummas. Med ökad koncentration (≥10 mg mL-1) observerades den molekylviktberoende cytotoxiciteten hos PEG-proverna. Trietylenglykol (TEG) visade uppenbar cytotoxicitet över 10 mg mL-1 (p < 0,05; kontrast till alla andra oligomerer när koncentrationen är över 5 mg mL-1) och IC50-värdet för TEG för HeLa-celler beräknades till 19,8 mg mL-1. Samtidigt visade andra PEG-oligomerer (Mn ∼ 400-4000) också liten cytotoxicitet.
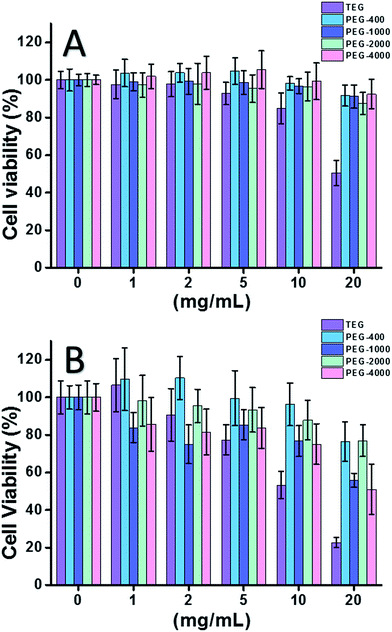
Cytotoxiciteten hos PEG-oligomerer för L929-celler (en modell för normala celler) utvärderades också (fig. 2B). Som förväntat minskade cellens livsduglighet med ökad PEG-koncentration. Förutom TEG visade vissa PEG-oligomerer (PEG-1000, PEG-4000) som är säkra för HeLa-celler också påvisbar cytotoxicitet. IC50-värdena för TEG, PEG-1000 och PEG-4000 beräknades till 12,4, 22,5 respektive 20,0 mg mL-1 för L929-celler, vilket också visar att PEG-oligomererna har en molekylviktberoende cytotoxicitet.
Ovanstående resultat tyder på att HeLa-celler har bättre tolerans mot PEG-oligomerer än L929-celler på grund av cancercellernas ihärdiga vitalitet, och TEG har mycket högre cytotoxicitet än andra PEG-oligomerer med högre molekylvikt (p < 0,05; kontrast till alla andra oligomerer när koncentrationen är över 5 mg mL-1). Den aktuella forskningen har visat att PEG-1000 och PEG-4000 är måttligt cytotoxiska för L929-celler och att PEG-400 och PEG-2000 nästan inte är cytotoxiska, vilket skiljer sig från den allmänna uppfattningen att PEG med hög molekylvikt skulle vara mer biokompatibla än deras motsvarigheter med låg molekylvikt. Även om orsaken till PEG:s cytotoxicitet fortfarande inte är klar, verkar PEG-400 och PEG-2000 vara bättre val för människor som vill syntetisera biokompatibla material.
När mPEGMA-500 testades minskade cellviabiliteten hos både HeLa-celler och L929-celler med ökad koncentration av mPEGMA-500 (Fig. 3A), och ingen uppenbar skillnad mellan två typer av celler observerades. IC50-värdena för mPEGMA-500 är 4,7 mg mL-1 för HeLa-celler och 5,3 mg mL-1 för L929-celler efter 24 timmars odling, vilket indikerar en mer betydande cytotoxicitet hos mPEGMA-500 än ovannämnda PEG-oligomerer, och antyder att kedjeändgrupperna hos PEG-derivaten är avgörande för deras toxicitet. När mPEGMA-950, ett annat PEG-baserat metakrylat med samma kedjeändgrupp men högre molekylvikt, testades genom samma procedur (fig. 3B), observerades en mycket lägre cytotoxicitet hos mPEGMA-950 för HeLa-celler eller L929-celler (p < 0,05; när koncentrationen är över 2 mg mL-1), IC50-värdena för mPEGMA-950 är 20,8 mg mL-1 för HeLa-celler, och 21.7 mg mL-1 för L929-celler efter 24 timmars odling, vilket också visar den molekylviktberoende cytotoxiciteten hos PEG-baserat metakrylat.
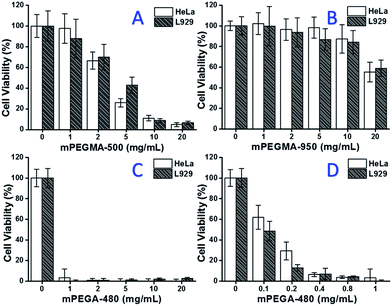
Det PEG-baserade akrylatet mPEGA-480 testades också. Även om skillnaden mellan mPEGA-480 och mPEGMA-500 endast är en metylgrupp i kedjeändan visade mPEGA-480 akut cytotoxicitet (fig. 3C). Mer än 95 % av cellerna förlorade sin livskraft även med 1 mg mL-1 mPEGA-480 i kulturmediet. Därför måste ytterligare experiment utföras med lägre koncentrationer för att fastställa dess cytotoxicitet (fig. 3D), och IC50-värdena för mPEGA-480 beräknades till 0,2 mg mL-1 för HeLa-celler och 0,1 mg mL-1 för L929-celler efter 24 timmars odling.
Cellviabilitetsförsöken bekräftade att både kedjeändgrupper och molekylvikt är viktiga påverkanselement för PEG-derivatens cytotoxicitet, och de PEG-baserade monomererna uppvisade en mycket mer påtaglig cytotoxicitet jämfört med PEG-oligomerer.
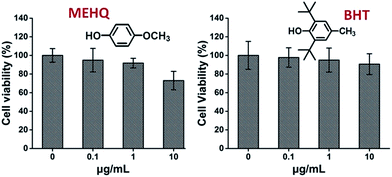
Men samtidigt utvärderades också cytotoxiciteten hos inhibitorer i PEG-baserade monomerer, hydrokinonmetyleter (MEHQ, 100 ppm i mPEGA) och butylerad hydroxytoluen (BHT, 300 ppm i mPEGMA) (Fig. 4), och L929-cellerna behöll en hög livskraft (≥90 %) vid lågkoncentrerade inhibitorer (≤1 μg mL-1). Det finns 0,1 μg mL-1 MEHQ i 1 mg mL-1 mPEGA-480 och 3 μg mL-1 BHT i 10 mg mL-1 mPEGA-500, medan mPEG-480 och mPEGMA-500 visade uppenbar cytotoxicitet vid dessa koncentrationer. Spårmängden hämmare i PEG-baserade monomerer verkar alltså ha en försumbar inverkan på monomerernas cytotoxicitet.
3.2 Observation av cellmorfologi
Observation med optiskt mikroskop användes för att direkt utvärdera cytotoxiciteten hos PEG-derivat för L929-celler. De optiska bilderna av L929-celler som exponerades för 20 mg mL-1 TEG och 0,1 mg mL-1 mPEGA under 24 timmar visas i figur 5A respektive B.
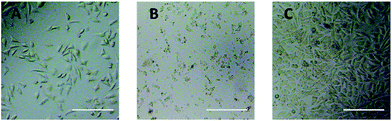
Efter inkubation med 20 mg mL-1 TEG i 24 timmar behöll cellerna en liknande morfologi (fig. 5A) som kontrollgruppen (fig. 5C, celler i rent odlingsmedium), men cellantalet minskade dramatiskt, vilket tyder på cytotoxiciteten hos TEG i hög koncentration, vilket ledde till att cellerna dog och därefter lossnade från mikroplattans botten. Fig. 5B visade morfologin hos L929-celler efter inkubation med 0,1 mg mL-1 mPEGA-480. Nästan alla celler förlorade sin normala morfologi, vilket tyder på den akuta cytotoxiciteten hos mPEGA-480 även vid en så låg koncentration.
Dessutom färgades cellerna också med fluorescein. FDA/PI dubbelfärgning är ett snabbt, enkelt och samtidigt förfarande för att observera levande och döda celler.43 FDA kan tränga in i hela celler och ackumuleras i cellerna, därför är ett komplett cellmembran nödvändigt för att förhindra att fluorescein läcker ut från cellen. PI kan däremot inte passera genom det intakta cellmembranet, men kan färga kärnan i döda celler genom att passera genom det skadade cellmembranet. Som framgår av fig. 6 har L929-celler som inkuberats med 20 mg mL-1 TEG mindre livskraftiga celler efter FDA-färgning (fig. 6b) jämfört med kontrollen (fig. 6a), och fler döda celler kan observeras efter PI-färgning (fig. 6b). 6b′), vilket är identiskt med resultatet av observation genom optisk mikroskopi. mPEGA-480:s akuta cytotoxicitet observerades också efter FDA/PI dubbelfärgning, ingen grön signal kunde identifieras efter inkubation av celler med 0,1 mg mL-1 mPEG-480 i 24 timmar (fig. 6c och c′′).
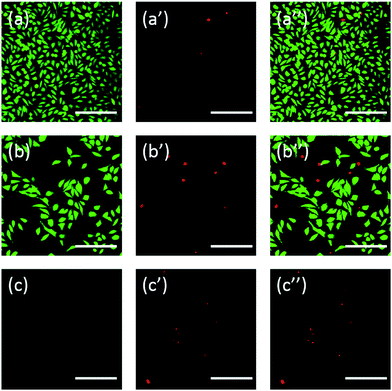
Både de optiska och fluorescerande bilderna visade intuitivt cytotoxiciteten hos dessa PEG-derivat, vilket ytterligare stödjer den slutsats som erhållits genom CCK-8-analyser. Det noterades att mPEGA-480 verkade mer toxisk genom FDA/PI dubbelfärgning, vilket beror på att FDA/PI dubbelfärgning skiljer på fullständigheten av levande/döda cellmembran medan CCK-8-analysen upptäcker aktiviteten hos dehydrogenas i mitokondrier, vilket tyder på att FDA/PI-färgning är ett utmärkt komplement till CCK-8-analysen för att ge fler detaljer om cellstatusen.
3.3 Mekanismstudie
Enligt cellviabilitetsförsöken beräknades och sammanfattades IC50-värdena för PEG-oligomerer och PEG-baserade monomerer till HeLa- och L929-celler efter 24 timmars odling (tabell 1), vilket tyder på att de PEG-baserade monomererna är mycket giftigare för cellerna än PEG-oligomererna, och att mPEGA har den högsta cytotoxiciteten. Generering av ROS och minskning av GSH i cellerna, två huvudmekanismer för cytotoxicitet, analyserades därför för att undersöka den möjliga orsaken till cytotoxiciteten.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| HeLa celler | 19.8 | 32,5 | 36,2 | 38,2 | 29,6 | 4,7 | 20,8 | 0,2 |
| L929-celler | 12,4 | 24.7 | 22,5 | 28,7 | 20,0 | 5,3 | 21,7 | 0,1 |
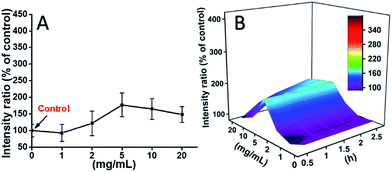
L929-celler inkuberades med TEG, och ROS-nivåerna vid olika tidpunkter (0, 0,5, 1,0, 1,5, 2 timmar) detekterades i enlighet med våra tidigare rapporter och visas i fig. 7. Som exempel visas ROS-nivåerna efter inkubation med olika koncentrationer TEG i 2 timmar i fig. 7A. Det är tydligt att ROS-nivåerna hålls stabila med låg TEG-koncentration (≤2 mg mL-1), men ökar betydligt när TEG-koncentrationen är högre än 2 mg mL-1, vilket stämmer överens med resultatet av experimentet med cellviabilitet i fig. 2B. På samma sätt ritades figurerna över ROS-nivån i förhållande till TEG-koncentrationen vid olika tidpunkter och sammanfogades för att få en 3D-karta (fig. 7B). De maximala ROS-nivåerna hittades vid 2 timmar med 20 mg mL-1 TEG, en cirka 400 % ökad ROS-nivå jämfört med kontrollen (ROS-nivå = 100) upptäcktes, vilket resulterade i den ljusaste fluorescensintensiteten. Dessa resultat tyder på att generering av ROS är en möjlig mekanism för TEG:s cytotoxicitet, och den höga ROS-nivån som induceras av TEG kan vara huvudorsaken till cellapoptos.
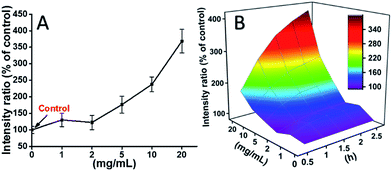
De ROS-nivåer som inducerades av mPEGA-480 efter 2 timmar testades också (fig. 8A). Till skillnad från TEG orsakade mPEGA inte den snabba ökningen av ROS i cellerna, endast ∼170 % ROS-ökning jämfört med kontrollen observerades som maximum. 3D ROS-nivån vs. mPEGA & tid (fig. 8B) visade ROS-nivån som inducerades av mPEGA-480 som en våg och krönet dök upp vid måttlig koncentration av mPEGA (5 mg mL-1), ingen signifikant ROS-generering kan observeras, vilket tyder på att ROS-genereringen kanske bara delvis bidrar till cytotoxiciteten hos mPEGA-480.
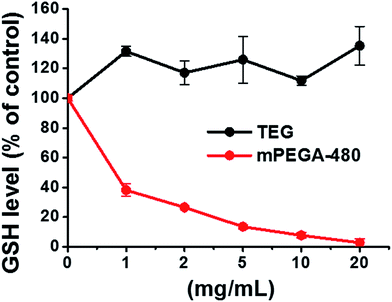
Den reducerande tiolgruppen i GSH är en viktig antioxidationskälla i organismer. En möjlig mekanism för cytotoxiciteten hos mPEGA-480 tillskrivs därför Michael-additionsreaktionen mellan tiolgruppen och vinylbindningen, vilket leder till den brutna intracellulära redoxjämvikten och cellapoptos. Tidigare forskning tyder på att Michael-additionen mellan tiol och akrylat är mycket snabbare än den mellan tiol och metakrylat,52 vilket kan vara en rimlig orsak till den olika akuta cytotoxiciteten mellan mPEGA-480 och mPEGMA-500.
Slutsatser
Cytotoxiciteten hos PEG-oligomerer och PEG-baserade monomerer för HeLa-celler och L929-celler utvärderades för första gången. Koncentrationsberoende cytotoxicitet hos PEG-oligomerer och PEG-baserade monomerer har bekräftats och presenteras som IC50-värden för HeLa-celler och L929-celler. PEG-400 och PEG-2000 verkar nästan inte vara cytotoxiska i den aktuella forskningen. PEG-1000, PEG-4000 och mPEGMA-950 visade måttlig cytotoxicitet, särskilt vid höga koncentrationer. TEG och mPEGMA-500 visade betydande cytotoxicitet och mPEGA-480 visade akut cytotoxicitet. Dessutom påverkar celltyperna också resultaten av cytotoxicitetsstudien, HeLa-celler är mer robusta än L929-celler när det gäller att tolerera PEG-derivat. Dessa resultat om PEG-derivatens cytotoxicitet är preliminära men grundläggande för deras framtida biomedicinska tillämpning, mer information om cellernas respons och beteende mot andra PEG-derivat kommer att undersökas ytterligare.
Acknowledgements
Denna forskning stöddes av Kinas nationella vetenskapsstiftelse (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein och G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan och J. L. Herrera, Am. J. Gastroenterol. 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper och M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang och D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun och H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris och R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese och G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley och J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill och W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner och W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann och A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li och Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao och Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng och Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad och S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan och D. Dixon, Gold Bull. 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li och Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Y. Yang, D. D. Fan, M. Y. Liu, L. Tao och Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo och H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka och H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya och C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander och P. Caliceti, Bioconjugate Chem. 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang och K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao och K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh och E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu och W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter och C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter och C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice och S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki och M. Watanabe, Anal. Commun. 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei och X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li och Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang och J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller och C. A. Thorne, Anal. Biochem. 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode och S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown och A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta och S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han och W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel och H. D. Maynard, Chem. Commun. 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake och L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang och P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones och J. A. Senft, J. Histochem. Cytochem. 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim och I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka och M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu och H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li och J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim och M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate och H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch och W. J. Stark, Toxicol. Lett. 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser och P. Wick, Toxicol. Lett., 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer och D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
