Introduktion
Divertikulär sjukdom i tjocktarmen är den vanligaste sjukdomen som drabbar tjocktarmen i västvärlden. Prevalensen av divertikulära sjukdomar har ökat under det senaste århundradet i hela världen, troligen på grund av förändringar i livsstilen, t.ex. rökning, övervikt och överhuvudtaget fysisk inaktivitet och fiberfattig kost. Prevalensen ökar med åldern, från cirka 5 % hos vuxna som är yngre än 40 år till 50-70 % hos dem som är 80 år eller äldre. 80 % av de patienter som får divertikulit är 50 år eller äldre. Divertiklar kan förekomma i antal från enstaka till hundratals, de är vanligtvis 5-10 mm i diameter, men kan överstiga 2 cm i storlek. Divertikulosan förekommer främst i sigmoideum och nedåtgående kolon hos mer än 90 % av patienterna, men kan förekomma i varierande grad i resten av kolonet.1
Det finns flera divertikularelaterade termer som kommer att användas i den här genomgången. Förekomsten av divertiklar i tjocktarmen i avsaknad av uppenbar inflammation kallas divertikulos eller okomplicerad divertikelsjukdom (UDD). Den kan vara symtomatisk eller asymtomatisk. Termen ”akut divertikulit i kolon” (ACD) används för att beskriva inflammation i divertiklarna, som kan eller inte kan utvecklas till komplikationer (komplicerad ACD). Det finns också kronisk divertikulit, på grund av återkommande divertikulit eller på grund av utvecklingen av en segmentell kolit i samband med divertiklarna. Sammanfattningsvis är det kliniska spektrumet av divertikelsjukdom brett.
Studier om sjukdomens naturliga historia pekar på att en stor majoritet av patienterna med divertiklar (cirka 80 %) förblir symtomfria under hela livet. Av de 15-20 % som utvecklar symtom kommer ungefär 1/4 så småningom att få en episod av symtomatisk smärtsam divertikelsjukdom utan inflammation, och upp till 10-25 % kommer att få en episod av ACD. Ungefär 1-2 % kommer att kräva sjukhusvistelse och 0,5 % kirurgi. Divertiklar är ansvariga för majoriteten (24-42 %) av episoderna av nedre gastrointestinal blödning.2-4
Fysiopatologi och symtomutveckling
Ett divertikel i kolon är en herniation av mukosa och submukosa, som motsvarar en svag punkt där vasa recti penetrerar tunica muscularis. De patogenetiska mekanismerna för divertikulära sjukdomar är fortfarande dåligt förstådda, men det är allmänt erkänt att dessa troligen är relaterade till komplexa interaktioner mellan kost, kolonens mikrobiota, genetiska faktorer, kolonens motilitet och struktur som resulterar i deras bildning av kolonens divertiklar med tiden.5 Se fig. 1. År 1971 publicerade Painter och Burkitt sin berömda hypotes att divertikelsjukdom orsakades av övertryck i tjocktarmen på grund av segmentering baserad på otillräckligt intag av kostfibrer. Som svar på det ökade intraluminala trycket kan det utvecklas outpouchings som sticker ut på områden med potentiell svaghet.6 Stasis eller obstruktion i den smalhalsade divertikeln kan leda till bakteriell överväxt och lokal vävnadsischemi, vilket i slutändan leder till perforation.7 Sedan dess har man i ett stort antal observationsstudier försökt påvisa fiberns eventuella effekt för att förebygga divertikelsjukdom. De flesta av dem drog slutsatsen att risken för UDD var omvänt associerad med intaget av kostfibrer.8-10 Baserat på dessa bevis rekommenderas en kost med hög fiberhalt för att förebygga divertikelsjukdom i de flesta aktuella riktlinjer och ställningstaganden.11-15 Denna hypotes har dock nyligen ifrågasatts eftersom: (1) det omvända sambandet mellan fiberintag och divertikulos har ifrågasatts i en del nyligen genomförda epidemiologiska studier16,17 och (2) nya patogena hypoteser, t.ex. den neuropatiska och myopatiska hypotesen, har dykt upp.18-22 Andra faktorer som har förknippats med en ökad risk för divertikelsjukdom är fysisk inaktivitet, förstoppning, fetma och rökning.23-27
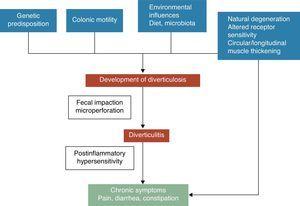
Symtomutveckling vid divertikulär sjukdom är troligen relaterad till komplexa interaktioner mellan genetiska egenskaper, kolonstruktur, tarmmotilitet låggradig inflammation och postinflammatorisk överkänslighet.
Sambandet mellan okomplicerad divertikelsjukdom (UDD) och symtom är osäkert. Det finns vissa belägg för att smärtsam divertikelsjukdom kan vara ett tillstånd som är relaterat till inflammation och dess effekter på den neuromuskulära funktionen i tjocktarmen.22-28 Förekomsten av en kronisk, låggradig tarminflammation skulle inducera en sensorisk-motorisk dysfunktion, vilket leder till att symtom utvecklas och/eller kvarstår. Förändringar i tarmens mikroflora skulle kunna vara en av de förmodade mekanismerna som är ansvariga för låggradig inflammation. Bakteriell överväxt som stöds av den fekala stasen i divertiklarna kan bidra till kronisk låggradig inflammation som sensibiliserar både intrinsiska primära efferenta och extrinsiska primära afferenta neuroner. Dessa förändringar kan leda till hypertrofi av glatt muskulatur och ökad känslighet för abdominell distension och slutligen till symtomutveckling.3,22 Se figur 1.
Som vi nämnde ovan förblir de flesta personer med divertikulos i tjocktarmen symtomfria, men kan så småningom utveckla komplikationer som ACD eller divertikelblödning. I den här artikeln fokuserar vi på ACD. Den kliniska manifestationen av denna händelse beror på ett antal faktorer, bland annat perforationens storlek, graden av extrakolonisk kontaminering och kroppens förmåga att begränsa denna kontaminering.29,30
Hantering av divertikelsjukdomHantering av okomplicerad divertikelsjukdom (UDD)
På patienter med asymtomatisk UDD,2 kan en fiberrik kost rekommenderas på grund av dess möjliga profylaktiska nytta för att förhindra symtomatisk UDD och komplikationer. Det finns inga bevis för att andra läkemedel är användbara hos dessa patienter.
Det finns mer bevis för nyttan av behandling vid symtomatisk UDD. Det vanligaste symtomet är buksmärta, som kan förvärras av att äta och lindras av defekation eller flatuspassage. Andra symtom är illamående, diarré, förstoppning och uppblåsthet. Över 61 % av patienter med symtomatisk UDD som inte vidtar någon terapeutisk åtgärd för att förhindra återkommande symtom kommer att få symtom inom ett år, och cirka 4 % kommer att utveckla komplikationer.31
Fem medel har föreslagits för behandling (se fig. 2):

Behandling av okomplicerad divertikulär sjukdom. Verkningsmekanismer.
A) Fiberrik kost eller fyllnadsmedel
Flera randomiserade kontrollerade studier (RCT) och andra interventionsstudier utvärderar effekten av fibrer vid symtomgivande UDD, men med inkonsekventa resultat.32-37 I vilket fall som helst rekommenderas fiber i förebyggande och behandling av symtomatisk UDD samt i förebyggande av ACD av de flesta aktuella riktlinjer och ställningstaganden.11-15
B) Antibiotikabehandling
Rationalet för användning av antibiotika vid symtomatisk UDD är inte klart fastställt. Nya studier tyder på att förändringar i tarmens mikrobiota (intestinal bakterieöverväxt) skulle kunna bidra till symtomutvecklingen på grund av överdriven produktion av tarmgaser genom fermentering av kolhydrater. För att undvika systematiska effekter verkar dåligt absorberade antimikrobiella medel som verkar mot enteriska patogener men har minimal risk för systematisk toxicitet eller biverkningar vara de lämpligaste antibiotika. Rifaximin har föreslagits.
Rifaximin
Rifaximin är en icke-systematisk rifamycinanalog med ett brett aktivitetsspektrum in vitro. Rifaximin kan minska den metaboliska aktiviteten hos tarmfloran, vilket ökar den fekala massan, och kan också utrota bakteriell överväxt. Detta antibiotikum har en hög säkerhets- och hög tolerabilitetsprofil.33,38 Plasmanivån av rifaximin är minimal, varför icke enteriska patogener inte utsätts för selektivt tryck och risken för bakteriell resistens är låg.39 Tre öppna och två dubbelblinda RCT:s40-44 har undersökt effektiviteten av cyklisk administrering av rifaximin och fibrer när det gäller att minska symtomen jämfört med enbart fibrer. En systematisk översikt och två metaanalyser har analyserat dessa prövningar.44-46 De drog slutsatsen att kombinerad behandling är effektiv när det gäller att uppnå symtomlindring efter ett år hos patienter med UDD. 35 % av de patienter som behandlades med enbart fiber var asymtomatiska jämfört med 64 % i grupper med kombinerad behandling. Antalet som behövdes för att behandla var tre för rifaximin jämfört med placebo för att lindra symtom och nio för att undvika komplikationer. Sammanfattningsvis har de bästa resultaten uppnåtts med en kombination av lösliga fibrer, t.ex. glukomannan, och rifaximin 1 vecka varje månad.
C) Probiotika
Probiotika är levande mikroorganismer som kan återställa den kommensala tarmfloran som kan ha förändrats vid divertikelsjukdom på grund av stasering och minskad transittid i kolonin.47 Tyvärr finns det få uppgifter om användningen av probiotika vid symtomatisk UDD och de flesta studier är små och okontrollerade. Majoriteten av dem visar symtomförbättring.48-50
Probiotika har också studerats i kombination med 5-aminosalicylat (5-ASA). Tursi och medarbetare har genomfört tre RCT:er som jämförde enbart 5-ASA, enbart probiotika eller kombinationsbehandling.51-53 Både 5-ASA och probiotika verkade vara effektiva för att förebygga symptomatisk UDD, men kombinationen av dem var bättre. En nyligen publicerad dubbelbindande RCT från samma vetenskapliga grupp drog slutsatsen att både cykliskt mesalazin och Lactobacillus casei subsp DG, särskilt i kombination, tycks vara bättre än placebo för att bibehålla remission av symtomatisk UDD.54 Men sammanfattningsvis kan man konstatera att de dåliga studiedesignerna och deras ringa storlek inte medger några definitiva slutsatser.
D) 5-ASA: mesalazin
Mesalazin har antiinflammatoriska och antioxidativa effekter. År 2010 publicerade Gatta et al,55 en systematisk Cochrane-översikt som utvärderade 5-ASA:s roll hos patienter med divertikelsjukdom. Författarna drog slutsatsen att 5-ASA kan vara effektivt vid behandling av denna sjukdom och att vardagligt mesalazin var bättre än cyklisk administrering för att förhindra återfall. Det krävs väl utformade RCT av hög kvalitet för att bekräfta deras observationer. Den första placebokontrollerade dubbelblinda studien visade att mesalazin var effektivt när det gällde smärtlindring hos patienter med akut UDD.56 Det finns också två intressanta RCT som visade att mesalazin var fördelaktigt jämfört med rifaximin när det gällde att förebygga symtomåterfall och att det var lika framgångsrikt när det gällde att bibehålla en långsiktig remission jämfört med probiotikumet Lactobacillus casei.53,57
E) Antikolinergiska/antispasmodiska medel
Hippermotiliteten i tjocktarmen vid divertikulos tyder på att antispasmodiska medel som dicyklomin och hyoscyamin kan förbättra symtomen genom att minska muskelkontraktionen. Men det finns inga RCT som bekräftar denna fördel.
F) Undvik NSAID-behandling
Flera kontrollerade studier har visat att NSAID är en riskfaktor för utveckling av symtom, ACD, perforation och blödning.7,58-60 NSAID-användare löper större risk att utveckla symtomgivande divertikulära sjukdomar än icke-användare (RR: 1,5, KI 95 %: 1,1-2,1).58 Och hos patienter med komplicerade divertikulära sjukdomar fanns det en större användning av NSAID jämfört med kontroller utan sjukdom. Det postulerades att denna ökade risk berodde på slemhinneskador som resulterade i försämrad barriärfunktion i kolonslemhinnan vilket möjliggjorde translokation av bakterier som framkallade inflammation.
G) Nivåer av D-vitamin
Det verkar som om incidensen av ACD har förknippats med geografiska och säsongsrelaterade variationer. På grund av detta genomförde Maguire et al. två intressanta observationsstudier som visade att lägre nivåer av D-vitamin och låg UV-ljusexponering (UV-exponering bestämmer D-vitaminstatus) är förknippade med betydligt högre risk för ACD. Fler studier av hög kvalitet är nödvändiga innan en rekommendation kan utfärdas.61,62
Behandling av akut divertikulit i tjocktarmen (ACD)
Och även om de flesta personer med divertikulos förblir symtomfria, uppskattas det att cirka 10-25 % av dem kommer att utveckla en episod av vänster ACD.63 Generellt sett är den kliniska diagnosen inte tillräckligt noggrann och radiologiska tekniker är indicerade. Hos patienter med milda symtom (de flesta) och utan tecken på komplicerad ACD kan kombinationen av smärta i nedre delen av vänster buk, avsaknad av kräkningar och ett C-reaktivt protein >50mg/l vara tillräcklig för diagnosen.64,65 Om bilddiagnostik är indicerad kan troligen en villkorad strategi med ultraljud som första linjesteknik och följt av datortomografi (CT), om ultraljudet inte är entydigt eller tveksamt, utgöra den mest effektiva metoden. Antalet CT-undersökningar kan minskas med 50 %. 1978 föreslog Hinchey et al. en klassificering av ACD, som senare modifierades.66,67 Den skiljer fem stadier av ACD; stadium 0, kliniskt mild divertikulit, stadium I (a: perikolisk inflammation och b: abcess
cm i närheten av den primära inflammationen), stadium II, intraabdominal, bäcken- eller retroperitoneal abcess eller abcess som ligger långt från den primära inflammationen, stadium III, generaliserad purulent peritonit och stadium IV, faecal peritonit. Se figur 3.

Algoritm för behandling av akut divertikulit i tjocktarmen.
Behandling av okomplicerad ACD (Hinchey stadium 0 eller Ia)
Flerparten av okomplicerad ACD kan säkert behandlas konservativt med en framgångsfrekvens på mellan 70 % och 100 %.14 Ambulansbehandling kan möjliggöra betydande kostnadsbesparingar för hälso- och sjukvårdssystemen. I fall av okomplicerad ACD är kriterierna för behandling i slutenvården betydande inflammation (inklusive förekomst av feber eller peritonit), intolerans mot orala vätskor, ålder över 80-85 år, immunosuppression eller allvarliga komorbiditeter. I de flesta fall räcker det med en kort sjukhusvistelse. Det finns inga bevis för att kostrestriktioner påverkade behandlingsresultaten, även om de flesta läkare vanligtvis rekommenderar klar flytande kost.
En av de största förändringarna på senare tid i hanteringen av okomplicerad ACD är den minskande användningen av antibiotika. I en nyligen genomförd Cochrane-granskning, som endast är kvalitativ (utan metaanalys), konstaterades att de bästa tillgängliga uppgifterna inte stöder rutinmässig användning av antibiotika.68 Antibiotika varken påskyndar tillfrisknandet eller förhindrar komplikationer eller återfall. Därför kan användningen av antibiotika i det här fallet ifrågasättas. Troligen skulle de vara lämpliga hos patienter med tecken på generaliserad infektion, tecken på septikemi eller bakteriemi och hos immunsupprimerade patienter. Rekommenderade regimer baseras på klinisk konsensus. Olika antibiotika kan användas, allt från ampicilin till tredje generationens cefalosporiner, så länge de är effektiva mot grampositiva, gramnegativa och anaeroba bakterier. Kombinationen av ciprofloxacin och metronidazol är förmodligen den mest förskrivna orala behandlingen. Om denna kombination tolereras dåligt kan ampicilin-sulfabaktam vara ett bra val. Å andra sidan har nya uppgifter visat att det inte finns några fördelar med intravenösa jämfört med orala antibiotika och med intravenös 4-dagarsbehandling jämfört med 7-dagarsbehandling.69-71 Vanligtvis observeras en klinisk förbättring inom 3-4 dagar efter behandlingen. Slutligen rekommenderas inläggning på sjukhus med intravenös antibiotika när patienten inte kan inta mat oralt, drabbas av allvarlig komorbiditet eller inte förbättras med öppenvårdsbehandling.
Behandling av komplicerad ACD (Hinchey-stadium Ib till IV)ACD Hinchey Ib eller II: abscess
Omkring 15 % av patienterna med ACD kommer att utveckla en abscess.67 Det finns ingen evidens av hög kvalitet om den mest optimala behandlingen av ACD med abscessbildning. Sjukhusvård är indicerat. Storleken är en viktig faktor för framgångsrik behandling. Vid mindre abscesser (
cm) rekommenderas konservativ behandling med bredspektrumantibiotika. Den kommer att vara framgångsrik i upp till 70 %.72 När konservativ behandling misslyckas eller vid större abscesser bör perkutan dränering utföras. Den är framgångsrik i upp till 80 %.73 Kirurgi är en räddningsbehandling när tidigare nämnda behandlingar misslyckas.ACD Hinchey III eller IV: purulent eller fekal peritonit
Peritonit är den allvarligaste komplikationen, med en dödlighet på 14 %. Även om det inte finns några bevis anses tidig kirurgi vara standardbehandling för dessa patienter. Valet av operation påverkas av patientens tillstånd, operationsfynd och kirurgens erfarenhet. Hos kritiskt sjuka patienter med hemodynamisk instabilitet rekommenderas Hartmanns förfarande. Hos hemodynamiskt stabila patienter måste dock primär anastomos med eller utan proximal fekal avledning anses vara att föredra.14,74
Traditionellt rekommenderar internationella riktlinjer att man använder endoskopi efter en episod av ACD för att utesluta kolorektal cancer. Denna rekommendation bygger endast på expertutlåtanden. Nya retrospektiva studier och en systematisk översikt75-80 visar att cancerfrekvensen hos dessa patienter är ganska låg. Baserat på dessa nya bevis kan den mest effektiva strategin vara att remittera till koloskopi endast de patienter med ihållande symtom eller de med misstänkta CT-fynd. Men fler studier är nödvändiga för en bestämd rekommendation.
Hantering efter en episod av ACDPrevention av återkommande ACD
Efter en episod av ACD kommer ungefär en tredjedel att få en andra ACD, och efter en andra episod kommer ytterligare en tredjedel att få en ny attack.73,74 Men bevisen för att definiera den optimala behandlingen efter en ACD-episod för att förhindra en ny episod är knapphändiga.
A) Fiberrik kost
När den akuta episoden har gått över, rekommenderas vanligen en fiberrik kost för att minska återfall. Men RCT:er om fiberrik kost hos patienter med ACD har haft inkonsekventa resultat. En nyligen publicerad systematisk genomgång av fiberrik kost kunde inte inkludera någon studie som undersöker fiberns roll i förebyggandet av återkommande ACD.26,81 Vissa livsmedel (frön, popcorn och nötter) undviks klassiskt eftersom de teoretiskt sett går in i, blockerar eller irriterar divertiklar. Men Strate et al. fann i sin stora, prospektiva studie inget samband med en ökad risk för ACD. Därför bör man inte rekommendera att dessa livsmedel utesluts ur kosten.82 Även viktminskning och rökstopp kan ha en gynnsam inverkan på förebyggandet av ACD.9,83
B) Antibiotika
Det finns tre nyligen genomförda systematiska översikter som utvärderat den roll som cykliskt rifaximin spelar för att förebygga återfall i ACD, men som inte visade på någon tydlig fördel.46,84,85 Ur patofysiologisk synvinkel kan en rimlig förklaring till rifaximins ineffektivitet när det gäller att förebygga återfall vara att en cyklisk behandling kanske inte kontrollerar kolonens bakteriepopulation under en hel månad, eftersom kolonens bakteriepopulation återhämtar sig inom 7-14 dagar efter det att rifaximin avslutats. En nyligen genomförd spansk öppen RCT har dock visat att cykliskt rifaximin kan förbättra symtomen och upprätthålla perioder av remission efter ACD.86 Återfall inträffade hos 10,4 % av de patienter som fick rifaximin plus fiber jämfört med 19,3 % av patienter som fick enbart fiber. Dessutom hade patienter med första diagnos sedan ≥1 år en högre risk för exacerbation (OR 3,34, 95 % CI: 0,01-12,18). Men det behövs ytterligare studier eftersom inga rekommendationer för närvarande kan utfärdas. Det finns inga belägg för att stödja användningen av andra antibiotika i denna miljö.
C) Probiotika
En del öppna studier har undersökt probiotikas roll för att förebygga återfall i ACD. Giaccari et al. utvärderade för mer än 20 år sedan betydelsen av Lactobacillus sp. efter rifaximin hos 79 patienter med kolonstenos efter divertikulit. 88 % av patienterna förblev symtomfria under en period av 12 månader.87 Denna observationsstudie var den första som antydde en möjlig roll för probiotika i denna situation. I en nyare studie utvärderades kombinerad behandling; balsalazid och VSL#3 (en probiotisk blandning av åtta arter). Efter 12 månader var 73 % av de personer som fick kombinationsbehandling asymptomatiska jämfört med 53 % som fick probiotisk monoterapi (p>0,05).52 Sammanfattningsvis verkar probiotika vara effektivt för att förhindra återfall i ACD, men väl utformade studier saknas.
D) 5-ASA
Flera dubbelblinda och öppna RCT:er har utvärderat mesalazins roll för att förhindra återfall i ACD. Tyvärr har de flesta av dem inte funnit någon fördel av mesalazin jämfört med placebo när det gäller att förebygga återfall.88-90 Raskin et al. har nyligen publicerat två intressanta och identiska fas 3 dubbelblinda placebo-RCT (PREVENT1 och PREVENT2) som också visar att mesalazin inte är överlägset placebo när det gäller att förebygga återfall i ACD.91 Även kombinationsbehandlingen, 5-ASA plus rifaximin, har utvärderats i flera studier. Trivedi och Das granskade data från fem RCT och en öppen studie med sammanlagt över 600 patienter och drog slutsatsen att kombinationen tycks vara överlägsen enbart rifaximin när det gäller att förebygga recidiverande ACD.92
E) Kirurgi
Till för några år sedan rekommenderades elektiv kirurgi efter två attacker av okomplicerad ACD eller en attack av komplicerad ACD för att minska morbiditeten och mortaliteten genom recidiv. Men elektiv kirurgi medför också en ökad risk för morbi-mortalitet.93 Därför är det viktigt att väga morbiditet och mortalitet till följd av kirurgi mot risken för komplicerade återfall och symtomens svårighetsgrad.
Nyare uppgifter visar att ACD:s naturliga historia är mycket mer godartad än vad man tidigare trodde.73,94 Den långsiktiga risken för återfall är lägre än vad man tidigare trott, och de långsiktiga riskerna för efterföljande akutkirurgi (3-7 %), död (95 visade att 16 % av fallen med första ACD akutopererades jämfört med endast 6 % i återfallsfall, och att 30-dagarsdödligheten för första episoden också var högre jämfört med återkommande händelser (3 % jämfört med 0 %). Faktum är att majoriteten av de patienter som presenterar komplicerad ACD saknar sjukdomshistoria.96 Det föreslås också att återkommande ACD kan skydda mot perforation, möjligen på grund av adhesionsbildning orsakad av inflammation.95 Därför minskar en policy för elektiv kirurgi efter ACD inte sannolikheten för ytterligare kirurgi (upp till 3 %) och skyddar inte helt mot återfall. Å andra sidan har förbättrad diagnostik och förbättrade behandlingsmetoder minskat morbi-mortaliteten vid komplicerad ACD. På grund av dessa nya uppgifter rekommenderar American Society of Colon and Rectum Surgeons i sin senaste riktlinje att elektiv sigmoidresektion efter återhämtning från ACD bör göras från fall till fall14 och anser att antalet tidigare episoder inte är en bra indikator för urvalet av kandidater för elektiv kirurgi. Läkare bör ta hänsyn till patientens medicinska tillstånd och ålder, frekvensen och svårighetsgraden av attacken/attackerna och förekomsten av ihållande symtom efter den akuta episoden.14
Det är mycket svårt att förutse vilka fall av ACD som kommer att återfalla. CT-graderad svårighetsgrad av den första episoden av ACD verkar vara en prediktor för en ogynnsam naturalhistoria. Vänster sida av ACD, >5 cm av kolon involverad och en retroperitoneal abscess var prediktorer för återfall och måste beaktas.97 Det finns ingen konsensus om huruvida ung ålder (82 Enligt nuvarande evidens bör ålder inte betraktas som en indikation för elektiv kirurgi eftersom den inte verkar ha något samband med ett allvarligt sjukdomsförlopp efter en medicinskt behandlad ACD. Men med hänsyn till att det finns en ökad incidens av ACD hos yngre patienter krävs ytterligare studier för att klargöra denna specifika fråga.
Särskilda fall är de immunsupprimerade individerna. Kohortstudier visar att dessa patienter hade en hög risk för komplicerad recidiverande ACD (5 gånger högre risk för perforation) och en hög risk för akut kirurgi.98 Därför kan en lägre tröskel för elektiv kirurgi gynna dem.14 Men Biondo et al. visar i sin nyligen genomförda studie att immunkompromiterade patienter hade en signifikant högre dödlighet, men endast vid den första episoden. Därför är kontroversen närvarande.99
Behandling av följdsjukdomarA) Fistel
En fistel uppstår när ett divertikulärt flegma eller en abscess rupturerar in i ett angränsande organ. En fistel uppträder hos färre än 5 % av patienterna med ACD. De vanligaste är kolovesikala och kolovaginala fistlar. Förmodligen skulle en operativ resektion i ett enda steg med stängning av fisteln och primär anastomos kunna utföras hos de flesta patienter. Andra fistlar som koloenteriska eller coluterina är sällsynta.100,101
B) Obstruktion
Återkommande episoder av ACD, som kan vara subkliniska, kan ge upphov till kronisk strikturering av kolon utan pågående inflammation. En höggradig eller fullständig obstruktion kan förekomma. Först av att behandla obstruktion är det nödvändigt att utesluta en malign etiologi. När neoplasm är tillräckligt utesluten och det inte finns någon ACD kan endoskopisk dilatation eller tillfällig dekompression med metallstent vara terapeutiska alternativ.102 Senare kan en efterföljande enstegsresektion utan diversion förverkligas.
Hantering av segmentell kolit i samband med divertikulos
Det definieras som en kronisk inflammation av interdivertikulära slemhinnor i ett kolonsegment involverar. Rektum och höger kolon är skonade. Det har blivit i en distinkt klinisk och patologisk sjukdom och presenterar ofta med blodig avföring. Patogenesen är okänd. Spektrumet av histologiska förändringar sträcker sig från mild ospecifik inflammation till inflammatoriska tarmsjukdomsliknande förändringar. På grund av detta är differentialdiagnosen ofta svår att ställa. De flesta patienter återhämtar sig helt inom några veckor eller månader. En del av dem behandlas initialt med oral 5-ASA, men troligen är dessa läkemedel inte nödvändiga eftersom de flesta fall löser sig spontant.103
Slutsatser
I symptomatisk UDD är målen för behandlingen att förebygga komplikationer och minska symtomen. Enligt nuvarande evidens verkar fiber plus cykliskt rifaximin eller mesalazin plus probiotika vara de mest effektiva terapierna. Vid ACD tycks antibiotika förbli den viktigaste behandlingen och en öppenvårdshantering anses vara det optimala tillvägagångssättet för det stora flertalet patienter med okomplicerad ACD. Vid komplicerad ACD är det dock nödvändigt att behandla patienterna på sjukhus och ge dem intravenösa antibiotika. För närvarande håller akutkirurgins roll på att förändras. De flesta divertikulitassocierade abscesser kan behandlas med intravenösa antibiotika och/eller perkutan dränering och akut kirurgi kommer att betraktas som standardbehandling endast för patienter med peritonit. Slutligen bör elektiv kirurgi efter återhämtning från ACD göras från fall till fall.
Författarnas bidrag
Gargallo CJ, Sopeña F och Lanas A bidrog i lika hög grad till utformningen, redigeringen av utkastet och granskningen av denna artikel.
Intressekonflikt
Dr Carla J. Gargallo och Dr Federico Sopeña rapporterar inga intressekonflikter. Dr Angel Lanas har varit rådgivare till AlfaWasserman.
