Ioniska, kovalenta (enkla molekylära och jätteatomära) och metalliska föreningar har alla olika egenskaper. För att klassificera ett ämne som någon av dessa föreningar måste därför en rad tester/experiment utföras för att ta reda på vilka egenskaper det har. Observera följande tabell:
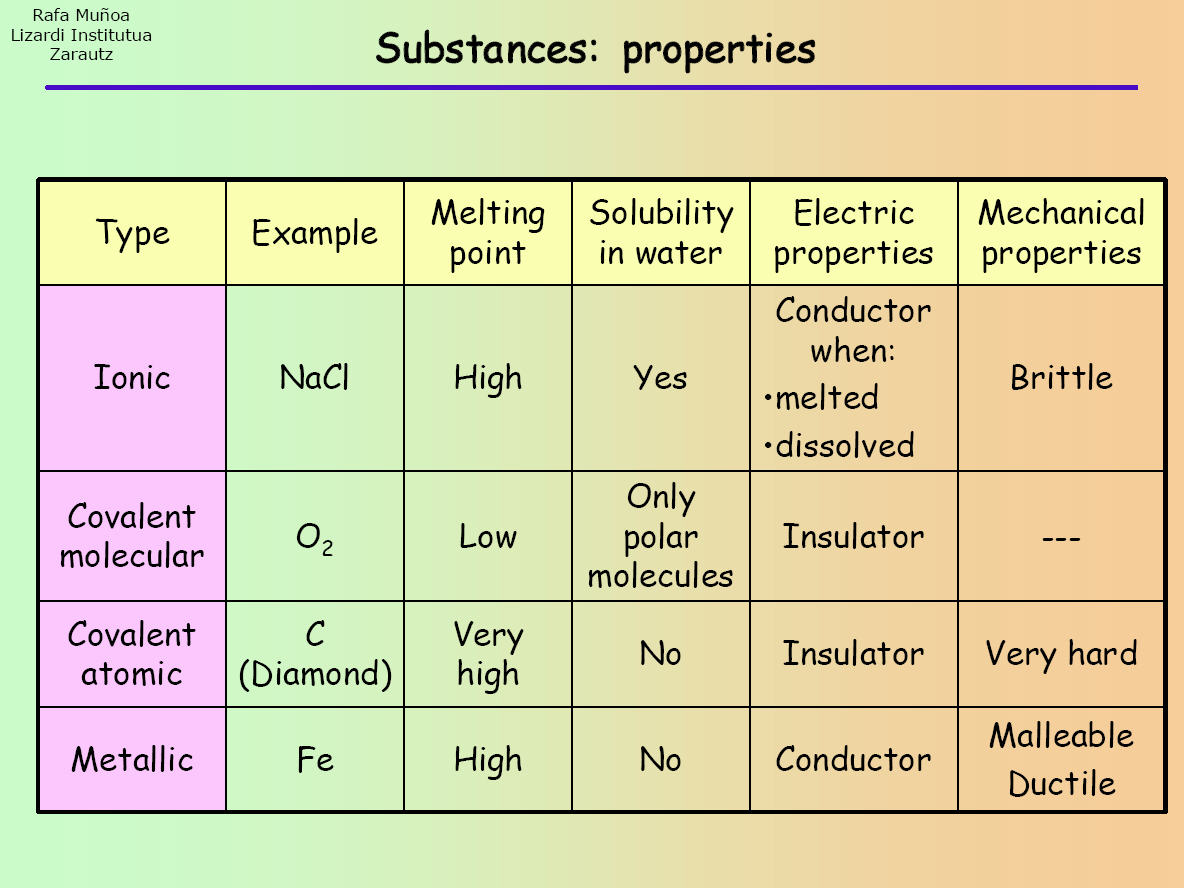
När experimentet har utförts kan man jämföra de resultat man får med resultaten i tabellen för att fastställa vilken sorts förening ämnet är.
Först kan man lägga ett prov av det okända ämnet i ett provrör och sätta det över en låga. Detta görs för att bestämma smältpunkten. Om ämnet smälter är det troligen ett kovalent enkelt molekylärt ämne (enligt tabellen). Om ingen smältning sker kan dock ämnet antingen vara joniskt, kovalent jätteatomärt eller metalliskt.
Det är egentligen därför vi måste utföra mer än ett test på det okända ämnet eftersom vissa kategorier av föreningar har liknande egenskaper (till exempel har joniska föreningar och kovalenta föreningar båda höga smältpunkter).
Nästan kan du försöka lösa upp en del av ämnet i vatten (eller ett annat polärt lösningsmedel). Om det löser sig kan det vara antingen en jonisk eller kovalent enkel molekylär förening. Dina resultat från det föregående och nästa testet kommer att hjälpa dig att begränsa dina resultat till endast en typ av förening.
Nästan kan du ansluta provet till en krets som den som visas nedan för att se om det leder en elektrisk ström.
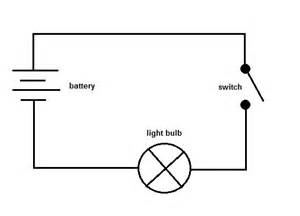
Du kan byta ut strömbrytaren mot provet. Om lampan tänds är det en ledare och om inte är det en icke-ledare.
Så, till exempel, i slutet av det här experimentet, om provet förblev osmält, upplöstes i vatten och ledde en elektrisk ström, så är det en jonisk förening.
Alla dessa observationer kan förklaras ytterligare genom att undersöka de bindningar och intermolekylära attraktionskrafter som håller samman komponenterna i en förening.
