När en gas i jämnt flöde passerar genom en förträngning, t.ex. i en öppning eller ventil, upplever den normalt en temperaturförändring. Detta beror delvis på förändringar i den kinetiska energin, men det finns en annan del som bidrar med gasens icke-idealitet. Om kanalerna uppströms och nedströms är tillräckligt stora för att den kinetiska energin skall vara försumbar vid dessa stationer, mäts temperaturerna uppströms och nedströms tillräckligt långt bort från den störning som skapas av förträngningen och systemet är adiabatiskt; den uppmätta effekten beror enbart på icke-idealiteten. Utifrån termodynamikens första lag är en sådan process isenthalpisk och man kan med fördel definiera en Joule-Thomson-koefficient som:
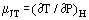
som ett mått på den temperaturförändring som uppstår till följd av ett tryckfall över förträngningen.
För de flesta riktiga gaser i ungefär samma förhållanden som i omgivningen är μ positiv, dvs. temperaturen sjunker när den passerar förträngningen. För väte och helium är den negativ och temperaturen ökar. Vid högre temperaturer, för de flesta gaser, sjunker μ och kan till och med bli negativ, μ kan också bli negativ genom att applicera tryck, även vid omgivningstemperatur, men tryck på över 200 bar är normalt nödvändiga för att uppnå detta.
