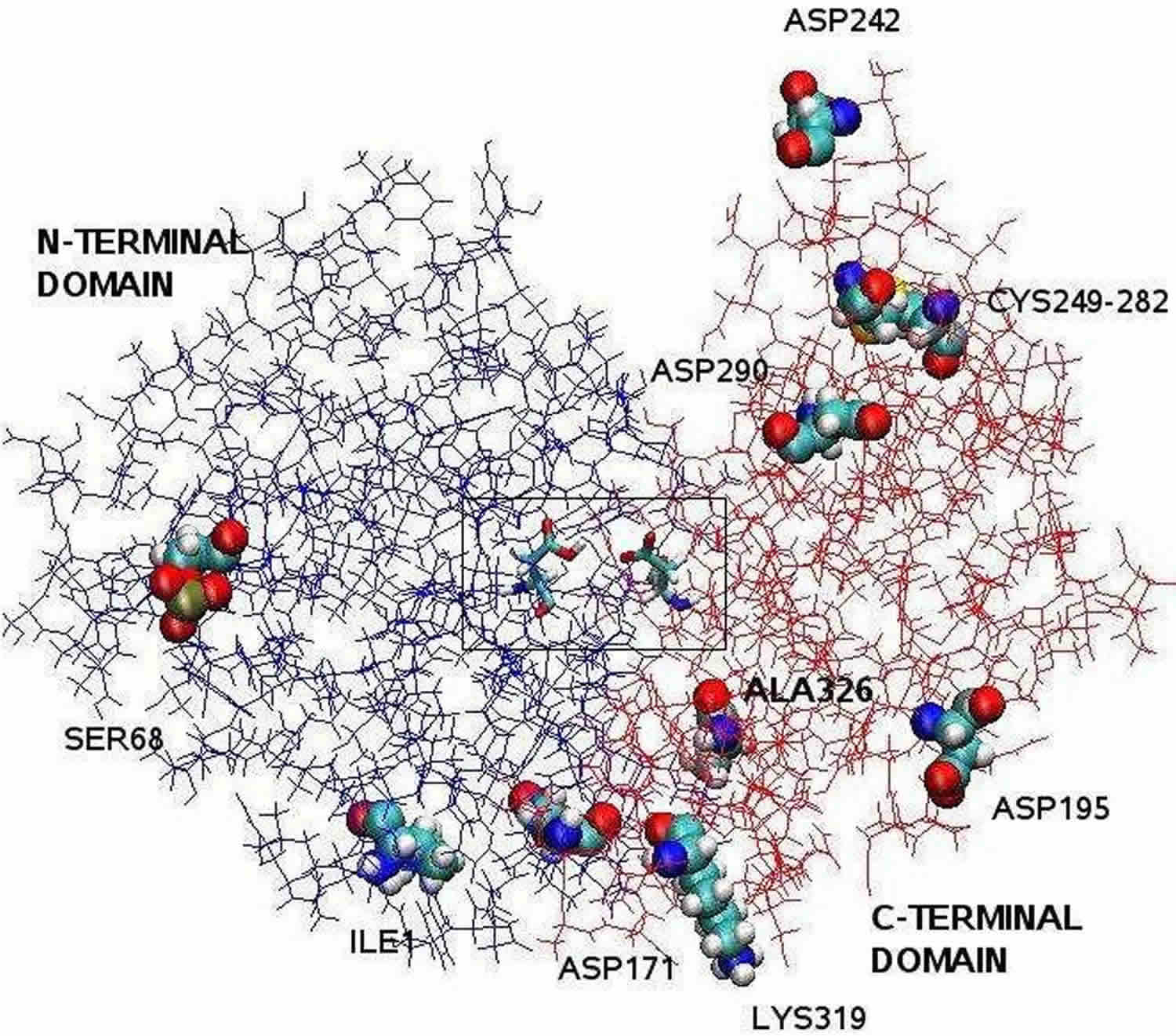
 Fotnot: Den pepsinstruktur som klargjorts med hjälp av röntgenkristallografi är bilobal med en stor klyfta i den aktiva platsen mellan de två loberna. Resterna 1 till 175 utgör den N-terminala domänen, medan resterna 176 till 326 utgör den C-terminala domänen. Två aspartater i mitten av klyftan, Asp32 och Asp215, fungerar som katalysatorrester. Den katalytiska platsen, som består av Asp32 och Asp215, är belägen i mitten av klyftan. De laddade aminosyraresterna på proteinytan är Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). Den fosforylerade Ser68 är helt exponerad för lösningsmedlet och disulfidbryggan mellan Cys 249 och Cys 282 är belägen på proteinytan.
Fotnot: Den pepsinstruktur som klargjorts med hjälp av röntgenkristallografi är bilobal med en stor klyfta i den aktiva platsen mellan de två loberna. Resterna 1 till 175 utgör den N-terminala domänen, medan resterna 176 till 326 utgör den C-terminala domänen. Två aspartater i mitten av klyftan, Asp32 och Asp215, fungerar som katalysatorrester. Den katalytiska platsen, som består av Asp32 och Asp215, är belägen i mitten av klyftan. De laddade aminosyraresterna på proteinytan är Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal), Ala326 (C-terminal). Den fosforylerade Ser68 är helt exponerad för lösningsmedlet och disulfidbryggan mellan Cys 249 och Cys 282 är belägen på proteinytan.
Pepsin har som aspartiskt proteas ett mycket lågt pH-optimum. Kondjoyan, Daudin och Santé-Lhoutellier 9) studerade smältbarheten hos myofibrillära proteiner och fann maximal pepsinaktivitet vid pH runt 2. Pletschke, Naudé och Oelofsen 10) studerade hydrolysen av hemoglobin med pepsin från svin och struts och fann också ett optimalt pH på 2,0 för pepsinaktivitet. När pepsinenzymet väl har aktiverats vid pH <4,5 denatureras det lätt vid pH över 7,0, vilket utgör egenskaper som bestämmer pepsins egenskaper 11).
I motsats till pH:s påverkan diskuteras jonstyrkans effekt på enzymaktiviteten mindre ofta. Tidigare arbete av Dale och White 12) visade att en ökning av jonstyrkan tydligt minskar reaktionshastigheten hos immobiliserat ribonukleas från bukspottkörteln, medan Butré, Wierenga och Gruppen 13) studerade den enzymatiska hydrolysen av vassleproteinisolat med alkalas och neutrase, och fann också att närvaron av 0.5M NaCl minskade hydrolyshastigheten.
Två potenta naturligt förekommande hämmare av pepsin är kända: pepstatin, en pentapeptid från Streptomyces, och en unik proteinös hämmare från Ascaris. Pepsin genomgår också en återkopplingshämning; en produkt från proteindesmältningen bromsar reaktionen genom att hämma pepsin 14).
Var produceras pepsin?
Hövdingecellerna utsöndrar pepsin i form av en inaktiv enzymprekursor som kallas pepsinogen. När pepsinogen kommer i kontakt med saltsyra från parietalcellerna bryts det snabbt ner och bildar pepsin 15). Pepsin påbörjar matsmältningen av nästan alla typer av kostprotein till polypeptider. Detta enzym är mest aktivt i en sur miljö, vilket tillhandahålls av saltsyran i magsaften.
Figur 2. Magsäcksceller (magkörtlar)
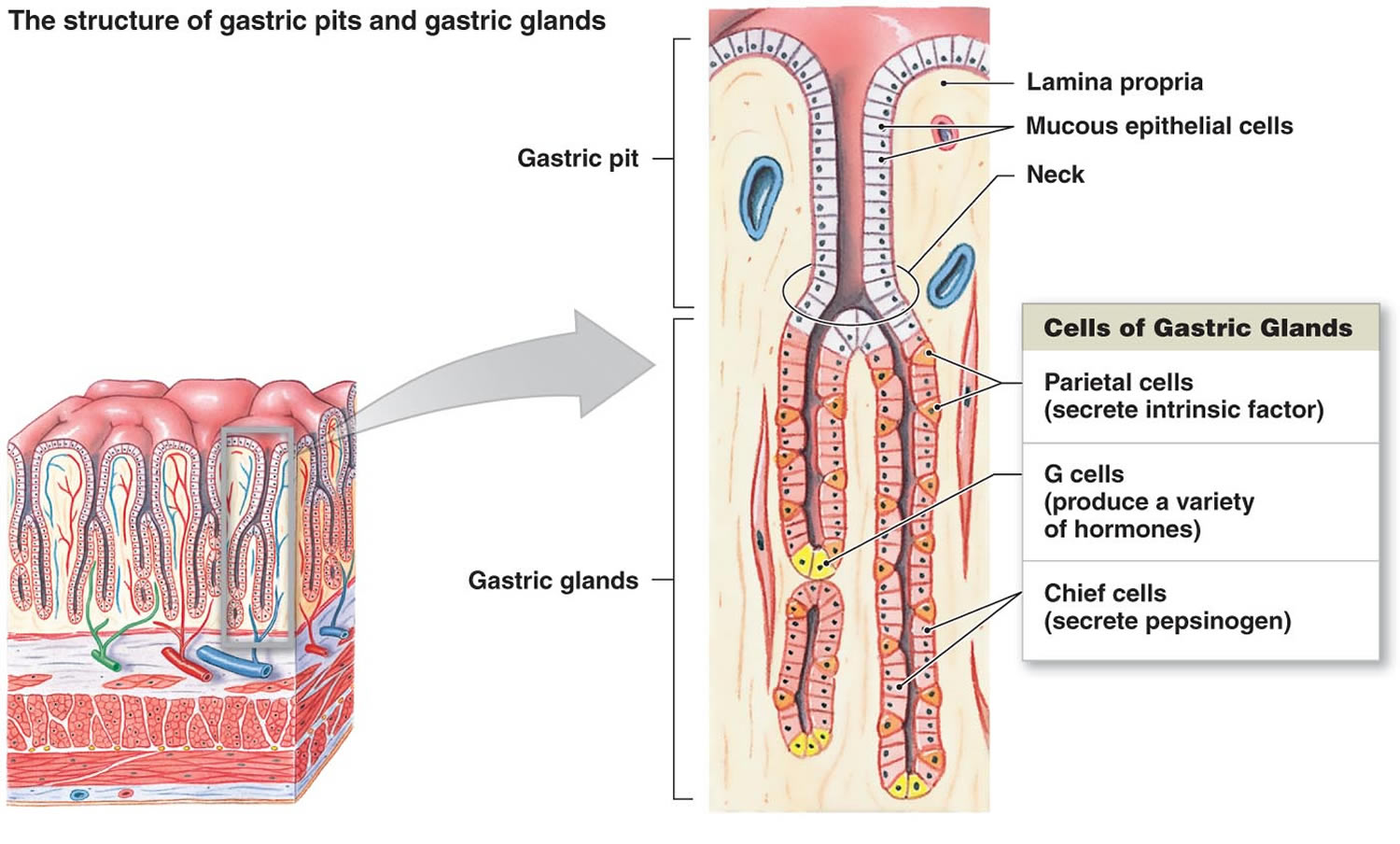 Fotnot: Magsäckens foder. Magsäckskörtlarna omfattar slemceller, parietalceller och huvudceller. Magsäckens slemhinna är översållad med maggropar som är öppningar för magkörtlarna.
Fotnot: Magsäckens foder. Magsäckskörtlarna omfattar slemceller, parietalceller och huvudceller. Magsäckens slemhinna är översållad med maggropar som är öppningar för magkörtlarna.
Vad gör pepsin?
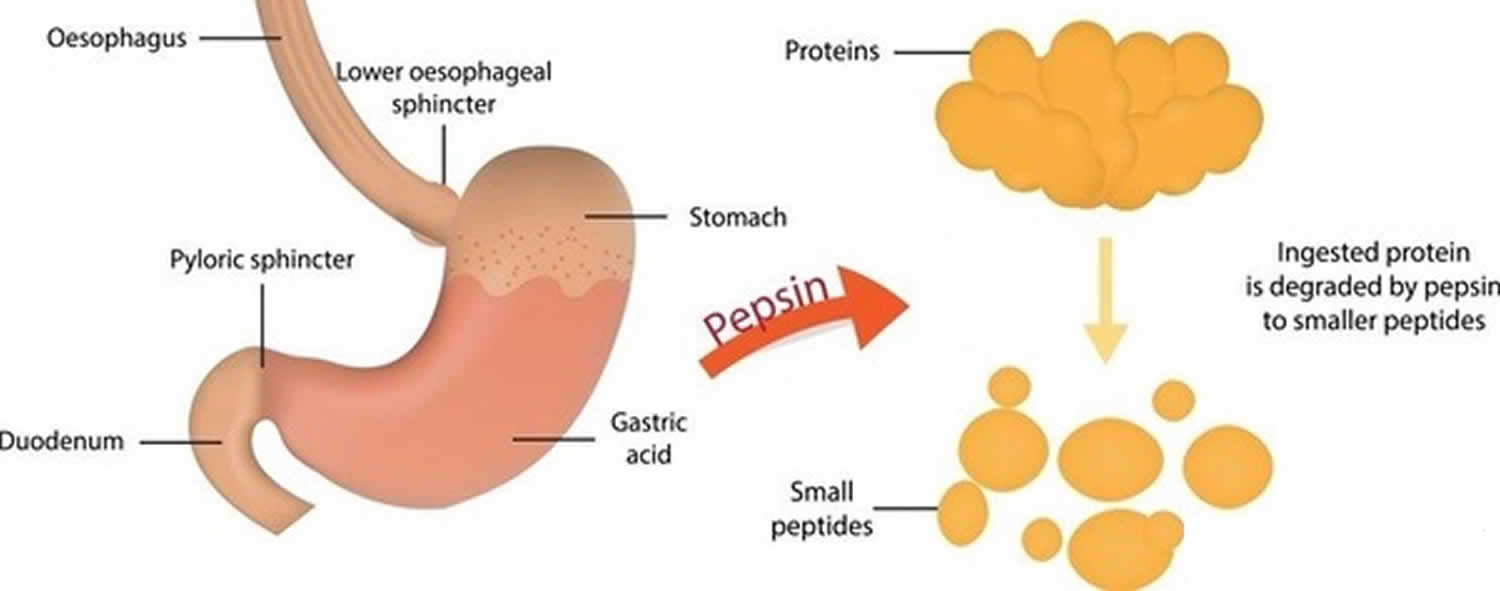
Pepsin som bildas från pepsinogen (inaktiv form av pepsin) i närvaro av saltsyra, smälter nästan alla typer av kostprotein till polypeptider (mindre proteinföreningar). Pepsin smälter proteiner i stark magsyra. Pepsin är optimerat för matsmältning i den sura miljön i magsäcken och är det första proteas som matproteiner möter i matsmältningskanalen. Pepsin är mest aktivt i sura miljöer mellan 37 °C och 42 °C 16).
Pepsins specificitet (dvs. sannolikheten för att pepsin ska klyva peptidbindningar) påverkas främst av aminosyraresterna vid position P1 och P1′, medan aminosyraresterna vid andra subsites också kan spela en roll. I allmänhet föredrar pepsin att klyva efter fenylalanin, leucin och metionin, medan det sällan klyver efter histidin, lysin, prolin och arginin 17). Aromatiska rester tyrosin, tryptofan och fenylalanin gynnas i position P1′. Prolin är starkt missgynnat i position P2, P2′ och P3′, medan histidin, lysin och arginin är missgynnade i position P3. Positionerna P4 och P4′ har liten inverkan 18).
Figur 3. Pepsinfunktion
.
