Insektssamling är en intressant hobby för många, men den är också mycket användbar inom vetenskaplig forskning. Det här inlägget kommer att förklara hur man samlar in och bevarar insekter, och visa hur de ska pinnas.
Insektssamling kan göras när som helst, även om de främst förekommer under våren till senhösten. Sommaren är förmodligen den bästa tiden, eftersom insekterna är som mest rikliga. Varma, soliga dagar kommer troligen att ha flest insekter närvarande, men det är klokt att kontrollera under olika tider och väderförhållanden, eftersom olika insekter dyker upp vid olika tidpunkter. På natten är gatubelysningar och verandalampor ett bra ställe att leta på. Lövkullar och växter hyser sannolikt insekter, och det finns också många nattliga insekter som håller sig borta från ljus.
Samlingsutrustning:
- Insektsnät – Dessa kan köpas eller tillverkas. De bör vara gjorda av nät som sys ihop med en muslin- eller canvasduk som lindas runt tråden. Därifrån kan insekten överföras till en burk, antingen genom att sätta burken i nätet eller genom att hålla insekten i bröstkorgen.
-

Min avlivningsburk. PC: Colton Weaver Dödsburk – Det är bäst att ha 2-3 burkar i olika former och storlekar. Helst är de korkade, men det kan bero på detta. De bör vara väl synligt märkta med ”POISON”. Gips eller bomull läggs i burken för att hålla kvar det dödande medlet. Borror, Delong och Triplehorn rekommenderar cyanid, men etylacetat kan också användas och är betydligt säkrare. Koltetraklorid eller kloroform kan också användas.
- Pillerboxar med vävnad
- Kuvert, eller papper för att göra dem – Användbart för tillfällig förvaring. Dessa kan lätt byggas i fält och förvarar dina exemplar relativt säkert.
- Flaskor fyllda med konserveringsvätska
- Tång
- Handlins
- Aspirator – Dessa fångar in små insekter i flaskor med hjälp av din andedräkt. Vanligtvis har de en skärm som förhindrar att du andas in insekten.
- Slående paraply eller lakan – Ett lakan eller paraply placeras under en växt, som sedan slås eller skakas så att små insekter faller ner på lakanet.
- Sifter – Bladspillning kan sakta siktas ner på en vit duk eller kartong, och sedan kan de insekter som hittas sugas upp.
- Fällor – Det finns många typer av fällor. En Berlese-tratt har en tratt med en skärm och en glödlampa på toppen, med alkohol i botten. Insekterna lockas till sig och faller sedan ner i den dödande burken. En ljusfälla kan vara effektiv mot vissa insekter, och kan vara så enkel som en lampa ovanför dödningsmedlet, eller en gå-fälla där insekterna sätter sig och kan samlas in för hand. Gropfällor kan användas för asätande skalbaggar eller andra icke-flygande insekter och är helt enkelt burkar med lockbete i botten. Insekterna faller i och kan inte fly. En enkel fälla kan vara en sockerlösning som sprids på en yta.
- Huvudlampa
- Skidkniv
Hantering av fångsten: Många insekter med mjuka kroppar kan placeras direkt i 70-90 % isopropyl- eller etylalkohol. Detta inkluderar larver och nymfer av många arter samt vissa mindre insekter. Hårdkroppade insekter bör läggas i en dödande burk. Hur lång tid det tar beror både på insekten och på avlivningsmedlet och kan variera från några minuter till några timmar. När insekten är död bör den avlägsnas så snart som möjligt för att förhindra ytterligare missfärgning. Dessa kan förvaras i pilleraskar eller i de papperskuvert som beskrivs ovan.
Relaxering: Om du inte kan nålla och sprida ett exemplar omedelbart kommer det troligen att torka. När det är i detta tillstånd är det ganska sprött och kommer att gå sönder om du försöker ordna det. För att åtgärda detta kan du antingen använda en avslappningskammare, avslappningsvätska eller koka insekten i vatten (detta kan dock skada den).
Avslappningskammare är behållare med våt sand eller tyg inuti. Helst ska karbolsyra tillsättas för att förhindra att det bildas mögel. Efter en dag eller två bör du kunna manipulera exemplaret igen.
Relaxeringsvätska kan tillverkas av olika blandningar, och vanligtvis låter du insekten ligga i den i flera minuter. En blandning, som ofta kallas Barbers vätska, finns listad nedan:
| 95% etylalkohol | 50 cm3 |
| Vatten | 50cm3 |
| Ethyl. acetat | 20cm3 |
| Bensen | 7cm3 |
En annan metod som kan användas är injektion av kranvatten. Detta fungerar på många fjärilar. Använd en 20-25 gauge nål och injicera vatten i thorax under vingen tills den är helt fylld. Efter 5-20 minuter ska insekten vara avslappnad.
Konservering i vätska: Detta kan användas på många insekter med mjuka kroppar (t.ex. majflugor, stenflugor, snytbaggar, etc.), som inte kan pinnas om de inte torkas på det sätt som nämns ovan. Det är också användbart för mycket små exemplar som ska studeras på mikroskopglas, samt för insektslarver och nymfer. Leddjur som inte är insekter bör också bevaras på detta sätt.
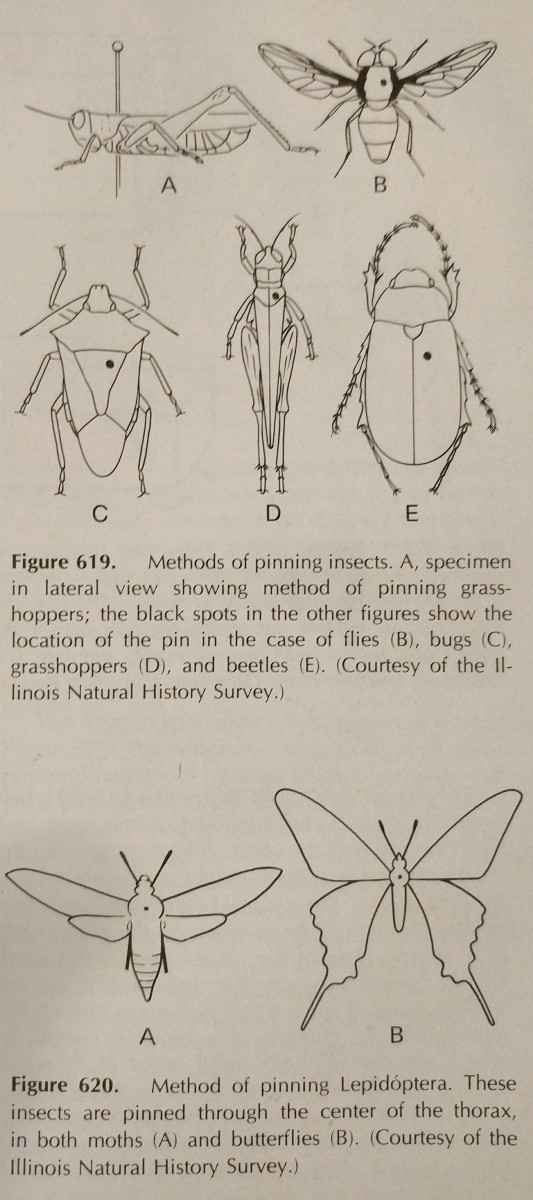
Pinning: Detta är det enklaste sättet att bevara en hårdkroppad insekt. Färgerna bleknar ofta när insekten torkar, men detta är dock svårt att undvika. Speciella insektsnålar bör användas, som är längre och inte rostar. Dessa finns i storlekarna 00-7, men de mindre kan vara mindre tillämpbara. Olika beställningar bör pinnas på olika ställen, vilket framgår av bilden. Benen ska vara utsträckta, liksom vingarna. Ofta har bina tungan utdragen för att underlätta identifiering.
Det är bäst om alla arter i en samling är pinnade på enhetliga avstånd. Ungefär 25 mm ovanför spetsen är idealiskt, och enhetliga avstånd kan lätt uppnås genom att använda ett stiftblock, som helt enkelt är ett träblock med hål borrade på olika djup.
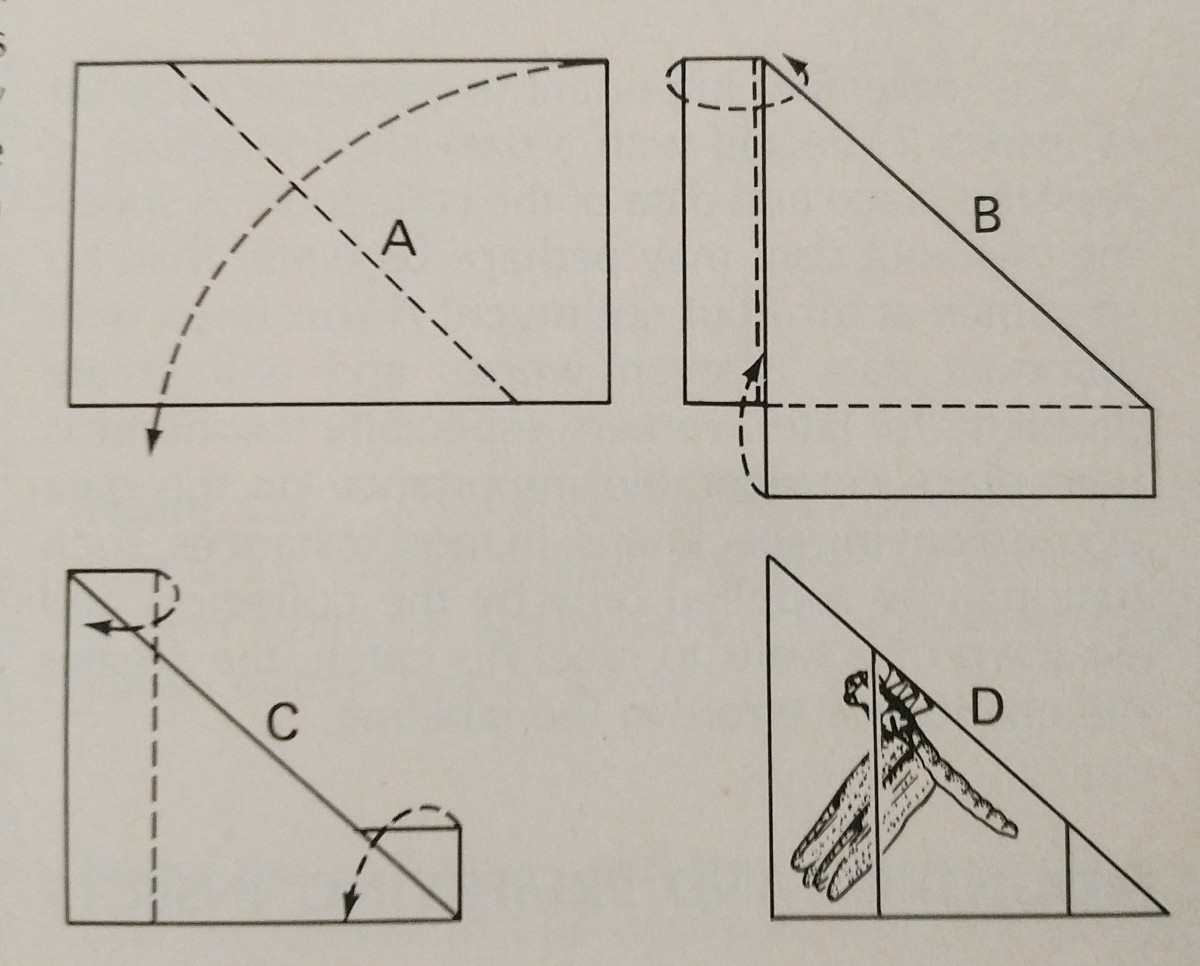
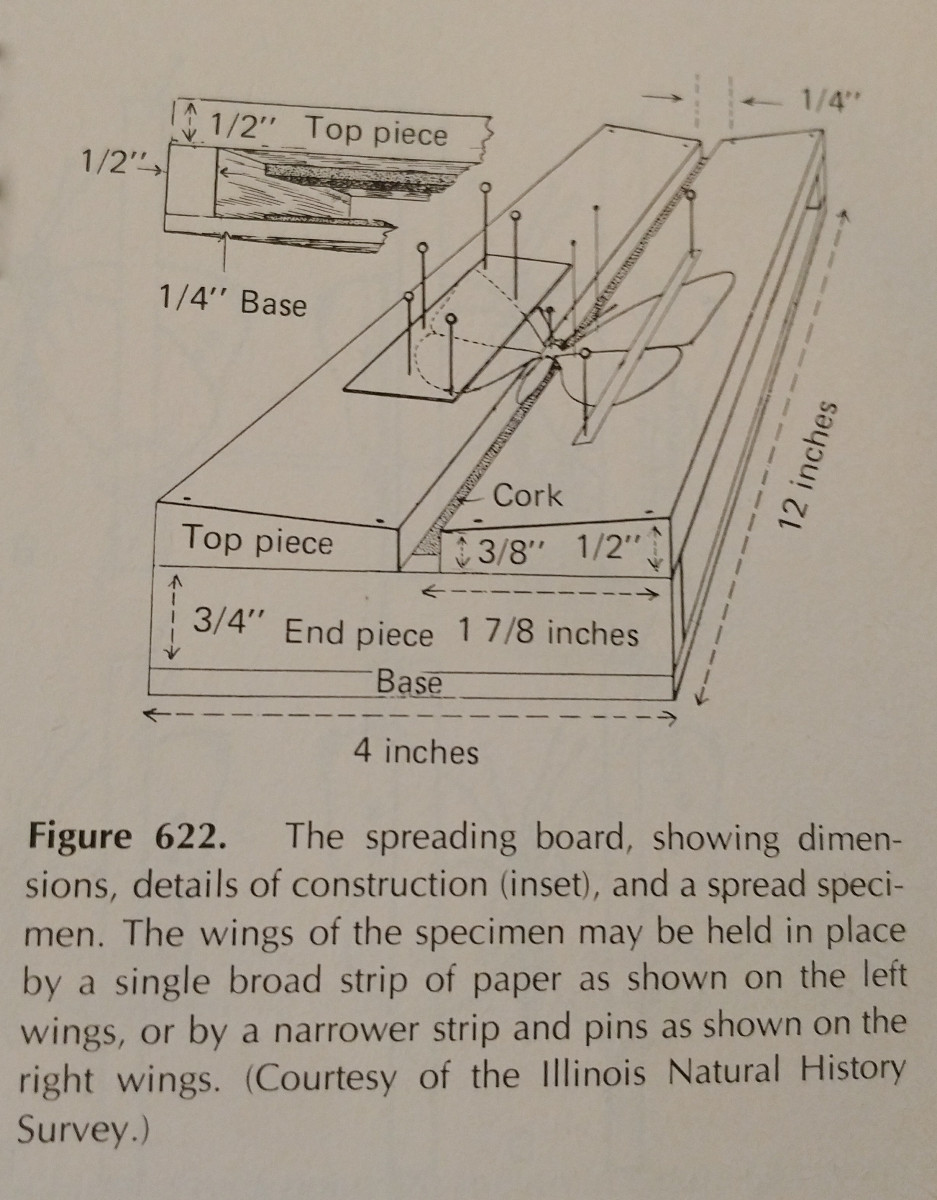
Spridning av en insekt handlar i hög grad om övning. Att använda en spridningsbräda gör uppgiften mycket lättare,
och att ha extra stift och pappersremsor är viktigt. Pinnar kan användas för att flytta runt lemmar och vingar.
Typiskt sett bör tryck utövas på den främre marginella vingevenen, särskilt hos Lepidoptera. Den bakre marginalen av en Lepidoptera’s vingar bör vara i rät vinkel med thorax, och bakvingarna uppåt så att det inte finns någon lucka mellan dem och framvingarna, som på bilden. Det är  viktigt att vara mycket försiktig och använda en pincett för att hantera insekterna. De är mycket ömtåliga, och ofta kan fjäll och antenn lätt slås av. Pappersremsor och nålar kan användas för att fästa vingarna, och då håller de sig på plats när de har torkat.
viktigt att vara mycket försiktig och använda en pincett för att hantera insekterna. De är mycket ömtåliga, och ofta kan fjäll och antenn lätt slås av. Pappersremsor och nålar kan användas för att fästa vingarna, och då håller de sig på plats när de har torkat.
Små insekter behöver lite uppfinningsrikedom för att monteras, och kan limmas fast på kartongspetsar, små nålar eller mikroskopiska objektglas. Det är bara att sätta fast kortspetsen, lägga en liten mängd lim på den och sedan limma fast insekten.
Torkning: Många pinnade insekter kan lufttorkas på en varm och torr plats. Större nattfjärilar kan behöva en torkskåp med en eller flera glödlampor inuti, och vissa stora exemplar kan till och med behöva få sina bukorgan borttagna. Det finns ingen definitiv tid det tar för ett exemplar att torka, men detta kommer med erfarenhet.
Mjukkroppade insekter kan frys- eller vakuumtorkas och sedan pinnas, för att skapa ett icke-fragilt, icke-missfärgat exemplar. Typiskt sett skulle de skrumpna, men detta steg gör dem tillräckligt torra för att stanna på en nål.
Typiskt sett används en etylalkohollösning. Några vanliga är listade nedan.
| Hoods lösning | |
| 70-.80 % etylalkohol | 95 cm3 |
| Glycerin | 5 cm3 |
| Kahles lösning | |
| 95 %. Etylalkohol | 30 cm3 |
| Formaldehyd | 12 cm3 |
| Glacialättiksyra | 4 cm3 |
| Vatten | 60 cm3 |
| Alkoholisk Bouin-lösning | |
| 80% etylalkohol | 150 cm3 |
| Formaldehyd | 60 cm3 |
| Glacial ättiksyra | 15 cm3 |
| Pitronsyra | 1g |
När vi ändå talar om lösningar, Etylacetat kan ofta vara ineffektivt på larver, så här är dödande medel som är tillräckliga:
| KAAD-blandning | |
| 95% etylalkohol | 70-100 cm3 |
| Kerosin (minska för larver med mjuka kroppar, t.ex. maskar) | 10 cm3 |
| Glacial ättiksyra | 20 cm3 |
| Dioxan | 10 cm3 |
| XA-blandning | |
| 95% etylacetat | 50 cm3 |
| Xylen | 50 cm3 |
Båda metoderna bör ta 1/2 – 4 timmar. Alla kända avdödningsmedel tar bort färg, särskilt grönt, tillåter och rött.
Typiskt sett bör konserverade exemplar inspekteras en eller två gånger per år, ifall någon vätska har avdunstat. Om så är fallet bör den bytas ut.
Montering på mikroskopglas: Det finns två typer av mikroskopfästen: permanenta och tillfälliga. De använder olika inkapslingsmedier, och vid tillfälliga inkapslingar återförs proverna vanligen till konserveringsmedium efter inkapslingen, där de kan förvaras på obestämd tid. Permanenta monteringar monteras en gång och kan sedan inte avlägsnas, men de kan hålla ganska länge, till och med flera år.
Många insekter med mjuka kroppar kan sättas direkt i monteringsmedium, men vissa måste först rensas i en speciell vätska. De viktigaste lösningarna som används för detta är KOH och Nesbitts lösning. Denna process innebär ofta att insekten får ligga i blöt i flera timmar till många dagar när den görs kallt, även om den kan göras snabbare med hjälp av värme och KOH.
Små exemplar kan monteras i ett vanligt objektglas, medan större exemplar kan behöva ett depressionsglas eller stöd för täckglaset.
De medier som används för tillfälliga objektglasmonteringar är vatten, alkohol, glycerin och glyceringelé. Vatten och alkohol kan bara hålla i några minuter innan de avdunstar, så glycerin används i allmänhet om exemplar vill studeras under en längre tid.
Det avslutar det här inlägget och avsnittet om konservering i Borror, Delong och Triplehorn. Det mesta av resten av arbetet med detta SOS kommer att bestå av att sammanställa mina dokument och diabilder samt att se till att mina flödesscheman och protokoll är i ordning.
