- Methodology
- Figur1:Imaging pathway
- Diagnostiskt tillvägagångssätt och inledande behandling
- Urincytologi
- Initiell avbildning hos lågriskpatienter
- Figur2:Transitional-cell-carcinoma-of-the-bladder-(US)
- Figur3:Renal transitional cell carcinoma (US and RPUG)
- Initial imaging in high-risk patients
- Figur4:Bladder-and-renal-TCC (CTU)
- Figur5:Bladder TCC (MRI)
- Figur6:Ureterisk TCC (CTU)
- Figur7:Blåsetumör (cystoskopi)
- Andra bildundersökningar
- Klinisk uppföljning
- Tabell2: Indikationer för remiss
Methodology
En elektronisk sökning från augusti-september 2015 i MEDLINE via PubMed och Cochrane Database of Systematic reviews identifierade relevanta originalartiklar, systematiska översikter och evidensbaserade riktlinjer från perioden 2008-september 2015, som inkluderades. Följande termer användes i kombination under litteraturgenomgången för att ta fram listan över granskade artiklar: ”painless”, ”macroscopic”, ”visible” AND ”haematuria”, ”kidneys”, ”ureters”, ”urinary bladder”, ”bladder cancer”, ”urinary tract”, ”cytology”, ”diagnostic imaging”, ”radiography”, ”ultrasonography”, ”ultrasound”, ”pyelography”, ”tomografi, röntgenkomputerad” OCH ”urografi”, ”magnetresonans” OCH ”urografi”, ”intravenös” ELLER ”exkretorisk” OCH ”urografi”, ”urologi” ELLER ”nefrologi” OCH ”remiss” ELLER ”konsultation”, ”cystoskopi”, ”riktlinjer”.
En manuell sökning för att identifiera andra relevanta publikationer från de hämtade studierna utfördes också för granskningen. Sammanlagt 84 artiklar i fulltext valdes ut i korthet och bedömdes för att vara stödberättigade. Artiklar som beskrev originalstudier, evidensbaserade riktlinjer eller systematiska översikter inkluderades, medan pediatriska studier och djurstudier uteslöts. Artiklar som inte var på engelska eller hade begränsad text exkluderades också, varefter 59 slutliga artiklar inkluderades och graderades enligt Oxford Centre for Evidence-Based Medicine Levels of Evidence . De evidensbaserade vägarna togs fram och granskades av DIP-redaktionens expertpanelmedlemmar (Diagnostic Imaging Pathways (DIP)) i enlighet med de vanliga DIP-processerna (http://www.imagingpathways.health.wa.gov.au/index.php/production/processes-for-creating-and-managing-content), i samråd med redaktören, en urolog och en nefrolog. Den slutliga algoritmen (figur 1) som också finns tillgänglig på Imaging Pathways (Online clinical decision-making tool: Dulku G. Painless Macroscopic Haematuria. Diagnostic Imaging Pathways; September 2015), ger vägledning och rekommendationer för bilddiagnostik för vuxna patienter med oförklarlig, smärtfri, synlig hematuri.
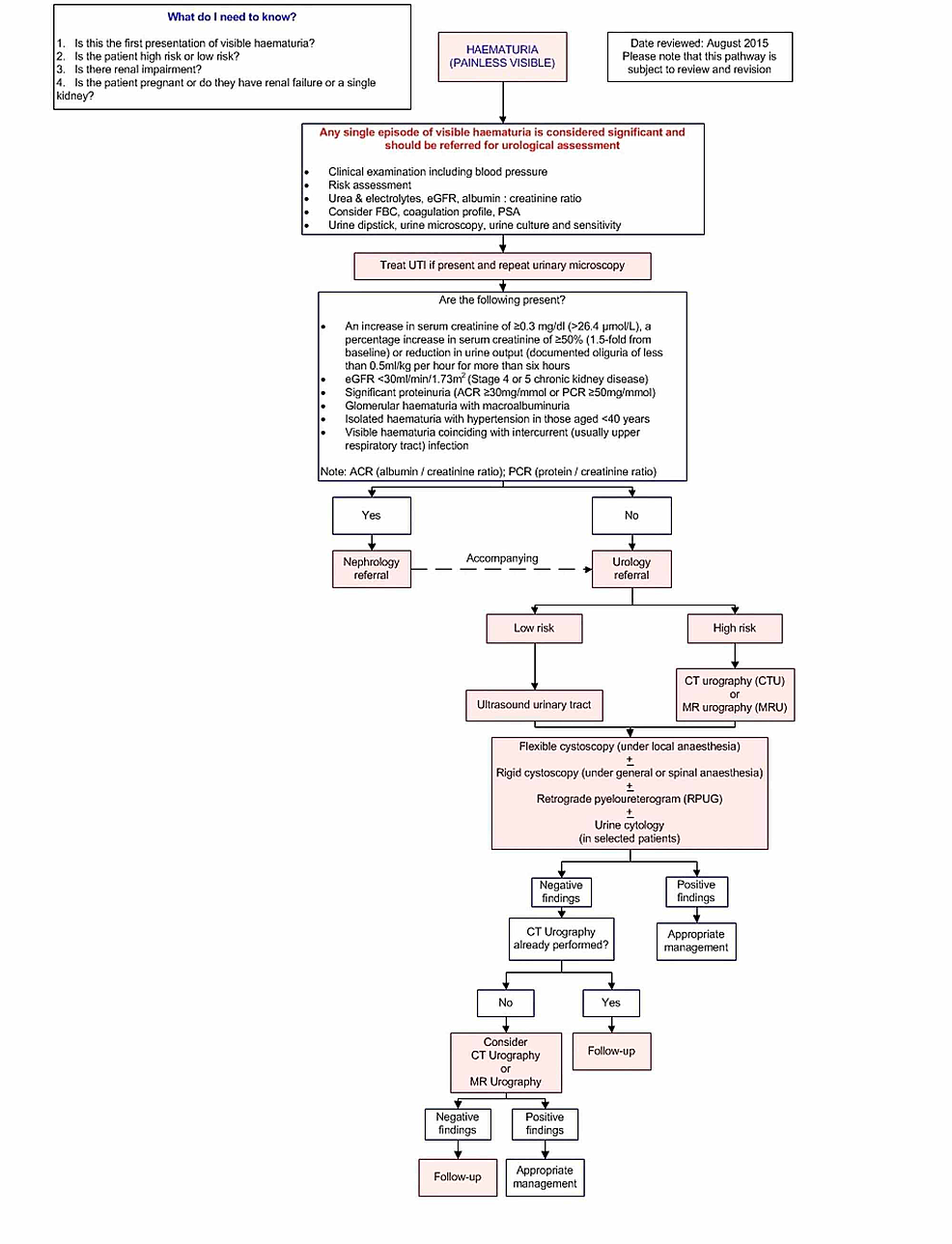
Figur1:Imaging pathway
Denna pathway ger vägledning om bilddiagnostik av vuxna patienter med oförklarlig smärtfri synlig hematuri.
eGFR: Skattad glomerulär filtrationshastighet; FBC: Fullständig blodstatus; PSA: Prostataspecifikt antigen; ACR: Kvot mellan albumin och kreatinin; PCR: UTI: Urinvägsinfektion.
Vår granskning omfattade inte en analys av vägledning för bilddiagnostik för att upptäcka urinvägskalk som en orsak till hematuri, eftersom detta vanligtvis är förknippat med smärta. Vårt fokus låg främst på vägledning för avbildning och stödjande litteratur för smärtfri synlig hematuri med urologiska maligniteter som en potentiell orsak.
Diagnostiskt tillvägagångssätt och inledande behandling
Konsensus från British Association of Urological Surgeons (BAUS) och Interregional Chiefs of Urology Service (IRCUS), Kaiser Permanente, Amerika föreslog att varje enskild episod av VH betraktas som signifikant och bör remitteras för urologisk bedömning, som i nästan alla fall kommer att innefatta cystoskopi .
I mellantiden kan undersökningar utföras för att identifiera övergående, behandlingsbara orsaker och ordna med primär avbildning. Patienter med VH och bevisad urinvägsinfektion (UTI) bör fortfarande undersökas med avseende på samtidig malignitet, eftersom malignitet ofta samexisterar med eller fungerar som en nidus för en infektion att sprida sig från . Urinvägsinfektion bör behandlas före cystoskopi eftersom det finns en risk för uro-sepsis om cystoskopi utförs i närvaro av aktiv UTI.
Närvaron av VH bör inte heller tillskrivas antikoagulerande eller trombocythämmande behandling och dessa patienter bör också utvärderas oberoende av dessa mediciner, eftersom rapporter om underliggande malignitet hittades hos 24 % och 7 % av patienterna i två separata serier .
Därmed är bilddiagnostikens primära roll att identifiera de patienter som har en malign orsak till hematuri. Valet av avbildningsmodalitet är dock beroende av olika individuella patientfaktorer (t.ex. ålder, riskfaktorer för malignitet, njurfunktion och graviditet) och andra faktorer, t.ex. lokal policy och praxis, kostnadseffektivitet och tillgång till resurser .
Traditionsenligt har förstalinjeundersökningar innefattat konventionell röntgen, ultraljud (US) av njurarna och/eller intravenöst pyelogram (IVP) i kombination med cystoskopi. Det sistnämnda är viktigt eftersom många blödande urinvägslesioner uppstår i urinblåsan och det ännu inte slutgiltigt har bevisats att avbildningsförfaranden är lika känsliga som cystoskopi när det gäller att diagnostisera de flesta av dem .
Sekundärundersökningar har inkluderat multi-detector computed tomography urogram (MDCTU) och magnetisk resonansurografi (MRU), som ofta endast utförs om de första undersökningarna avslöjar en abnormitet.
IRCUS har rekommenderat att en modifierad CTU eller IVP med samtidig renal US ska utföras för patienter med signifikant hematuri. Det finns inget behov av njurtomografi vid intravenös urografi (IVU) om en samtidig renal US utförs. Detta tillvägagångssätt minskar exponeringen för joniserande strålning.
När Cowan rekommenderade bildbehandling för utvärdering av VH föreslog Cowan att typen av bildbehandling skulle baseras på en riskpoäng där patienter >40 år skulle genomgå CT-urografi, medan patienter <40 år skulle genomgå ultraljud som förstahandsmetod för bildbehandling. European Society of Urogenital Radiology (ESUR) har föreslagit att utredning av lågriskpatienter kräver ultraljud och cystoskopi och att högriskpatienter kräver CTU och cystoskopi för grundlig avbildning av njurar och urinvägar .
Urincytologi
Urincytologi är, även om den är kontroversiell, nödvändig för utvärdering av urothelialcellkarcinom i övre urinvägarna (UUT-UCC) och riktlinjerna från European Association of Urology (EAU) rekommenderar att urincytologi bör utföras som en del av den diagnostiska standardutredningen . Urincytologi har en sensitivitet på 25 %, en specificitet på 91 %, ett högt positivt prediktivt värde men ett lågt negativt prediktivt värde .
Urincytologi har dock en hög falskt negativ frekvens när det gäller upptäckt av malignitet och en negativ cytologi kan aldrig helt utesluta närvaron av en tumör i urinblåsan, cystoskopi är motiverat i alla fall.
Antal kommersiellt tillgängliga urintester för urinburna biomarkörer inkluderar BTA TRAK, ImmunoCyt/uCyt+, CxBladder, Nuclear Matrix Protein 22 (NMP-22) och UroVysion (FISH), även om dessa kan missa en betydande andel av patienterna med urinblåsecancer, särskilt då dess noggrannhet är dålig för tumörer med lågt stadie och låg grad . Av dessa skäl uppnåddes ingen konsensus om den roll som urincytologi och/eller tumörmarkörer i urinblåsan spelar i utvärderingen av patienter med hematuri .
Initiell avbildning hos lågriskpatienter
ESUR hade föreslagit att utredningen av lågriskpatienter kräver US och cystoskopi och att högriskpatienter kräver CTU och cystoskopi för en grundlig avbildning av njurarna och urinvägarna . Känsligheten hos US är dock inte tillräcklig för att eliminera behovet av cystoskopi på grund av dess bristande känslighet när det gäller att upptäcka små tumörer i urinblåsan, särskilt de som är mindre än 0,5 cm i diameter .
Ultraljud (US) är viktigt vid den första bedömningen av hematuri och förutom att det är lättillgängligt och billigt, innebär det ingen exponering för joniserande strålning och är särskilt användbart i strålningskänsliga befolkningsgrupper, t.ex. barn och gravida eller kvinnor i barnafödande ålder. Ultraljudet möjliggör också ett obegränsat antal skanningsytor, vilket gör att njurarna och urinblåsan kan visualiseras på ett bra sätt. Dopplerstudier kan dessutom ge ytterligare information om massornas vaskularitet (figur 2A, 2B).
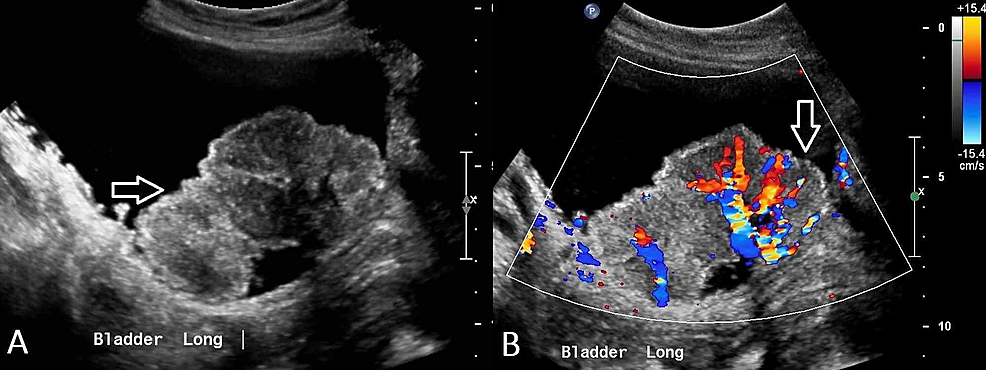
Figur2:Transitional-cell-carcinoma-of-the-bladder-(US)
(A) Ultraljud på bäckenet visar en oregelbunden, heterogen inom urinblåsan med flera mindre polypoida lesioner som ses i anslutning till, vilket tyder på cancer i urinblåsan. (B) Vaskularitet påvisas inom denna massa.
I samband med upptäckt av UUT-tumörer har US en varierande känslighet vid upptäckt av urothelialkarcinom, med måttlig känslighet (82 %) för upptäckt av njurcellskarcinom och låg känslighet (12 %) för upptäckt av urothelialkarcinom i urinledaren . Jämfört med IVP vid upptäckt av avvikelser i UUT hos patienter som uppvisar hematuri är dock US känsligare vid upptäckt av njur- och blåsetumörer, med högre sensitivitet (96 % jämfört med 25 %) och högre negativt prediktivt värde (98 % jämfört med 91 %) .
Fortfarande är US också användbart för att upptäcka hydronefros och/eller hydroureter, som kan vara en följd av blåsetumörer som blockerar den vesiko-ureteriska korsningen (figur 3). Jämfört med tvärsnittsbilder som MDCTU eller MRU har US dock en lägre känslighet när det gäller att upptäcka avvikelser i urinvägarna.
Ultraljud är utmärkt när det gäller att avgöra om en massa är cystisk eller inte och om en cystisk lesion är en enkel cysta eller minimalt komplicerad eller komplicerad. Lesioner som inte är enkla cystor kräver ytterligare utredning med CT eller MRT. Kontrastförstärkt US (CEUS) är ett lovande alternativ vid den inledande utredningen av njurmassor. De rapporterade resultaten av CEUS vid utvärdering av misstänkta solida eller komplexa cystiska massor tyder på att CEUS har ett liknande värde som CT. CEUS har fördelarna att det inte är nefrotoxiskt, att det inte finns någon joniserande strålning och att man kan utvärdera förstärkningsmönstret i realtid – och detta kan göras vid den första undersökningen av patienten. CEUS:s plats i den diagnostiska algoritmen behöver dock klargöras ytterligare.
Därmed verkar det motiverat att använda US som förstahandsmetod vid bedömning av hematuri. Med tanke på att enbart ultraljud potentiellt kan missa ureterala och uroteliska lesioner är ytterligare utvärdering med cystoskopi nödvändig, medan retrograd pyelo-ureterografi är ett användbart komplement (figur 3) .
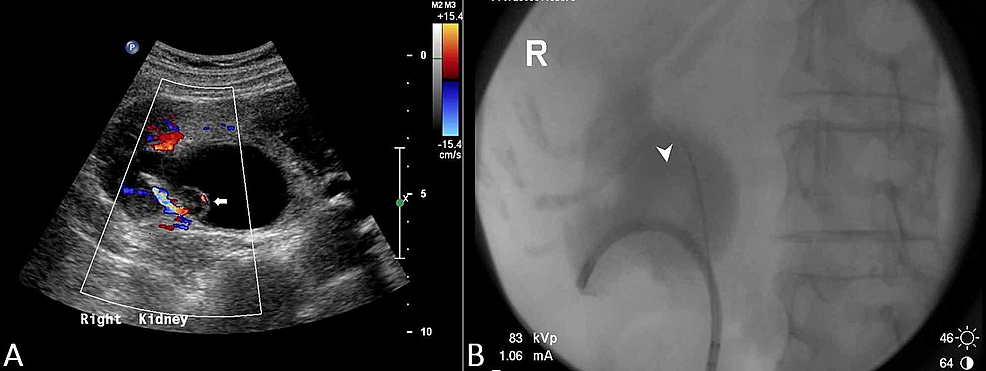
Figur3:Renal transitional cell carcinoma (US and RPUG)
(A) Ultraljud bäcken visar en diffust förtjockad proximal höger urinledare med en papillär lesion (pil) som ses inom det högra njurbäckenet, och resulterande höger hydronefros. (B) Detta motsvarar fyndet i det retrograda pyelo-ureterogrammet (RPUG) (pilhuvud) som tyder på ett obstruerande höger övre urinrörs övergångscellkarcinom.
Initial imaging in high-risk patients
CT Urography
CT urography (även kallad CT IVP även om CTU är den föredragna termen) överträffar US, IVU, och röntgen vid utvärdering av njurparenkymala massor och urinvägskalk med en sensitivitet och specificitet för maligniteter i övre urinvägarna på 67-100 % respektive 93-99 % .
Den optimala diagnostiska strategin för att utreda patienter med hög risk efter att ha uteslutit UTI är en kombinerad strategi med CTU och flexibel cystoskopi . Patienter med lesioner som överensstämmer med blåscancer på CTU bör hänvisas direkt till rigid cystoskopi och på så sätt undvika flexibel cystoskopi med en fördel av en 17-procentig minskning av antalet utförda flexibla cystoskopier .
För alla andra patientkategorier, inklusive yngre patienter och patienter med mer godartade indikationer och lägre sannolikhet för cancer före testet, är US den första bilddiagnostiska modaliteten . Modifieringar av undersökningstekniken för CT-urografi, bestående av begränsade protokoll och kombinationer av skanningsfaser, skulle kunna användas som alternativ eller komplement till de andra avbildningstesterna .
Scanningsprotokollet bör omfatta: kontrastfri skanning, nefrografisk (90-100 sekunder efter kontrastbolus) och exkretorisk (eller pyelografisk) fas (5-15 minuter efter kontrasttillförsel) . En kortiko-medullär fas är användbar i utvalda fall, t.ex. om pseudoaneurysm eller pseudotumör misstänks. Rutinmässig registrering under denna fas kanske inte är motiverad . De kontrastfria bilderna är användbara för att upptäcka njursten. Den nefrografiska fasen har den högsta känsligheten när det gäller att upptäcka njurmassor, och korrelation med oförstärkta bilder krävs för att visa otvetydig förstärkning. Den pyelografiska/exkretoriska fasen används för att bedöma det samlande systemet, urinledarna och urinblåsan med användning av ureterdistorsionstekniker som kompression, intravenös saltlösning och diuretika, som alla ger varierande resultat. CT-urografi kan också upptäcka sjukdomar utanför urinvägarna.
I motsats till uroteliala tumörer förblir många patienter med malignitet i njurarna symtomfria fram till sena stadier av sjukdomen, med tanke på att den stora majoriteten av njurcancer är små och upptäcks oavsiktligt. Dessutom invaderar njurmassor sällan i kollektorsystemet. Den klassiska triaden med smärta i flanken, hematuri och en palpabel abdominell njurmassa vid njurcellscancer (RCC) förekommer därför hos högst 6-9 % av patienterna, och när den finns tyder den starkt på lokalt avancerad sjukdom och dålig prognos. Här rekommenderas CT och MRT som båda är likvärdiga för stadieindelning och diagnostik (figurerna 4 och 5). Man väntar dock på jämförande studier mellan CT och högfälts-MRI. Under tiden kan MRT användas i utvalda fall för problemlösning. Diffusionsviktad MRT (DWI) kan också vara användbar vid upptäckt och karakterisering av lesioner, men systematiska undersökningar visar på endast måttlig noggrannhet .
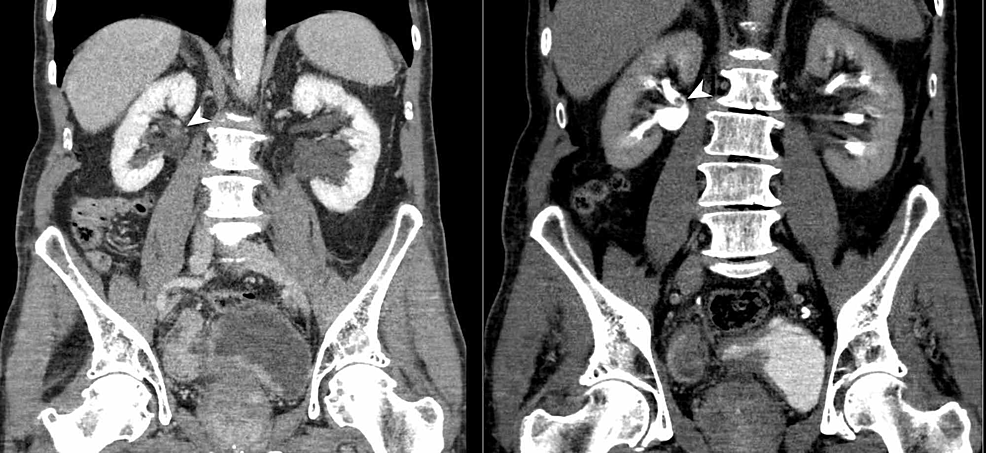
Figur4:Bladder-and-renal-TCC (CTU)
CT-urografi (koronalt reformat) visar en oregelbunden förtjockning av urinblåseväggen och även ett ojämn polypoid fyllnadsdefekt i den bakre aspekten av höger njurbäcken (pilhuvuden). Fynden tyder på multifokalt urinvägsövergångscellkarcinom (TCC).
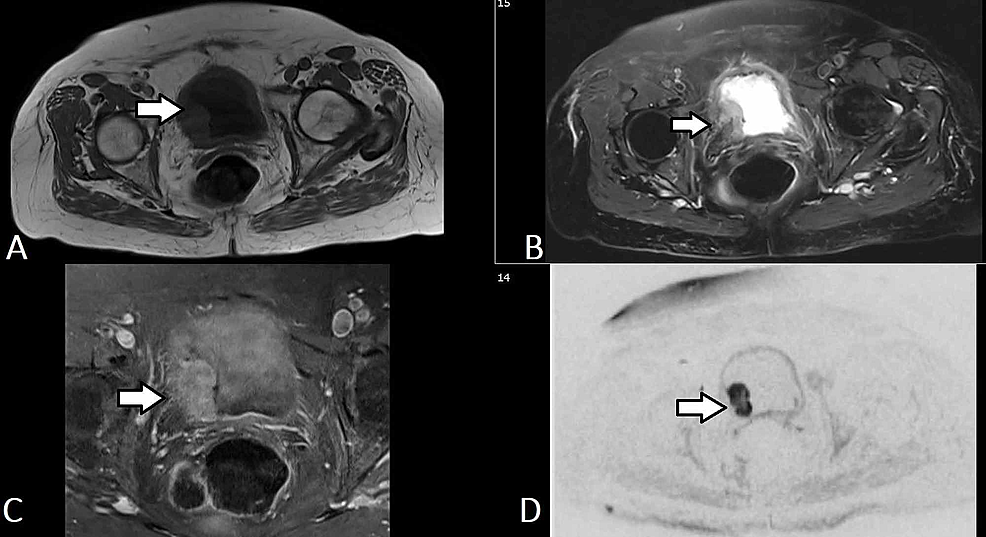
Figur5:Bladder TCC (MRI)
(A-D) Utvalda axiella MR-urografibilder från samma patient visar en lobulerad massa (pil) som utgår från urinblåsans högra sidovägg och som sträcker sig till trigonen och invaderar urinblåsans vägg för att involvera det yttre skiktet utan att sträcka sig in i det perivesikala fettet. Massan har låg T1-signalintensitet och hög T2-signalintensitet. Massan uppvisar en relativt homogen, diffus kontrastförstärkning och en framträdande diffusionsbegränsning (b50/400/800). Konstellationen av fynd återspeglar en blåsetumör som troligen klassificeras som T2b No Mx.
TCC: Transitional cell carcinoma
Bosniak-klassificeringen av cystiska njurmassor baseras på avbildningsegenskaper vid kontrastförstärkt datortomografi och är till hjälp för att förutsäga risken för malignitet och för att ge vägledning i hanteringen. Risken för malignitet för Bosniak 1, 2, 2F, 3 och 4 cystiska lesioner är 0 %, 0 %, 25 %, 54 % respektive 100 % .
CT-urografi kan också vara effektiv vid diagnos av blåsetumörer. Resultaten kan dock skilja sig åt beroende på den specifika population som studeras. I högriskgruppen var otvetydiga CTU-resultat 93 % känsliga och 99 % specifika för upptäckt av blåscancer med ett övergripande negativt prediktivt värde (NPV) på 95 %. CTU:s höga NPV kan göra det möjligt att undvika cystoskopi hos dessa utvalda patienter, även om cystoskopi förblir den gyllene standarden när det gäller upptäckt av tumörer i de nedre urinvägarna, inklusive urotheliala tumörer i urinblåsan, eftersom varken IVP eller MDCTU konsekvent har en känslighet som är tillräckligt stor för att utesluta avvikelser i slemhinnan i urinblåsan.
Strålningsdoser är ett problem vid MDCTU och detta kan minskas genom att begränsa antalet avbildningsfaser genom användning av dual-energy CT (DECT) eller split-bolus-teknik . Dessutom leder (25) utelämnande av den icke-förstärkta förvärvet till en minskning av strålningsexponeringen med nästan 50 % .
DECT ger information om hur ämnen beter sig vid olika energier, förmågan att generera virtuella icke-förstärkta dataset och förbättrad upptäckt av jodinnehållande ämnen på lågenergibilder . Andra fördelar med DECT är god tidsmässig och rumslig registrering och god spektral separation mellan hög- och lågenergiskanningar lätt att utjämna dos och brus . En prospektiv studie visade att DECT-urografi i en fas med synkron nefrografisk-exkretorisk fasförbättring utgör en exakt ”allt-i-ett”-metod med en stråldosbesparing på upp till 45 % jämfört med ett standardprotokoll med dubbla faser med god opakifiering i 86 .9 % av fallen och utmärkta eller goda virtuella oförstärkta bilder (VUE) i 83,3 % av fallen .
Å andra sidan ger split-bolus MDCTU minst 50 % opakifiering av majoriteten av UUT-segmenten med en hög känslighet (88.9-100 %), specificitet (99-99,5 %) och noggrannhet (98,5-99,5 %) för upptäckt av tumörer i övre urinvägarna (figur 6) .
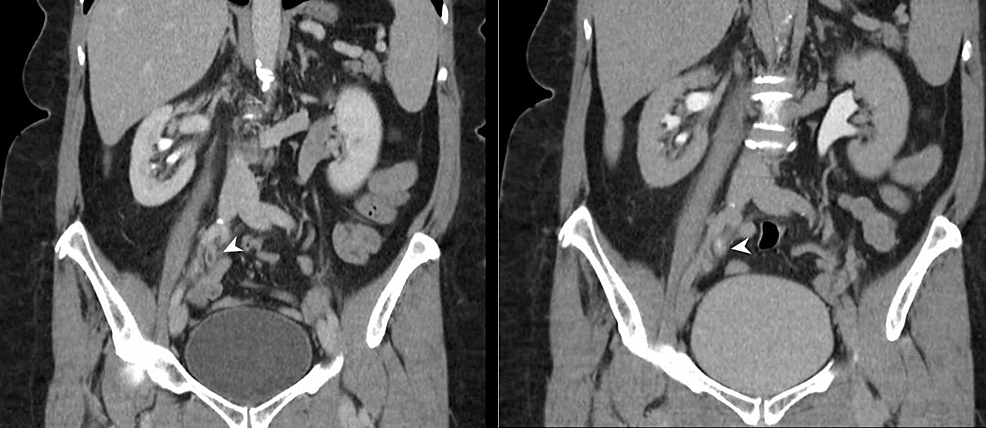
Figur6:Ureterisk TCC (CTU)
CT-urografi (koronala omformateringar) visar ett 4 cm stort segment med circumferentiell urotelförtjockning vid korsningen mellan den mellersta och distala högra uretern (pilhuvuden) med onormal urotelförstärkning. Det finns en sekundär obstruktion av det högra samlingssystemet med övergångspunkten noterad på nivån för den onormala uroteliska förtjockningen, vilket är mycket misstänkt för en högersidig urotelisk TCC.
TCC: Transitional cell carcinoma
Magnetisk Resonans Urografi
Magnetisk resonanstomografi är användbar vid diagnos och stadieindelning av maligniteter i njurarna, urinblåsan och prostatakörteln och vid bedömning av njurfunktionen. Den fungerar som en alternativ avbildningsteknik för den strålningskänsliga befolkningen, inklusive barn och gravida kvinnor, de som behöver upprepade undersökningar av urinvägarna och de som är kontraindicerade för jodhaltiga kontrastmedel.
Ett komplett MRU-protokoll kan användas för att avbilda alla delar av njurarna och urinsamlingssystemet vid en enda avbildningssession. MR-urografi utförs med två huvudmetoder: statisk-fluidurografi med ultrasnabba T2-viktade sekvenser, liknande dem som används för magnetresonanskolangiopankreatografi (MRCP), och T1-viktade sekvenser av utsöndringsurografi efter intravenös gadoliniumkontrasttillförsel .
Statisk-fluid MRU är att föredra framför excretorisk MRU vid avbildning av patienter med nedsatt njurfunktion, gravida patienter och patienter med ureterobstruktion, särskilt när det finns en rimlig risk för nefrogen systemisk fibros . Med tanke på att de T2-viktade sekvenserna utförs utan intravenös kontrasttillförsel är det dock ofta nödvändigt att göra ändringar i avbildningen för att optimera avbildningen av urinledaren.
Avbildningen av urinledaren kan också förbättras, särskilt vid exkretorisk MRU, efter administrering av intravenöst kontrastmedel, koksaltlösning och ett diuretikum för att uppnå en mer jämn kontrastfördelning . Även om bevisen visar att DWI endast uppvisar en måttlig noggrannhet när det gäller att förutsäga malignitet i njurarna, är dess prestanda som ett oberoende test fortfarande obeprövad . Tillägget av DWI till T1- och T2-viktade bilder ökar känsligheten vid identifiering av UUT-cancer med utmärkt överensstämmelse mellan observatörerna. Särskilt kombinationen T2WI+DWI uppvisar en känslighet på 92-98 % för att diagnostisera blåstumörer (figur 5).
Nackdelar med MRU är bland annat kostnad, tillgänglighet, längre förvärvstid, bilddegradering på grund av rörelseartefakter, lägre rumslig upplösning och diagnostisk tillförlitlighet när det gäller upptäckt av malignitet i urotheliala system jämfört med CTU. Utvecklingen av snabbare sekvenser och optimering av 3-T MRI-protokoll förväntas dock lösa dessa problem .
Cystoskopi
Cystoskopi är fortfarande den bästa metoden för utvärdering av urinblåsan och bör inte ersättas av någon excretorisk avbildningsteknik . I de senaste EAU-riktlinjerna rekommenderas också att cystoskopi bör utföras för att utesluta samtidig blåsetumör (figur 7) när cancer i urinblåsan diagnostiseras, särskilt när författare har visat på anmärkningsvärda falskt positiva och falskt negativa resultat vid CTU och MRU vid upptäckt av blåsetumörer jämfört med histopatologi hos patienter med synlig hematuri . En cystoskopi bör utföras på praktiskt taget alla patienter med smärtfri synlig hematuri .
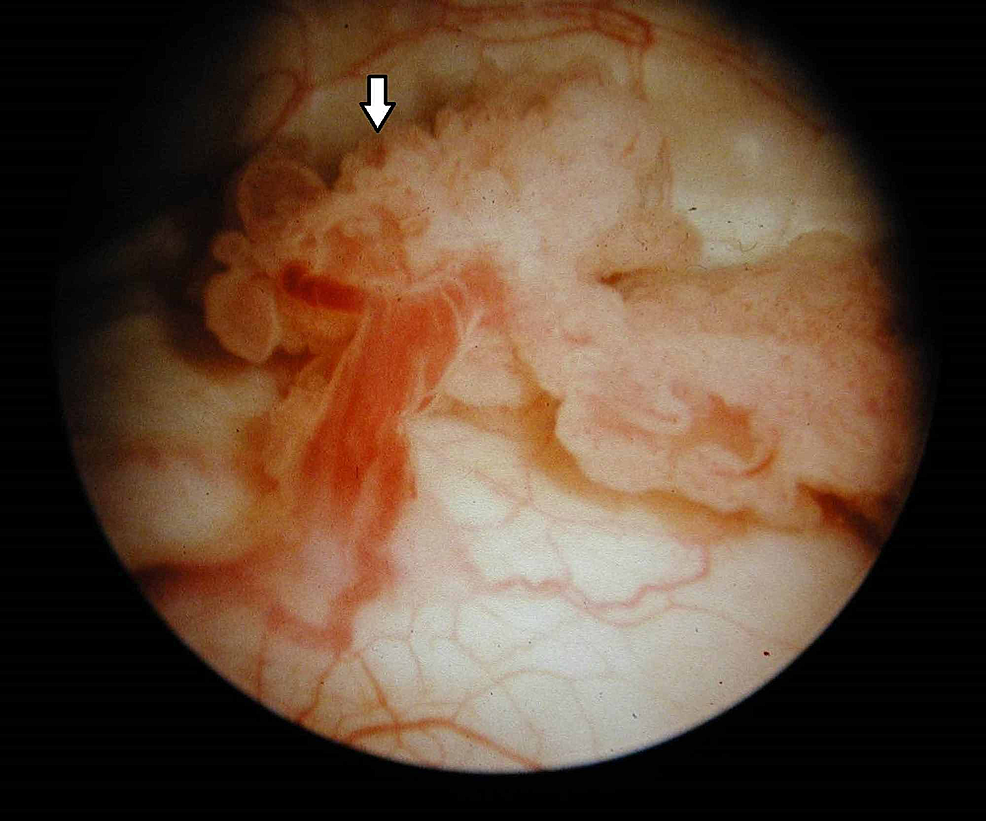
Figur7:Blåsetumör (cystoskopi)
Cystoskopi avslöjar en exofytisk, blomkålsliknande utväxt med känsliga fransar och områden med ulceration i enlighet med en malignitet i urinblåsan (pil).
Flexibel cystoskopi är ett enkelt, snabbt och säkert förfarande som utförs under lokalbedövning som ett dagsfall med tillförlitlig trygghet och som gör det möjligt för operativa patienter att diagnostiseras och förberedas för sin operation vid samma besök .
Däremot utförs rigid cystoskopi under allmän- eller ryggmärgsbedövning, i synnerhet när mer komplexa ytterligare ingrepp är förväntade. Ett retrograd pyelo-ureterogram (RPUG) kan utföras vid tidpunkten för rigid cystoskopi för att avbilda de övre kanalerna om CTU inte redan har utförts .
Andra bildundersökningar
Retrograd pyelo-ureterografi
CT-urogram har visat sig ha en större diagnostisk noggrannhet än RPUG för upptäckt av urothelial lesion . Därför är det motiverat att CTU bör användas före RP, som ett enda, icke-invasivt och omfattande test som möjliggör samtidig diagnos och/eller stadieindelning.
Retrograd pyelografi kan fortfarande användas som en andrahandsutredning för att ytterligare karakterisera fyllnadsdefekter som upptäcks på andra modaliteter, icke-diagnostiska CTU, eller hos patienter med njursvikt eller fall av kontrastmedelsallergi. Retrograd pyelo-ureterografi kan endast visa urinledarens lumen och kan inte direkt avbilda extrinsiska avvikelser (figur 3) .
Plain Radiography of the Kidneys, Ureters and Urinary Bladder (Plain X-ray KUB)
Plain X-ray KUB är för närvarande av ringa värde vid utredning av patienter med smärtfri hematuri och används inte som första linjens bildmodalitet .
Excretory Urography/Intravenous Urography (IVU)
Intravenous urography is a good choice in evaluating urothelial and intraluminal disease but is not sufficiently sensitive for detecting renal masses <2-3 cm in size and has now been replaced by CTU for imaging the UUT . Undersökning av hematuri hos högriskpatienter med enbart IVU förespråkas inte längre.
Dess främsta fördel är att IVU avbildar hela UUT med hög rumslig upplösning och även ger strukturell information samt begränsade funktionella data. Det är ofta det mest kostnadseffektiva testet på många centra .
Nackdelar med IVU är dock lång förvärvstid, potentiellt farliga kontrastreaktioner, som kräver tarmförberedelser och exponering för en märkbar strålningsbelastning. Dess relativa inexakthet är dess största brist och kommer snart att vara föråldrad .
Klinisk uppföljning
Det finns en risk att 1-3 % av patienterna med en negativ utredning utvecklar malignitet inom tre år om de lämnas okontrollerade . American Urological Association (AUA) best policy panel rekommenderar att primärvårdsläkare kontrollerar VH, nya urinsymtom och positiv cytologi var sjätte månad i tre år och om fynden är konsekvent negativa då kan uppföljningen upphöra . BAUS rekommenderar att en ny remiss till urologin är nödvändig om VH eller symtomatisk icke synlig hematuri (NVH) utvecklas under primärvårdens uppföljning, vars varaktighet inte var klart definierad . Best Practice Advocacy Centre New Zealand har rekommenderat årlig övervakning av nefrologiska orsaker med urinprov, blodtryck, eGFR och förhållandet mellan albumin och kreatinin/protein och kreatinin i urinen (ACR/PCR) så länge hematuri kvarstår, och årligen under två år för urologiska orsaker med urinprov, eGFR, ACR/PCR och cytologi i urinen. Detta initiativ gör det möjligt för primärvården att följa upp patienterna och ge dem trygghet när de oroar sig för pågående hematuri som kan vara intermittenta men som kvarstår trots en negativ undersökning. Indikationen för remiss till nefrologi och urologi sammanfattas i tabell 2 .
Referens till nefrologi
En ökning av serumkreatinin på ≥0.3 mg/dl (>26,4 µmol/L), en procentuell ökning av serumkreatinin på ≥50 % (1,5 gånger från baslinjen) eller minskad urinproduktion (dokumenterad oliguri på mindre än 0.5 ml/kg per timme i mer än sex timmar
Signifikant proteinuri (ACR ≥30 mg/mmol eller PCR ≥50 mg/mmol) utöver hematuri väcker misstanke om intrinsisk njursjukdom
Glomerulär hematuri med makroalbuminuri
Isolerad hematuri (dvs, i avsaknad av betydande proteinuri) med hypertoni hos personer i åldern <40 år
Synlig hematuri som sammanfaller med en pågående infektion (vanligen i de övre luftvägarna)
Urologisk remiss
Synlig hematuri hos alla patienter (oberoende av ålder)
Patienter med symtomatisk icke-synlig hematuri i avsaknad av urinvägsinfektion eller andra övergående orsaker (oavsett ålder)
Manliga patienter med asymtomatisk icke synlig hematuri
Alla patienter med asymtomatisk icke synlig hematuri och andra riskfaktorer
Tabell2: Indikationer för remiss
† Förekomst av dysmorfiska röda blodkroppar, proteinuri, cellutgjutningar och/eller njurinsufficiens, eller någon annan klinisk indikator som misstänks för njurparenkym-sjukdom motiverar samtidig nefrologisk utredning men utesluter inte behovet av urologisk utvärdering.
‡ Kvinnor med asymtomatisk icke synlig hematuri i åldern <40 år behöver inte remitteras till urolog.
