A forma longa comummente utilizada da tabela periódica foi concebida para enfatizar as configurações dos electrões. Como são os elétrons mais externos (valência) que estão principalmente envolvidos nas interações químicas entre os átomos, o último elétron adicionado a um átomo no processo de construção é muito mais interessante para um químico do que o primeiro. Este último elétron é chamado de elétron distintivo porque distingue um átomo daquele que o precede na tabela periódica. O tipo de subconcha (s, p, d, f)em que o elétron distintivo é colocado está muito relacionado com o comportamento químico de um elemento e dá origem à classificação mostrada pelo código de cores na tabela periódica aqui vista. Os elementos representativos são aqueles em que o elétron distintivo entra na subcasa ans ou p. A maioria dos elementos cuja química e valência discutimos até agora se enquadram nesta categoria. Muitas das propriedades químicas dos elementos representativos podem ser explicadas com base nos diagramas de Lewis. Ou seja, as valências dos elementos representativos podem ser previstas com base no número de elétrons de valência que eles têm, ou com base no número de elétrons que teriam que ser adicionados para atingir a mesma configuração eletrônica que um átomo de um gás nobre. Para elementos representativos o número de elétrons de valência é o mesmo que o número do grupo periódico, e o número necessário para corresponder à próxima configuração de gás nobre é 8 menos o número do grupo. Isto concorda com as regras de valência derivadas da tabela periódica, e resulta em fórmulas para cloretos da primeira dúzia de elementos que mostram a variação periódica da valência.
| Element | Peso Atómico | Compostos de Hidrogénio | Compostos de Oxigénio | Compostos de Cloro |
|---|---|---|---|---|
| Hidrogénio | 1.01 | H2 | H2O, H2O2 | HCl | Helium | 4.00 | Nenhum formado | Nenhum formado | Nenhum formado | Lithium | 6.94 | LiH | Li2O, Li2O2 | LiCl | Beryllium | 9.01 | BeH2 | BeO | BeCl2 |
| Boro | 10.81 | B2H6 | B2O3 | BCl3 | Carbono | 12.01 | CH4, C2H6, C3H8 | CO2, CO, C2O3 | CCl4, C2Cl6 |
| Nitrogénio | 14.01 | NH3, N2H4, HN3 | N2O, NO, NO2, N2O5 | NCl3 |
| Oxygen | 16.00 | H2O, H2O2 | O2, O3 | <Cl2O, ClO2, Cl2O7 | Fluorine | 19.00 | HF | OF2, O2F2 | ClF, ClF3, ClF5 |
| Neon | 20.18 | Nenhum formado | Nenhum formado | Nenhum formado | Sódio | 22.99 | NaH | Na2O, Na2O2 | NaCl | Magnésio | 24.31 | MgH2 | MgO | MgCl2 |
As três primeiras linhas ou períodos horizontais da tabela periódica moderna consistem inteiramente de elementos representativos. No primeiro período os elétrons distintivos para H e He estão na sub-camada 1s. Durante o segundo período Li e Be têm elétrons distintivos na subesfera 2s, e os elétrons estão sendo adicionados à subesfera 2p nos átomos de B a Ne. No terceiro período, a sub-camada 3s está preenchendo para Na e Mg e, portanto, Al, Si, P, S, Cl, e Ar. Como regra geral, no caso dos elementos representativos, o elétron distintivo estará em uma subesfera de ns ou np. O valor de n, o número quântico principal para o elétron distintivo, pode ser determinado rapidamente através da contagem regressiva a partir do topo da tabela periódica. Por exemplo, o iodo é um elemento representativo no quinto período. Portanto, o elétron distintivo deve ocupar ou a subcasa 5s ou 5p. Como eu estou no lado direito da tabela, 5p é a escolha correta.
Quando o número quântico principal é três ou mais, também são possíveis as subcasas do tipo d. Os elementos de transição ou metais de transição são aqueles elementos cujo elétron distintivo é encontrado em um orbital d. Os primeiros exemplos de metais de transição (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn) são encontrados no quarto período, embora o elétron distintivo em cada caso seja um elétron 3d e pertença à terceira casca. Este hiato resulta, como já vimos, porque o 4s é menor em energia do que o 3d. O orbital dos 4s começa assim a encher-se, começando o quarto período antes de qualquer um dos orbitais 3d poder ser ocupado.
Figure {1}(PageIndex{1}) compara as distribuições de probabilidade de um electrão 4s e de um electrão 3d num átomo V. Embora a nuvem de electrões 4s esteja mais afastada do núcleo em média do que a nuvem 3d, uma pequena porção da densidade de electrões 4s encontra-se muito próxima do núcleo onde dificilmente está protegida da carga nuclear total de +23. É a força atractiva muito forte desta pequena fracção da densidade total de electrões 4s que baixa a energia do electrão 4s abaixo da do 3d.
_and_4s_(color)_Electron_Clouds.jpg?revision=1)
O fato da nuvem de elétrons 4s ser mais extensa que a 3d tem uma influência importante sobre a química dos elementos de transição. Quando um átomo como o V (Figura \PageIndex{1}) interage com outro átomo, são os elétrons 4s que se estendem mais longe do núcleo que primeiro entram em contato com o outro átomo. Assim os 4s electrões são muitas vezes mais significativos do que os 3d na determinação da valência e das fórmulas dos compostos. Os elétrons 3d são “enterrados” sob as superfícies dos átomos dos metais de transição. A adição de mais um electrão 3d tem um efeito consideravelmente menor nas suas propriedades químicas do que a adição de mais um electrão 3s ou 3p no caso dos elementos representativos. Assim, existe uma transição lenta mas constante nas propriedades de um elemento de transição para outro. Note-se, por exemplo, que exceto para Sc, todos os metais de transição formam cloretos, MCl2, onde o metal tem uma valência de 2; exemplos são TiCl2, VCl2, CrCl2, e assim por diante. Isto pode ser visto na tabela encontrada no topo desta página. A valência de 2 corresponde aos dois elétrons de valência 4s.
Cada metal de transição também exibe outras valências onde um ou mais dos elétrons 3d também estão envolvidos. Por exemplo, em alguns compostos V (vanádio) tem uma valência de 2 (VO, VCl2) em outros tem uma valência de 3 (V2O3, VCl3), em outros ainda tem uma valência de 4 (VO2, VCl4), e em pelo menos um caso (V2O5) tem uma valência de 5. A química dos metais de transição é mais complicada e uma maior variedade de fórmulas para compostos de metais de transição é possível devido a esta variável de valência. Em alguns casos os elétrons das subcasas d atuam como elétrons de valência, enquanto em outros casos eles não atuam. Embora as nuvens de elétrons 3d não se afastem do núcleo mais do que 3s e 3p (e, portanto, não constituem outra concha como os elétrons 4s), elas estão completamente protegidas da carga nuclear e, portanto, muitas vezes atuam como elétrons de valência. Este comportamento Jekyll e Hyde dos elétrons 3d torna a vida mais complicada (e muitas vezes muito mais interessante) para os químicos que estudam os elementos de transição.
| Z | Element | Configuração | 1 | H | 1s 1 | 2 | Ele | 1s 2 | 3 | Li | 2s 1 |
|---|---|---|---|
| 4 | Be | 2s 2 | |
| 5 | B | 2s 2 2p1 | |
| 6 | C | 2s 2 2p2 | 7 | N | 2s 2 2p3 |
| 8 | 0 | 2s 2 2p4 | |
| F | 2s 2 2p5 | ||
| 10 | Ne | 2s 2 2p6 | |
| 11 | Na | 3s 1 | |
| 12 | Mg | 3s 2 | |
| 13 | Al | 3s 2 3p1 | 14 | Si | 3s 2 3p2 |
| 15 | P | 3s 2 3p3 | |
| 16 | S | 3s 2 3p4 | |
| 17 | Cl | 3s 2 3p5 | |
| 18 | Ar | 3s 2 3p6 | |
| 19 | K | 4s 1 | 20 | Ca | 4s 2 |
| 21 | Sc | 3d 1 4s 2 | |
| 22 | Ti | 3d 2 4s 2 | |
| 23 | V | 3d 3 4s 2 | |
| 24 | Cr | 3d 5 4s 1 | |
| 25 | Mn | 3d 5 4s 2 | 26 | Fe | 3d 6 4s 2 |
| 27 | Co | 3d 7 4s 2 | |
| 28 | Ni | 3d 8 4s 2 | 29 | Cu | 3d 10 4s 1 |
| 30 | Zn | 3d 10 4s 2 | |
| 31 | Ga | 3d 10 4s 2 4p 1 | |
| 32 | Ge | 3d 10 4s 2 4p 2 | 33 | Como | 3d 10 4s 2 4p 3 |
| 34 | Se | 3d 10 4s 2 4p 4 | |
| 35 | Br | 3d 10 4s 2 4p 5 | 36 | Kr | 3d 10 4s 2 4p 6 |
| 37 | Rb | 5s 1 | |
| 38 | Sr | 5s 2 | |
| 39 | Y | 4d 1 5s 2 | 40 | Zr | 4d 2 5s 2 | 41 | Nb | 4d 4 5s 1 |
| 42 | Mo | 4d 5 5s 1 | |
| 43 | Tc | 4d 5 5s 2 | |
| 44 | Ru | 4d 7 5s 1 | |
| 45 | Rh | 4d 8 5s 1 | 46 | Pd | 4d 10 |
| 47 | Ag | 4d 10 5s 1 | |
| 48 | Cd | 4d 10 5s 2 | |
| 49 | Em | 4d 10 5s 2 5p 1 | |
| 50 | Sn | 4d 10 5s 2 5p 2 | 51 | Sb | 4d 10 5s 2 5p 3 |
| 52 | Te | 4d 10 5s 2 5p 4 | 53 | I | 4d 10 5s 2 5p 5 |
| 54 | Xe | 4d 10 5s 2 5p 6 | |
| 55 | Cs | 6s 1 | |
| 56 | Ba | 6s 2 | 57 | La | 5d 1 6s 2 |
| 58 | Ce | 4f 1 5d 1 6s 2 | 59 | Pr | 4f 3 6s 2 |
| 60 | Nd | 4f 4 6s 2 | |
| 61 | Pm | 4f 5 6s 2 | 62 | Sm | 4f 6 6s 2 | 63 | Eu | 4f 7 6s 2 |
| 64 | Gd | 4f 7 5d 1 6s 2 | |
| 65 | Tb | 4f 9 6s 2 | |
| 66 | Dy | 4f 10 6s 2 | |
| 67 | Ho | 4f 11 6s 2 | |
| 68 | Er | 4f 12 6s 2 | |
| 69 | Tm | 4f 13 6s 2 | 70 | Yb | 4f 14 5d 1 6s 2 |
| 71 | Lu | 4f 14 5d 1 6s 2 | |
| 72 | Hf | 4f 14 5d 2 6s 2 | 73 | Ta | 4f 14 5d 3 6s 2 |
| 74 | W | 4f 14 5d 4 6s 2 | 75 | Re | 4f 14 5d 5 6s 2 |
| 76 | 0s | 4f 14 5d 6 6s 2 | |
| 77 | Ir | 4f 14 5d 7 6s 2 | 78 | Pt | 4f 14 5d 9 6s 1 |
| 79 | Au | 4f 14 5d 10 6s 1 | 80 | Hg | 4f 14 5d 10 6s 2 | 81 | Tl | 4f 14 5d 10 6s 2 6p1 |
| 82 | Pb | 4f 14 5d 10 6s 2 6p2 | 83 | Bi | 4f 14 5d 10 6s 2 6p 3 |
| 84 | Po | 4f 14 5d 10 6s 2 6p 4 | |
| 85 | Em | 4f 14 5d 10 6s 2 6p 5 | |
| 86 | Rn | 4f 14 5d 10 6s 2 6p 6 | |
| 87 | Fr | 7s 1 | 88 | Ra | 7s 2 | 89 | Ac | 6d 1 7s 2 |
| 90 | Th | 6d 2 7s 2 | |
| 91 | Pa | 5f 2 6d 1 7s 2 | |
| 92 | U | 5f 3 6d 1 7s 2 | |
| 93 | Np | 5f 4 6d 1 7s 2 | 94 | Pu | 5f 6 7s 2 |
| 95 | Am | 5f 7 7s 2 | |
| 96 | Cm | 5f 7 6d 1 s 2 | 97 | Bk | 5f 9 s 2 |
| 98 | Cf | 5f 10 s 2 | |
| 99 | Es | 5f 11 s 2 | |
| 100 | Fm | 5f 12 s 2 | |
| 101 | Md | 5f 13 s 2 | |
| 102 | Não | 5f 14 s 2 | 103 | Lr | 5f 14 6d 1 s 2 |
| 104 | Rf | 5f 14 6d 2 s 2 |
A terceira categoria principal de elementos surge quando o electrão distintivo ocupa uma subesfera f. O primeiro exemplo ocorre no caso dos lantanóides (elementos com números atómicos entre 57 e 71). Os lantanóides têm a configuração geral dos electrões
4d104f i5s25p65d0 ou 16s2
onde i é um número entre 0 e 14. Assim, no processo de construção dos lantanóides, os elétrons estão sendo adicionados a uma subesfera (4f) cujo número quântico principal é dois a menos do que o do orbital mais externo (6s). A adição de outro elétron a uma casca interna enterrada tão profundamente quanto o 4f tem pouco ou nenhum efeito sobre as propriedades químicas desses elementos. Todos são bastante semelhantes ao lantânio (La) e podem caber exactamente no mesmo espaço da tabela periódica que La. Os elementos lantanóides são tão semelhantes uns aos outros que técnicas especiais são necessárias para separá-los. Como resultado, mesmo amostras aproximadamente puras da maioria deles não foram preparadas até a década de 1870. Seguindo o elemento actinium (Ac) é uma série de átomos em que a sub-camada 5f está a encher. Os actinóides são um pouco menos semelhantes ao Ac do que os lantanóides são para La porque algumas excepções à ordem habitual de enchimento orbital ocorrem no caso do Th, Pa e U (Tabela \PageIndex{1}}).
Porque os lantanóides e a maioria dos actinóides se comportam quimicamente como se cabessem no grupo IIIB da tabela periódica (onde Lu e Lr são encontrados), ambos os grupos são separados do resto da tabela e colocados juntos em um bloco abaixo. Tomados juntos, os lantanóides e actinóides são chamados de elementos de transição interna porque as subcasas a serem preenchidas estão tão profundamente dentro da estrutura electrónica restante dos seus átomos.
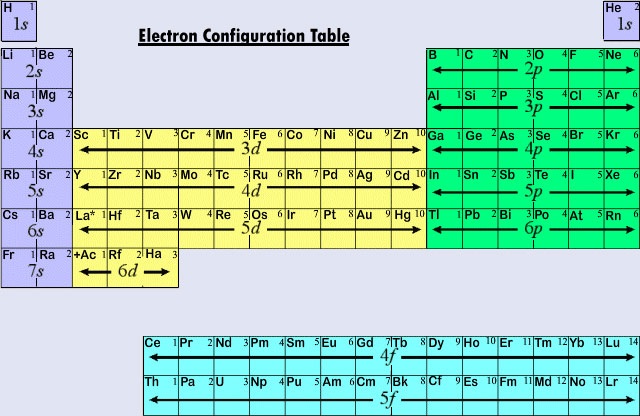
Figure \(\PageIndex{2}}) resume o tipo de subcasa em que o electrão distintivo se encontra para átomos de elementos em várias regiões da tabela periódica. Esta informação resumida torna relativamente simples a utilização da tabela periódica para obter configurações de elétrons, como mostra o seguinte exemplo.
Exemplo \(\PageIndex{1}}): Configuração eletrônica
Obter a configuração eletrônica para (a) Nb; (b) Pr.
Solução
a) Nb, elemento número 41, é encontrado no quinto período e em uma região da tabela periódica onde uma subesquema d está preenchendo (a segunda série de transição). Voltando para trás (em direção a números atômicos inferiores) através da tabela periódica, o gás nobre mais próximo é Kr, e assim usamos o kernel Kr:
Nb _____
O próximo elemento depois de 36K é 37Rb no qual a subesquema 5s está se enchendo. Movendo para a direita mais um espaço, chegamos ao 38Sr que tem um par de 5s2. Até agora temos o Nb _____ 5s2 para a configuração Nb. Agora vamos mais para a direita na região da sub-capa 4d da tabela periódica e contamos mais de três espaços (Y, Zr, Nb) para chegar ao Nb. A configuração eletrônica total é assim Nb 4d35s2 (Note que o número quântico principal da subcasa d é 4 – um a menos do que o número do período. Também, se você olhar para a tabela de configurações de elétrons, deve ser notado que Nb é uma exceção às regras típicas de preenchimento orbital) b) Um procedimento similar é seguido para Pr, elemento número 59. Voltando para trás através da tabela, o gás nobre mais próximo é Xe, e por isso usamos o kernel Xe. Contando novamente para frente, Cs e Ba correspondem a 6s2. Depois La, Ce, e Pr correspondem a mais três elétrons na sub-camada 4f. A configuração é assim Pr…4f36s2
Mais um ponto deve ser enfatizado sobre a relação entre a configuração dos elétrons e a tabela periódica. Os átomos dos elementos na mesma coluna vertical da tabela têm configurações de elétrons similares. Por exemplo, considere os elementos alcalino-terra (grupo IIA). Utilizando as nossas regras para derivar configurações de electrões (Exemplo 1) temos
| Element | Configuração Electrónica | Diagrama Lewis |
|---|---|---|
| Be | 2s2 | Be: |
| Mg | 3s2 | Mg: | Ca | 4s2 | Ca: |
| Sr | 5s2 | Sr: |
| Ba | 6s2 | Ba: | Ra | 7s2 | Ra: |
Assim, as semelhanças de comportamento químico e valência observadas anteriormente para estes elementos correlacionam-se com as semelhanças das suas nuvens de electrões mais exteriores. Tais semelhanças são responsáveis pelo sucesso das previsões de Mendeleev sobre as propriedades dos elementos não descobertos.
Contribuidores e Atribuições
-
Ed Vitz (Universidade de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, e Adam Hahn.
