Objectivos de aprendizagem
- Descrever os componentes envolvidos numa contracção muscular
- Explicar como os músculos Contrair e relaxar
- Descrever o modelo de filamento deslizante de contração muscular
A sequência de eventos que resultam na contração de uma fibra muscular individual começa com um sinal – o neurotransmissor, ACh – do neurónio motor a inervar aquela fibra. A membrana local da fibra despolarizará à medida que os íons de sódio (Na+) com carga positiva entram, desencadeando um potencial de ação que se espalha para o resto da membrana despolarizará, incluindo o tubo T. Isto desencadeia a liberação de íons de cálcio (Ca++) do armazenamento no retículo sarcoplásmico (SR). O Ca++ inicia então a contração, que é sustentada por ATP (Figura 1). Enquanto os íons Ca++ permanecerem no sarcoplasma para ligar-se à troponina, que mantém os locais de ligação de actina “desprotegidos”, e enquanto o ATP estiver disponível para conduzir o ciclismo da ponte transversal e o puxar dos fios de actina pela miosina, a fibra muscular continuará a encurtar até um limite anatômico.

Figure 1. Contração de uma Fibra Muscular. Forma-se uma ponte transversal entre a actina e as cabeças de miosina, provocando a contracção. Enquanto os íons Ca++ permanecerem no sarcoplasma para se ligar à troponina, e enquanto o ATP estiver disponível, a fibra muscular continuará a encurtar.
Contração do músculo geralmente pára quando a sinalização do neurônio motor termina, o que repolariza o sarcolemma e o tubo T, e fecha os canais de cálcio de tensão no SR. Os íons Ca++ são então bombeados de volta para o SR, o que faz com que a tropomiosina resguarde (ou recubra) os locais de ligação nos fios de actina. Um músculo também pode parar de se contrair quando ele fica sem ATP e se cansa (Figura 2).

Figure 2. Relaxamento de uma Fibra Muscular. Os íons Ca++ são bombeados de volta ao SR, o que faz com que a tropomiosina resguarde os locais de ligação dos filamentos de actina. Um músculo também pode parar de se contrair quando fica sem ATP e fica cansado.
Os eventos moleculares de encurtamento da fibra muscular ocorrem dentro dos sarcômeros da fibra (veja Figura 3). A contração de uma fibra muscular estriada ocorre quando os sarcômeros, dispostos linearmente dentro das miofibrilas, encurtam à medida que as cabeças de miosina puxam os filamentos de actina.
A região onde os filamentos grossos e finos se sobrepõem tem uma aparência densa, já que há pouco espaço entre os filamentos. Esta zona onde os filamentos finos e grossos se sobrepõem é muito importante para a contração muscular, pois é o local onde o movimento dos filamentos começa. Os filamentos finos, ancorados nas suas extremidades pelos discos Z, não se estendem completamente para a região central que contém apenas filamentos grossos, ancorados nas suas bases num ponto chamado linha M. Uma miofibrilha é composta de muitos sarcomeres que correm ao longo de seu comprimento; assim, miofibrilas e células musculares se contraem conforme os sarcomeres se contraem.
O Modelo de Contração do Filamento Deslizante
Quando sinalizado por um neurônio motor, uma fibra muscular esquelética se contrai conforme os filamentos finos são puxados e então deslizam pelos filamentos grossos dentro dos sarcomeres da fibra. Este processo é conhecido como o modelo de filamento deslizante de contração muscular (Figura 3). O deslizamento só pode ocorrer quando os locais de ligação de miosina nos filamentos de actina são expostos por uma série de passos que começam com a entrada de Ca++ no sarcoplasma.

Figure 3. O Modelo de Filamento Deslizante de Contração Muscular. Quando um sarcômero se contrai, as linhas Z se aproximam, e a banda I se torna menor. A banda A fica com a mesma largura. Na contração total, os filamentos finos e grossos se sobrepõem.
Tropomyosin é uma proteína que serpenteia ao redor das cadeias do filamento de actina e cobre os locais de ligação da miosina para evitar que a actina se ligue à miosina. A tropomiosina liga-se à troponina para formar um complexo troponina-tropomiosina. O complexo troponina-tropomiosina impede que as “cabeças” de miosina se liguem aos sítios ativos nos microfilamentos de actina. A troponina também tem um local de ligação para íons Ca++.
Para iniciar a contração muscular, a tropomiosina tem que expor o local de ligação da miosina em um filamento de actina para permitir a formação de pontes cruzadas entre a actina e os microfilamentos de miosina. O primeiro passo no processo de contração é a ligação de Ca++ à troponina para que a tropomiosina possa deslizar para longe dos locais de ligação dos filamentos de actina. Isso permite que as cabeças de miosina se liguem a esses locais de ligação expostos e formem pontes cruzadas. Os filamentos finos são então puxados pelas cabeças de miosina para deslizar através dos filamentos grossos em direção ao centro do sarcômero. Mas cada cabeça só pode puxar uma distância muito curta antes de ter atingido o seu limite e deve ser “re-travada” antes de poder puxar novamente, um passo que requer ATP.
ATP e Contração Muscular
Para que os filamentos finos continuem a deslizar para além dos filamentos grossos durante a contração muscular, as cabeças de miosina devem puxar a actina nos locais de ligação, descolar, re-travar, re-travar, etc. Este movimento repetido é conhecido como o ciclo da ponte-cruzada. Este movimento das cabeças de myosin é similar aos remos quando um indivíduo rema um barco: A palheta dos remos (as cabeças de miosina) puxa, é levantada da água (desprender-se), reposicionada (voltar a bater) e depois imersa novamente para puxar (Figura 4). Cada ciclo requer energia, e a ação das cabeças de miosina nos sarcomeres puxando repetidamente os filamentos finos também requer energia, que é fornecida por ATP.
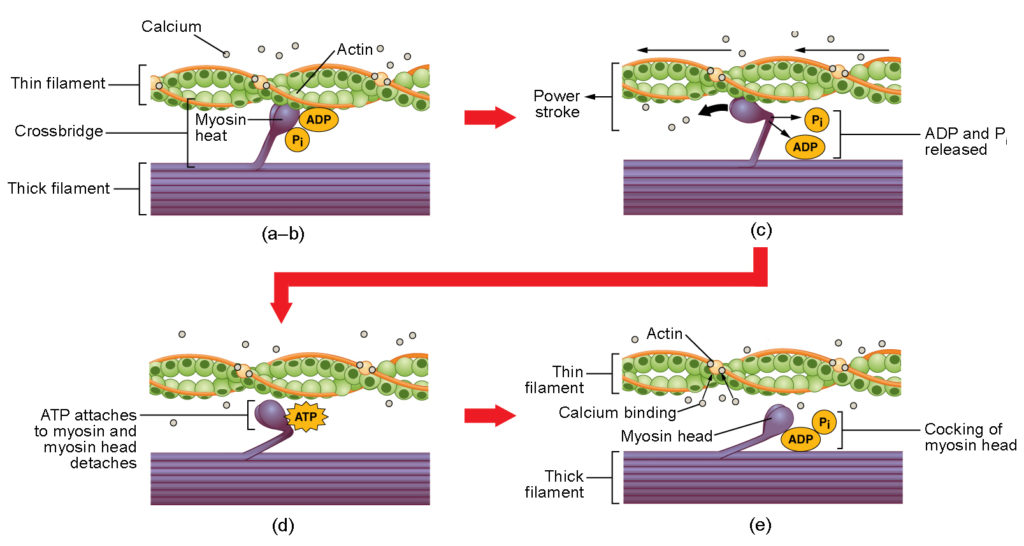
Figure 4. Contração do músculo esquelético. (a) O local ativo na actina é exposto como o cálcio se liga à troponina. (b) A cabeça da miosina é atraída pela actina, e a miosina liga-se à actina no seu local de ligação à actina, formando a ponte transversal. (c) Durante o curso de energia, o fosfato gerado no ciclo de contração anterior é liberado. Isto faz com que a cabeça da miosina gire em direção ao centro do sarcômero, após o que o ADP e o grupo fosfato anexados são liberados. (d) Uma nova molécula de ATP se prende à cabeça da miosina, fazendo com que a ponte transversal se desprenda. (e) A cabeça da miosina hidrolisa ATP a ADP e fosfato, o que faz com que a miosina retorne para a posição de coquete.
A formação da ponte transversal ocorre quando a cabeça da miosina se liga à actina enquanto que o difosfato de adenosina (ADP) e o fosfato inorgânico (Pi) ainda estão ligados à miosina (Figura 4a,b). Pi é então libertado, fazendo com que a miosina forme uma ligação mais forte à actina, após o que a cabeça da miosina se move em direcção à linha M, puxando a actina juntamente com ela. Quando a actina é puxada, os filamentos movem-se aproximadamente 10 nm em direcção à linha M. Este movimento é chamado de curso de força, pois o movimento do filamento fino ocorre neste passo (Figura 4c). Na ausência do ATP, a cabeça da miosina não se separa da actina.
Uma parte da cabeça da miosina se prende ao local de ligação da actina, mas a cabeça tem outro local de ligação para o ATP. A ligação ATP faz com que a cabeça de myosin se desprenda do actin (Figura 4d). Após isso ocorrer, ATP é convertido em ADP e Pi pela atividade intrínseca ATPase da miosina. A energia liberada durante a hidrólise de ATP muda o ângulo da cabeça da miosina para uma posição em cocked (Figura 4e). A cabeça da miosina está agora em posição para movimento posterior.
Quando a cabeça da miosina está ligada, a miosina está em uma configuração de alta energia. Esta energia é gasta à medida que a cabeça myosin se move através do curso de potência, e no final do curso de potência, a cabeça myosin está em uma posição de baixa energia. Após o curso de potência, o ADP é liberado; no entanto, a ponte transversal formada ainda está no lugar, e a actina e a miosina estão unidas. Enquanto o ATP estiver disponível, ele prontamente se prende à miosina, o ciclo da ponte transversal pode se repetir, e a contração muscular pode continuar.
Note que cada filamento grosso de aproximadamente 300 moléculas de miosina tem múltiplas cabeças de miosina, e muitas pontes transversais se formam e se rompem continuamente durante a contração muscular. Multiplique isso por todos os sarcômeros em uma miofibril, todas as miofibrilas em uma fibra muscular, e todas as fibras musculares em um músculo esquelético, e você pode entender porque tanta energia (ATP) é necessária para manter os músculos esqueléticos trabalhando. Na verdade, é a perda de ATP que resulta no rigor mortis observado logo após a morte de alguém. Sem produção de ATP adicional possível, não há ATP disponível para as cabeças de miosina se destacarem dos locais de ligação da actina, assim as pontes cruzadas permanecem no lugar, causando a rigidez nos músculos esqueléticos.
Fontes de ATP
ATP fornece a energia para que a contração muscular ocorra. Para além do seu papel directo no ciclo transversal, o ATP também fornece a energia para as bombas de transporte activo Ca++ no SR. A contração muscular não ocorre sem quantidades suficientes de ATP. A quantidade de ATP armazenada no músculo é muito baixa, apenas suficiente para alimentar alguns segundos de contracções. Como está quebrado, o ATP deve ser regenerado e substituído rapidamente para permitir uma contração sustentada. Existem três mecanismos pelos quais o ATP pode ser regenerado: metabolismo do fosfato de creatina, glicólise anaeróbica, fermentação e respiração aeróbica.
Fosfato de creatina é uma molécula que pode armazenar energia nas suas ligações de fosfato. Em um músculo em repouso, o excesso de ATP transfere sua energia para a creatina, produzindo ADP e fosfato de creatina. Isto age como uma reserva de energia que pode ser usada para criar mais ATP rapidamente. Quando o músculo começa a contrair e precisa de energia, o fosfato de creatina transfere seu fosfato de volta para o ADP para formar ATP e creatina. Esta reacção é catalisada pela enzima creatina quinase e ocorre muito rapidamente; assim, o ATP derivado do fosfato de creatina alimenta os primeiros segundos de contracção muscular. No entanto, o fosfato de creatina só pode fornecer aproximadamente 15 segundos de energia, altura em que outra fonte de energia tem de ser usada (Figura 5).

Figure 5. Metabolismo Muscular. Algum ATP é armazenado em um músculo em repouso. Quando a contração começa, ele é usado em segundos. Mais ATP é gerado a partir do fosfato de creatina por cerca de 15 segundos.
Como o ATP produzido pelo fosfato de creatina se esgota, os músculos se voltam para a glicólise como uma fonte de ATP. A glicólise é um processo anaeróbico (não dependente de oxigênio) que decompõe a glicose (açúcar) para produzir ATP; entretanto, a glicólise não pode gerar ATP tão rapidamente quanto o fosfato de creatina. Assim, a mudança para glicólise resulta em uma taxa mais lenta de disponibilidade de ATP para o músculo. O açúcar usado na glicólise pode ser fornecido pela glicose no sangue ou pela metabolização do glicogênio que é armazenado no músculo. A decomposição de uma molécula de glicose produz dois ATP e duas moléculas de ácido pirúvico, que podem ser usadas na respiração aeróbica ou quando os níveis de oxigênio estão baixos, convertidas em ácido láctico (Figura 6).

Figure 6. Glicólise e Respiração Aeróbica. Cada molécula de glicose produz duas ATP e duas moléculas de ácido pirúvico, que podem ser utilizadas na respiração aeróbica ou convertidas em ácido láctico. Se não houver oxigênio disponível, o ácido pirúvico é convertido em ácido láctico, o que pode contribuir para a fadiga muscular. Isto ocorre durante exercício extenuante quando são necessárias altas quantidades de energia, mas o oxigénio não pode ser suficientemente fornecido ao músculo.
Se o oxigénio estiver disponível, o ácido pirúvico é utilizado na respiração aeróbica. Contudo, se o oxigénio não estiver disponível, o ácido pirúvico é convertido em ácido láctico, o que pode contribuir para a fadiga muscular. Esta conversão permite a reciclagem da enzima NAD+ da NADH, que é necessária para que a glicólise continue. Isto ocorre durante o exercício extenuante quando são necessárias altas quantidades de energia, mas o oxigénio não pode ser suficientemente fornecido ao músculo. A glicólise em si não pode ser sustentada por muito tempo (aproximadamente 1 minuto de atividade muscular), mas é útil para facilitar explosões curtas de alta intensidade. Isto é porque a glicólise não utiliza a glicose muito eficientemente, produzindo um ganho líquido de dois ATPs por molécula de glicose, e o produto final do ácido láctico, que pode contribuir para a fadiga muscular à medida que se acumula.
Aeróbica respiração é a quebra da glicose ou outros nutrientes na presença de oxigênio (O2) para produzir dióxido de carbono, água, e ATP. Aproximadamente 95% do ATP necessário para o repouso ou músculos moderadamente ativos é fornecido pela respiração aeróbica, que ocorre em mitocôndrias. As entradas para a respiração aeróbica incluem a glicose que circula na corrente sanguínea, ácido pirúvico e ácidos graxos. A respiração aeróbica é muito mais eficiente do que a glicólise anaeróbica, produzindo aproximadamente 36 ATPs por molécula de glicose versus quatro de glicólise. Entretanto, a respiração aeróbica não pode ser sustentada sem um suprimento constante de O2 para o músculo esquelético e é muito mais lenta (Figura 7). Para compensar, os músculos armazenam pequena quantidade de oxigênio em excesso nas proteínas chamada mioglobina, permitindo contrações musculares mais eficientes e menos fadiga. O treinamento aeróbico também aumenta a eficiência do sistema circulatório para que o O2 possa ser fornecido aos músculos por longos períodos de tempo.

Figure 7. Respiração Celular. A respiração aeróbica é a quebra da glicose na presença de oxigênio (O2) para produzir dióxido de carbono, água e ATP. Aproximadamente 95% do ATP necessário para repouso ou músculos moderadamente ativos é fornecido pela respiração aeróbica, que ocorre em mitocôndrias.
Fadiga muscular ocorre quando um músculo não pode mais contrair em resposta a sinais do sistema nervoso. As causas exatas da fadiga muscular não são totalmente conhecidas, embora certos fatores tenham sido correlacionados com a diminuição da contração muscular que ocorre durante a fadiga. O ATP é necessário para a contração muscular normal, e como as reservas de ATP são reduzidas, a função muscular pode diminuir. Isto pode ser mais um fator em resumo, produção muscular intensa em vez de esforços sustentados e de menor intensidade. A acumulação de ácido láctico pode diminuir o pH intracelular, afetando a atividade enzimática e proteica. Desequilíbrios nos níveis de Na+ e K+ como resultado da despolarização da membrana podem perturbar o fluxo de Ca++ para fora do SR. Longos períodos de exercício prolongado podem danificar o SR e o sarcolemma, resultando na regulação de Ca++ deficiente.
Atividade muscular intensa resulta em uma dívida de oxigênio, que é a quantidade de oxigênio necessária para compensar o ATP produzido sem oxigênio durante a contração muscular. O oxigênio é necessário para restaurar os níveis de ATP e creatina fosfato, converter ácido láctico em ácido pirúvico, e, no fígado, converter ácido láctico em glicose ou glicogênio. Outros sistemas usados durante o exercício também requerem oxigênio, e todos esses processos combinados resultam no aumento da taxa respiratória que ocorre após o exercício. Até que o débito de oxigênio seja atingido, a ingestão de oxigênio é elevada, mesmo após a interrupção do exercício.
Relaxação de um músculo esquelético
Relaxação das fibras musculares esqueléticas, e finalmente, o músculo esquelético, começa com o neurônio motor, que pára de liberar seu sinal químico, ACh, para a sinapse no NMJ. A fibra muscular irá repolarizar, o que fecha os portões do SR onde Ca++ estava sendo liberado. As bombas acionadas por ATP moverão o Ca++ do sarcoplasma de volta para o SR. Isto resulta no “reshielding” dos locais de ligação de actina nos filamentos finos. Sem a capacidade de formar pontes cruzadas entre os filamentos finos e grossos, a fibra muscular perde a tensão e relaxa.
Força do músculo
O número de fibras musculares esqueléticas em um determinado músculo é geneticamente determinado e não muda. A força muscular está directamente relacionada com a quantidade de miofibrilas e sarcômeros dentro de cada fibra. Fatores, tais como hormônios e estresse (e esteróides anabolizantes artificiais), agindo sobre o músculo podem aumentar a produção de sarcômeros e miofibrilas dentro das fibras musculares, uma mudança chamada hipertrofia, que resulta no aumento da massa e volume em um músculo esquelético. Da mesma forma, a diminuição do uso de um músculo esquelético resulta em atrofia, onde o número de sarcômeros e miofibrilas desaparece (mas não o número de fibras musculares). É comum que um membro de um gesso apresente músculos atrofiados quando o gesso é removido, e certas doenças, como a poliomielite, mostram músculos atrofiados.
Disordens do Sistema Muscular
Distrofia muscular de Duchenne (DMD) é um enfraquecimento progressivo dos músculos esqueléticos. É uma das várias doenças referidas colectivamente como “distrofia muscular”. A DMD é causada pela falta da distrofina proteica, que ajuda os filamentos finos das miofibrilas a ligarem-se ao sarcolemma. Sem distrofina suficiente, as contrações musculares provocam a ruptura do sarcolemma, causando um influxo de Ca++, levando a danos celulares e degradação das fibras musculares. Com o tempo, à medida que o dano muscular se acumula, a massa muscular é perdida e maiores deficiências funcionais se desenvolvem.
DMD é uma desordem hereditária causada por um cromossoma X anormal. Afeta principalmente os homens, e geralmente é diagnosticada na primeira infância. A DMD geralmente aparece primeiro como dificuldade de equilíbrio e movimento, e depois progride para uma incapacidade de caminhar. Continua a progredir para cima no corpo desde as extremidades inferiores até à parte superior do corpo, onde afecta os músculos responsáveis pela respiração e circulação. Em última instância, causa a morte por insuficiência respiratória, e os aflitos não costumam viver além dos 20 anos.
Porque a DMD é causada por uma mutação no gene que codifica a distrofina, pensou-se que introduzir miooblastos saudáveis nos pacientes poderia ser um tratamento eficaz. Os miooblastos são as células embrionárias responsáveis pelo desenvolvimento muscular, e idealmente, eles carregariam genes saudáveis que poderiam produzir a distrofina necessária para a contração muscular normal. Esta abordagem tem sido largamente mal sucedida em humanos. Uma abordagem recente tem envolvido a tentativa de aumentar a produção muscular de utrofina, uma proteína semelhante à distrofina que pode ser capaz de assumir o papel da distrofina e evitar a ocorrência de danos celulares.
Perguntas de auto-verificação
Realize o questionário abaixo para verificar o seu entendimento da contração e relaxamento da fibra muscular:
