A: AMINO ACIDS
BIOQUEMISTRIA – DR. JAKUBOWSKI
Última Atualização: 27/02/16
Metas/Objetivos de Aprendizagem para o Capítulo 2A: Após a aula e esta leitura, os alunos serão capazes de
- destabelecer a carga nas cadeias laterais de aminoácidos usando a equação de Henderson Hasselbach e a carga aproximada por inspeção a qualquer pH
- destabelecer mecanismos e identificar produtos para a reação de cadeias laterais nucleofílicas Lys e Cys com agentes de modificação química comuns e estender este entendimento às reações dos seus.
- draw mechanisms for disulfide exchange reactions for sulfhydryls using them and oxidation numbers to explain redox reactions of cysteine/cystine.
A7. Cystine Chemistry
Duas cadeias laterais de cisteína podem covalentemente interagir em uma proteína para produzir um dissulfeto. Assim como HOOH (peróxido de hidrogênio) é mais oxidado que HOH (O em H2O2 tem um número de oxidação 1- enquanto o O em H2O tem um número de oxidação 2-) , RSSR é a forma oxidada (S número de oxidação 1-) e RSH é a forma reduzida (S número de oxidação 2-) de tióis. O número de oxidação é análogo já que O e S estão ambos no Grupo 6 da tabela periódica e ambos são mais electronegativos que C.
Uma revisão rápida das reacções redox e dos números de oxidação.
Figura: DISULFIDE – CYSTINE – REACTIONS
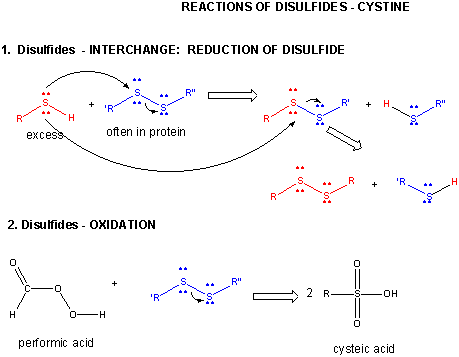
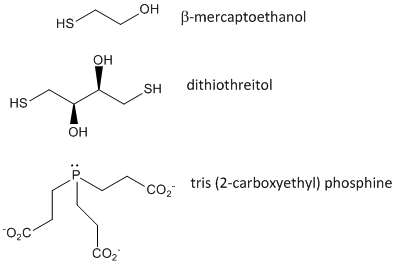
Quando uma proteína se dobra, duas cadeias laterais de Cys podem se aproximar uma da outra, e formar uma ligação de bissulfureto intra-cadeia. Da mesma forma, duas cadeias laterais de Cys em proteínas separadas podem se aproximar e formar um bissulfeto intra-cadeia. Tais dissulfuretos devem ser clivados, e as cadeias separadas antes de analisar a sequência da proteína. O dissulfeto na proteína pode ser clivado por agentes redutores como beta-mercaptoetanol, ditiotreitol, tris (2-carboxietil) fosfina (TCEP) ou agentes oxidantes que oxidam ainda mais o dissulfeto para separar os ácidos cisteicos.
Figure: Agentes oxidantes do dissulfeto – b-mercaptoetanol, ditiotreitol e fosfinas
>
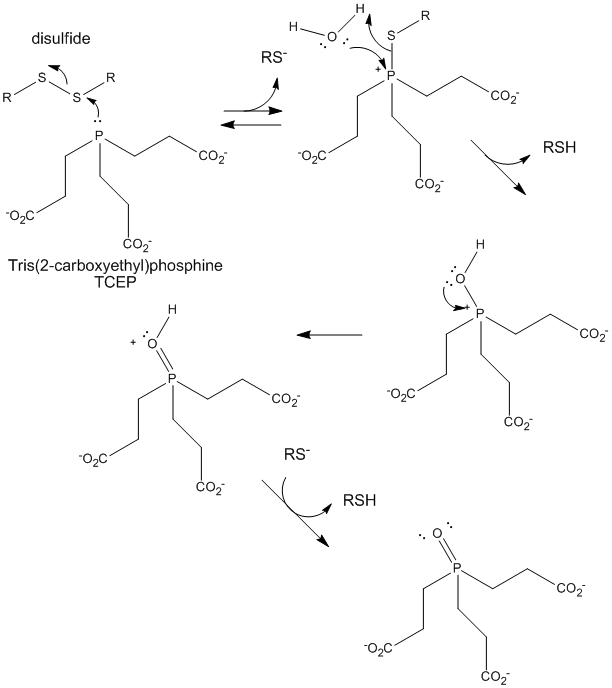
Figure: TCEP redução de dissulfetos
>
 >
>
> O interior das células é mantido num ambiente reduzido pela presença de muitos agentes “redutores”, tais como o tripeptídeo g-glu-cys-gly (glutationa). Assim, as proteínas intracelulares geralmente não contêm dissulfetos, que são abundantes em proteínas extracelulares (como as encontradas no sangue) ou em certas organelas, como o retículo endoplasmático e o espaço intermembrana mitocondrial onde o dissulfidesc pode ser introduzido.
Figure:
Cleaving Disulfide Bonds in Proteins
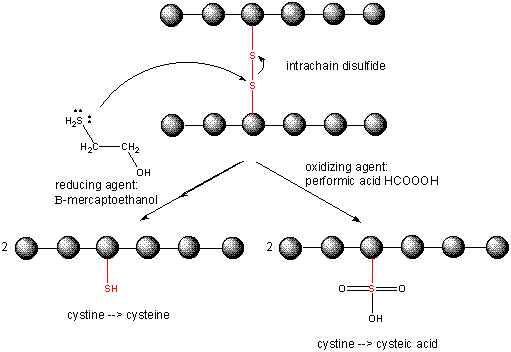
Cysteine Redox Chemistry
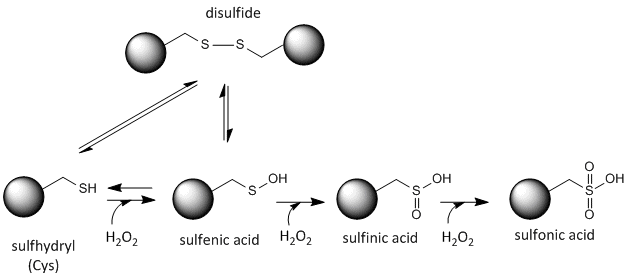
O enxofre na cisteína é redox-activo e por isso pode existir numa grande variedade de estados, dependendo do ambiente redox local e da presença de agentes redutores e oxidantes. Um agente oxidante potente que pode ser feito nas células é o peróxido de hidrogênio, que pode levar a modificações químicas mais drásticas e irreversíveis nas cadeias laterais de Cys. Se um Cys reativo é importante para a função da proteína, então a função da proteína pode ser modulada (às vezes reversivelmente, às vezes irreversivelmente) com vários agentes oxidantes, como mostrado na figura abaixo.
Figure:Redox state of Cysteine
Navigation
Return toChapter 2A: Amino Acid Sections
Return toBiochemistry Online Table of Contents
Archived version of fullChapter 2A: Amino Acids
