 Artigo de Acesso Aberto
Artigo de Acesso Aberto
 Este artigo de Acesso Aberto está licenciado sob uma Atribuição de Atribuição de Acesso Aberto
Este artigo de Acesso Aberto está licenciado sob uma Atribuição de Atribuição de Acesso Aberto
Creative Commons 3.0 Unported Licence
Guoqiang Liua, Yongsan Liab, Lei Yangd, Yen Weia, Xing Wangb, Zhiming Wangc e Lei Tao *a
*a
aKey Laboratory of Bioorganic Phosphorus Chemistry & Biologia Química (Ministério da Educação), Departamento de Química, Universidade Tsinghua, Beijing 100084, P. R. China. E-mail: [email protected]
bThe State Key Laboratory of Chemical Resource Engineering, Beijing University of Chemical Technology, Beijing 100029, P. R. China
cCollege of Pharmaceutical Science, Zhejiang Chinese Medical University, Hangzhou, Zhejiang 311400, P. R. China. China
dCancer Institute & Hospital, Peking Union Medical College & Academia Chinesa de Ciências Médicas, Beijing 100021, P. R. China
Primeiro publicado em 27 de março de 2017
Derivados de polietilenoglicol (PEG) têm sido amplamente utilizados em pesquisas relacionadas a bio. No entanto, os oligómeros de PEG (com diferentes pesos moleculares) ou monómeros à base de PEG (com diferentes grupos terminais em cadeia) têm na realidade diferentes propriedades químicas e físicas, o que pode levar a uma potencial toxicidade. Neste trabalho, a citotoxicidade de uma série de derivados do PEG (oligómeros e monómeros) foi medida utilizando células humanas do cancro do colo do útero (HeLa) e uma linha celular de fibroblastos derivados de ratos (L929) como células modelo. A maioria dos oligómeros de PEG são seguros para ambos os tipos de células, excepto o trietilenoglicol (TEG), que é tóxico em concentrações elevadas para as células L929. Por outro lado, os monómeros à base de PEG, incluindo o poli(etilenoglicol) acrilato de éter metílico (mPEGA) e o poli(etilenoglicol) metacrilato de éter metílico (mPEGMA), mostraram uma evidente citotoxicidade. Posteriormente, esses derivados tóxicos do PEG foram estudados para revelar os diferentes mecanismos da sua toxicidade. Esta pesquisa atual avaliou a citotoxicidade dos derivados de PEG e apontou o perigo potencial dos biomateriais “seguros”, que podem oferecer uma referência útil para as pessoas usarem os derivados de PEG em pesquisas biomédicas futuras.
Introdução
Polietilenoglicol (PEG) tem sido amplamente aplicado em vários campos médicos devido às suas propriedades excepcionais, tais como segurança satisfatória, biocompatibilidade, hidrofilicidade, etc. Por exemplo, o PEG tem sido utilizado em alguns laxantes aprovados pela Food and Drug Administration devido à sua excelente retenção de umidade e capacidade de lubrificação.1-3 Em outro exemplo, a modificação de medicamentos/proteínas com PEG (PEGylation) pode efetivamente melhorar a sua hidrossolubilidade e meia-vida de circulação de medicamentos,4,5 resultando em maior segurança e efeitos terapêuticos. Na verdade, o PEGylation está se tornando uma das biotecnologias mais atraentes e alcançando enorme sucesso na pesquisa fundamental e no mercado.6-11 Atualmente, muitos derivados do PEG têm sido utilizados como excelentes materiais de partida para sintetizar uma série de novos materiais poliméricos para bioaplicações.12 Por exemplo, um PEG linear foi modificado como um PEG difuncional (DF-PEG) que poderia ser utilizado para gerar rapidamente um hidrogel auto-regenerativo interessante.13,14 Alguns oligómeros de PEG têm sido utilizados para modificar a superfície das nanopartículas inorgânicas para melhorar a solubilidade da água e reduzir a toxicidade desses materiais inorgânicos.15-17 Alguns monômeros comerciais à base de PEG, como o poli(etilenoglicol) éter metílico acrilato (mPEGA) e o poli(etilenoglicol) metacrilato de éter metílico (mPEGMA) têm sido usados para preparar polímeros ramificados para subsequente conjugação de proteínas, auto-montagem, administração de drogas, etc.18-27
Embora o PEG seja normalmente considerado quase atóxico, alguns problemas inseguros de PEG com baixo peso molecular têm sido notados pelos pesquisadores. Smyth et al. relataram a toxicidade oral crônica do oligômero PEG (Mn ∼ 200) em ratos,28,29 os resultados adversos também têm sido observados em macacos,30 sugerindo potenciais problemas de segurança desses materiais “seguros”. Portanto, considerando a ampla utilização dos derivados de PEG em áreas de pesquisa, o estudo sistemático da citotoxicidade desses oligômeros de PEG e monômeros baseados em PEG é necessário e importante para sua posterior aplicação em campos bio relacionados (Esquema 1).
No trabalho atual, foi avaliada a citotoxicidade de alguns oligômeros de PEG (com diferentes pesos moleculares) e monômeros comerciais à base de PEG (com diferentes grupos terminais em cadeia) para células cancerosas do colo do útero humano (HeLa) e uma linha celular de fibroblastos derivados de camundongos (L929). A citotoxicidade molecular dependente do peso dos oligómeros de PEG foi observada, e os diferentes mecanismos de citotoxicidade dos oligómeros de PEG e dos monómeros baseados no PEG foram revelados pela primeira vez. Essas informações de citotoxicidade dos derivados de PEG podem ser referências valiosas para as pessoas escolherem o PEG como material de base e projetarem rotas de purificação para preparar materiais biocompatíveis à base de PEG para outras aplicações biomédicas.
Materiais e métodos
2.1 Produtos químicos
Trietilenoglicol (TEG, 97%, HEOWNS), PEG-400 (Mn ∼ 400, TCI), PEG-1000 (Mn ∼ 1000, Jiangsu Haitian Petrochemical Works), PEG-2000 (Mn ∼ 2000, SCRC), PEG-4000 (Mn ∼ 4000, SCRC), poli(etilenoglicol) éter metílico acrilato 480 (mPEGA-480, Mn ∼ 480, Sigma-Aldrich), metacrilato de polietilenoglicol metílico 500 (mPEGMA-500, Mn ∼ 500, Sigma-Aldrich) e metacrilato de polietilenoglicol metílico 950 (mPEGMA-950, Mn ∼ 950, Sigma-Aldrich) foram utilizados diretamente sem purificação adicional.
Células de câncer cervical humano (HeLa) e uma linha celular de fibroblasto derivado de camundongos (L929) foram adquiridas da coleção de cultura tipo americano (ATCC). Meio de cultura Dulbecco modificado de águia (DMEM, Corning-Cellgro), solução tampão fosfato salina (PBS, pH ∼ 7,2-7,4, 0,01 M, Solarbio), soro fetal bovino (FBS, Gibco), meio de cultura Roswell Park Memorial Institute 1640 (meio de cultura RPMI 1640, Gibco), solução de penicilina-estreptomicina (Gibco), trypsina-EDTA (Gibco, 0.25%), 4-(3-(2-metoxi-4-nitrofenil)-2-(4-nitrofenil)-2H-tetrazol-3-ium-5-yl)benzeno-1,3-dissulfonato (CCK-8, Beyotime), diacetato de 2,7-diclorodihidrofluoresceína (DCFH-DA, Beyotime), glutationa oxidada (GSSG, Beyotime), nicotinamida adenina dinucleotídeo fosfato (NADPH, Beyotime), 5,5′-dithiobis-(ácido 2-nitrobenzoico) (DTNB, Beyotime), diacetato de fluoresceína (FDA, Sigma) e iodeto de propidio (PI, 94%, Sigma) foram usados como comprados.
2,2 Cultura de células
Cultura de células foi mantida em uma incubadora a 37 °C com 5% de CO2, o meio de cultura foi trocado a cada um ou dois dias para manter o crescimento exponencial das células. As células de HeLa foram derivadas de células cancerosas do colo do útero e cultivadas em meio DMEM suplementado com 10% de soro fetal bovino (FBS) e 1% de penicilina e estreptomicina. L929 células foram derivadas de ratos e cultivadas em RPMI 1640 meio suplementado com 10% de soro fetal bovino (FBS) e 1% de penicilina e estreptomicina.
2,3 Análise de citotoxicidade
Os resultados foram apresentados como média ± desvio padrão (DP), e os valores da metade da concentração inibitória máxima 50% (IC50) de derivados de PEG foram calculados pelo SPSS 15.0.
De acordo com nosso trabalho anterior,32,33 o diacetato de fluoresceína (FDA) e o iodeto de propidio (PI) poderiam ser usados como um método rápido e conveniente de dupla coloração para observar a viabilidade celular. As células L929 foram semeadas em uma placa de 24 poços a uma densidade de ∼5 × 104 células por mL. Após a fixação, as células foram lavadas com PBS e cultivadas com diferentes concentrações de derivados de PEG no meio de cultura durante 24 h. Em seguida, o meio foi removido, as células foram lavadas com PBS. Uma solução mista de PBS-FDA-PI (FDA: 3 μg mL-1; PI: 3 μg mL-1) foi posteriormente adicionada e a placa de 24 poços foi incubada a 37 °C durante 15 min. Foi utilizado um microscópio de fluorescência (Leica Germany) para observar as células vivas e mortas sob 450-490 nm e 515-560 nm filtros de excitação de passagem de banda (I3 e N2.1), respectivamente (lâmpada de mercúrio de 100 W).
Briefly, células L929 foram semeadas em uma placa de 24 poços e incubadas em 0,5 mL de meio de cultura com diferentes concentrações de TEG (A, A′) durante 1 h (Fig. 1), foram utilizados poços A1-A6 para medir a quantidade total de glutatião (GSH + GSSG) enquanto os poços A′1-A′6 foram utilizados para medir a quantidade de glutatião oxidado (GSSG) na presença de TEG. Após 1 h, as células foram coletadas por digestão da tripsina e centrifugação (1000 rpm, 5 min). Em seguida, uma solução de remoção de proteína de volume triplo (50 mg mL-1) foi adicionada para remover as proteínas ruidosas. Após três ciclos rápidos de congelamento-degelo em nitrogênio líquido e um banho de água a 37 °C, a suspensão foi colocada em um refrigerador (4 °C) por 5 min, e as amostras de sobrenadante celular foram obtidas após a centrifugação (10 000 rpm, 10 min). As amostras dos poços A1-A6 foram utilizadas para medir o nível de glutationa total (GSH + GSSG). A solução de NADPH (0,5 mg mL-1) foi adicionada para reduzir todo o glutationa ao GSH, então, 5,5′-dithiobis-(2-nitrobenzoic acid) (DTNB) foi usado para oxidar o GSH, a absorvância alterada a 405 nm foi registrada por um leitor de microplaca (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Amostras de poços A′1-A′6 foram usadas para medir o nível de glutationa oxidado (GSSG). Ao usar a solução removedora de GSH, apenas o GSSG foi deixado na solução da amostra. As amostras foram analisadas através do mesmo método descrito acima para medir o nível de GSSG. A quantidade total de glutatião e a quantidade de glutatião oxidado foram coletadas para calcular o nível de glutatião reduzido enquanto o nível de GSH de células em meio de cultura puro foi usado como controle. Os resultados foram apresentados como média ± SD.
000 rpm, 10 min). As amostras dos poços A1-A6 foram utilizadas para medir o nível de glutationa total (GSH + GSSG). A solução de NADPH (0,5 mg mL-1) foi adicionada para reduzir todo o glutationa ao GSH, então, 5,5′-dithiobis-(2-nitrobenzoic acid) (DTNB) foi usado para oxidar o GSH, a absorvância alterada a 405 nm foi registrada por um leitor de microplaca (VICTOR™ X3 PerkinElmer 2030 Multilabel Plate Reader).35,36 Amostras de poços A′1-A′6 foram usadas para medir o nível de glutationa oxidado (GSSG). Ao usar a solução removedora de GSH, apenas o GSSG foi deixado na solução da amostra. As amostras foram analisadas através do mesmo método descrito acima para medir o nível de GSSG. A quantidade total de glutatião e a quantidade de glutatião oxidado foram coletadas para calcular o nível de glutatião reduzido enquanto o nível de GSH de células em meio de cultura puro foi usado como controle. Os resultados foram apresentados como média ± SD.
Poços na linha B e B′ foram utilizados para testar a quantidade total de GSH e GSSG na presença de mPEGA-480, respectivamente, através do mesmo procedimento.
Resultados e discussão
3.1 Estudo de viabilidade celular
Quando se utilizou célula de HeLa (um modelo de células cancerígenas) (Fig. 2A), a citotoxicidade de todos os oligómeros de PEG em baixas concentrações (≤5 mg mL-1) poderia ser negligenciada. Com o aumento da concentração (≥10 mg mL-1), foi observada a citotoxicidade dependente do peso molecular das amostras de PEG. O trietilenoglicol (TEG) mostrou evidente citotoxicidade acima de 10 mg mL-1 (p < 0,05; contraste com qualquer outro oligómero quando a concentração é superior a 5 mg mL-1) e o valor IC50 do TEG para células de HeLa foi calculado como 19,8 mg mL-1. Enquanto isso, outros oligómeros de PEG (Mn ∼ 400-4000) também mostraram uma pequena citotoxicidade.
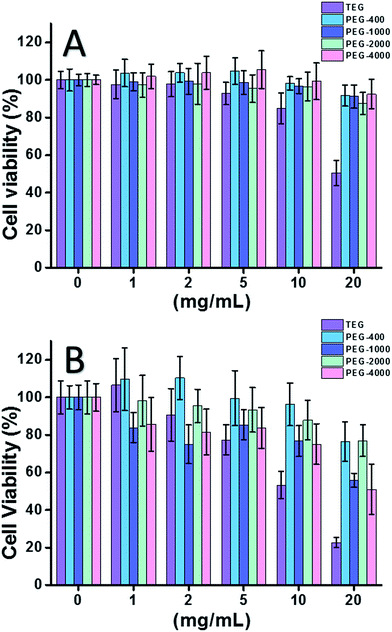
A citotoxicidade dos oligómeros de PEG para células L929 (um modelo de células normais) também foi avaliada (Fig. 2B). A viabilidade celular diminuiu com o aumento da concentração de PEG, como esperado. Além do TEG, alguns oligômeros de PEG (PEG-1000, PEG-4000) que são seguros para as células de HeLa também mostraram citotoxicidade detectável, os valores de IC50 de TEG, PEG-1000 e PEG-4000 foram calculados como 12,4, 22,5 e 20,0 mg mL-1 para células L929, respectivamente, indicando também a citotoxicidade dependente do peso molecular dos oligômeros de PEG.
Os resultados acima sugeriram que as células de HeLa têm melhor tolerância aos oligómeros de PEG do que as células de L929 devido à vitalidade tenaz das células cancerosas, e o TEG tem uma citotoxicidade muito maior do que outros oligómeros de PEG com maior peso molecular (p < 0,05; contraste com qualquer outro oligómero quando a concentração é superior a 5 mg mL-1). Observa-se que a pesquisa atual demonstrou a citotoxicidade moderada das células PEG-1000 e PEG-4000 para L929, e a quase não citotoxicidade do PEG-400 e PEG-2000, que é diferente com a impressão comum de que os PEG de alto peso molecular devem ser mais biocompatíveis do que seus homólogos de baixo peso molecular. Embora a razão da citotoxicidade do PEG ainda não esteja clara, o PEG-400 e o PEG-2000 parecem ser melhores escolhas para as pessoas sintetizarem materiais biocompatíveis.
Quando o mPEGMA-500 foi testado, a viabilidade celular das células de HeLa e L929 diminuiu com o aumento da concentração de mPEGMA-500 (Fig. 3A), e nenhuma diferença aparente entre dois tipos de células foi observada. Os valores de IC50 da mPEGMA-500 são 4,7 mg mL-1 para células HeLa, e 5,3 mg mL-1 para células L929 após cultura 24 h, indicando citotoxicidade mais significativa da mPEGMA-500 do que os oligómeros de PEG acima mencionados, e implicando que os grupos terminais da cadeia de derivados de PEG são cruciais para a sua toxicidade. Quando mPEGMA-950, outro metacrilato à base de PEG com o mesmo grupo terminal de cadeia mas maior peso molecular foi testado através do mesmo procedimento (Fig. 3B), foi observada uma citotoxicidade muito menor da mPEGMA-950 para células HeLa ou células L929 (p < 0,05; quando a concentração é superior a 2 mg mL-1), os valores de IC50 da mPEGMA-950 são 20,8 mg mL-1 para células HeLa, e 21.7 mg mL-1 a células L929 após cultura 24 h, demonstrando também a citotoxicidade molecular dependente do peso do metacrilato à base de PEG.
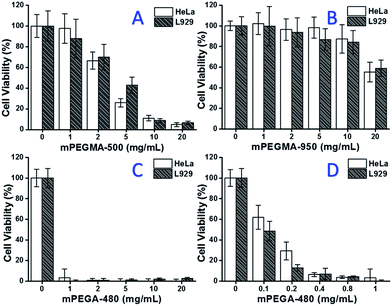
Outras vezes, o acrilato à base de PEG mPEGA-480 também foi testado. Embora a diferença entre mPEGA-480 e mPEGMA-500 seja apenas um grupo metilo no final da cadeia, o mPEGA-480 mostrou citotoxicidade aguda (Fig. 3C). Mais de 95% das células perderam viabilidade mesmo com 1 mg mL-1 mPEGA-480 no meio de cultura. Assim, experimentos adicionais devem ser realizados com concentrações menores para determinar sua citotoxicidade (Fig. 3D), e os valores de IC50 da mPEGA-480 foram calculados como 0,2 mg mL-1 para células de HeLa e 0,1 mg mL-1 para células de L929 após cultura de 24 h.
Os experimentos de viabilidade celular confirmaram que tanto os grupos terminais da cadeia quanto o peso molecular são importantes elementos de influência na citotoxicidade dos derivados de PEG, e os monômeros à base de PEG mostraram uma citotoxicidade muito mais perceptível em comparação com os oligômeros de PEG.
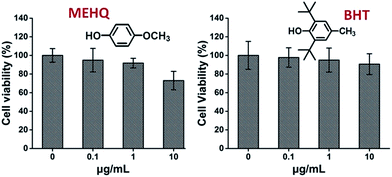
Meanwhile, the cytotoxicity of inhibitors in PEG-based monomers, hydroquinone methyl ether (MEHQ, 100 ppm in mPEGA) and butylated hydroxytoluene (BHT, 300 ppm in mPEGMA), were also evaluated (Fig. 4), and the L929 cells remained high viability (≥90%) at low concentrated inhibitors (≤1 μg mL-1). Há 0,1 μg mL-1 de MEHQ em 1 mg mL-1 de mPEGA-480, e 3 μg mL-1 de BHT em 10 mg mL-1 de mPEGA-500, enquanto mPEG-480 e mPEGMA-500 demonstraram evidente citotoxicidade nessas concentrações. Assim, os inibidores de quantidade de traços em monômeros baseados em PEG pareciam ter influência insignificante na citotoxicidade dos monômeros.
3.2 Observação da morfologia celular
Observação do microscópio óptico foi utilizada para avaliar diretamente a citotoxicidade dos derivados de PEG para células L929. As imagens ópticas das células L929 expostas a 20 mg mL-1 TEG e 0,1 mg mL-1 mPEGA durante 24 h foram mostradas na Fig. 5A e B, respectivamente.
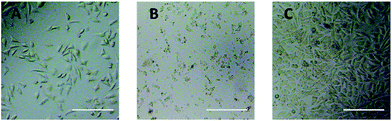
Após incubação com 20 mg mL-1 TEG durante 24 h, as células mantiveram a morfologia semelhante (Fig. 5A) com o grupo controle (Fig. 5C, células em meio de cultura puro), mas o número de células diminuiu drasticamente, indicando a citotoxicidade do TEG em alta concentração, o que levou à morte e seguiu o descolamento das células do fundo da microplaca. Fig. 5B mostrou a morfologia das células L929 após a incubação com 0,1 mg mL-1 mPEGA-480. Quase todas as células perderam morfologia normal, sugerindo a citotoxicidade aguda do mPEGA-480 mesmo em tão baixa concentração.
Adicionalmente, as células também foram coradas com fluoresceína. A dupla coloração FDA/PI é um procedimento rápido, simples e simultâneo para observar as células vivas e mortas.43 A FDA pode entrar nas células completas e acumular-se nas células, portanto, a membrana celular completa é necessária para prevenir o vazamento da fluoresceína da célula. Em contraste, a PI não pode passar através da membrana celular intacta, mas pode manchar o núcleo das células mortas ao passar através da membrana celular danificada. Como mostrado na Fig. 6, células L929 incubadas com 20 mg mL-1 TEG têm menos células viáveis após a coloração da FDA (Fig. 6b) em comparação com o controle (Fig. 6a), e mais células mortas podem ser observadas após a coloração da PI (Fig. 6b), e mais células mortas podem ser observadas após a coloração da PI (Fig. 6b). 6b′), idêntico ao resultado por observação através de microscopia óptica. A citotoxicidade aguda do mPEGA-480 também foi observada após o procedimento de dupla coloração FDA/PI, não foi possível identificar sinal verde após a incubação de células com 0,1 mg mL-1 mPEG-480 durante 24 h (Fig. 6c e c′′).
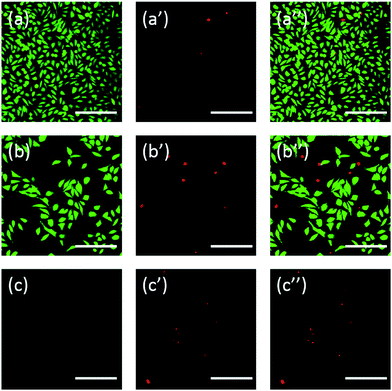
As imagens ópticas e fluorescentes demonstraram intuitivamente a citotoxicidade desses derivados do PEG, apoiando ainda mais a conclusão obtida através dos ensaios CCK-8. Observa-se que o mPEGA-480 pareceu mais tóxico pelo ensaio de dupla coloração FDA/PI, que é atribuído ao ensaio de dupla coloração FDA/PI que distingue a completude da membrana celular viva/morta enquanto o ensaio CCK-8 detecta a atividade da desidrogenase nas mitocôndrias, sugerindo a coloração FDA/PI um excelente suplemento do ensaio CCK-8 para oferecer mais detalhes sobre o estado celular.
3.3 Estudo do mecanismo
De acordo com os experimentos de viabilidade celular, os valores de IC50 dos oligômeros de PEG e dos monômeros baseados no PEG para células HeLa e L929 após cultura de 24 h foram calculados e resumidos (Tabela 1), sugerindo que os monômeros baseados no PEG são muito mais tóxicos para as células do que os oligômeros de PEG, e o mPEGA tem a maior citotoxicidade. A geração de ROS e o declínio do GSH nas células, dois mecanismos principais de citotoxicidade foram, portanto, analisados para sondar a possível razão da citotoxicidade.
| TEG | PEG-400 | PEG-1000 | PEG-2000 | PEG-4000 | mPEGMA-500 | mPEGMA-950 | mPEGA-480 | |
|---|---|---|---|---|---|---|---|---|
| Células HeLa | 19.8 | 32,5 | 36,2 | 38,2 | 29,6 | 4,7 | 20,8 | 0,2 |
| L929 células | 12,4 | 24.7 | 22,5 | 28,7 | 20,0 | 5,3 | 21,7 | 0,1 |
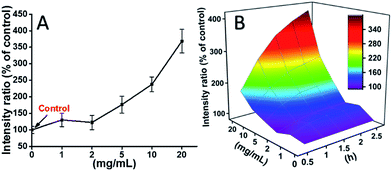
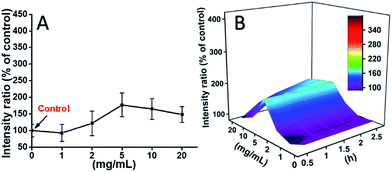
L929 células foram incubadas com TEG, e os níveis de ROS em diferentes pontos de tempo (0, 0,5, 1,0, 1,5, 2 h) foram detectados de acordo com nossos relatórios anteriores e mostrados na Fig. 7. Como exemplo, os níveis de ROS após a incubação com diferentes concentrações de TEG durante 2 h foram mostrados na Fig. 7A. É evidente que os níveis de ROS se mantiveram estáveis com baixa concentração de TEG (≤2 mg mL-1), mas aumentaram significativamente quando a concentração de TEG é maior que 2 mg mL-1, consistente com o resultado do experimento de viabilidade celular da Fig. 2B. Da mesma forma, as figuras de nível ROS vs. concentração de TEG em diferentes pontos de tempo foram desenhadas e fundidas para obter um mapa 3D (Fig. 7B). Os níveis máximos de ROS foram encontrados em 2 h com 20 mg mL-1 TEG, um aumento de aproximadamente 400% no nível de ROS sobre controle (nível ROS = 100) foi detectado, resultando na intensidade de fluorescência mais brilhante. Esses resultados sugerem que a geração de ROS é o possível mecanismo da citotoxicidade do TEG, e o alto nível de ROS induzido pelo TEG pode ser a principal razão para a apoptose celular.
Os níveis de ROS induzidos por mPEGA-480 após 2 h também foram testados (Fig. 8A). Diferente do TEG, mPEGA não causou o rápido aumento de ROS nas células, apenas o aumento de ROS em ∼170% comparado com o controle foi observado como o máximo. O nível 3D de ROS vs. mPEGA & tempo (Fig. 8B) mostrou o nível de ROS induzido pelo mPEGA-480 como uma onda e a crista apareceu em concentração moderada de mPEGA (5 mg mL-1), nenhuma geração significativa de ROS pode ser observada, sugerindo que a geração de ROS poderia contribuir apenas parcialmente para a citotoxicidade do mPEGA-480.
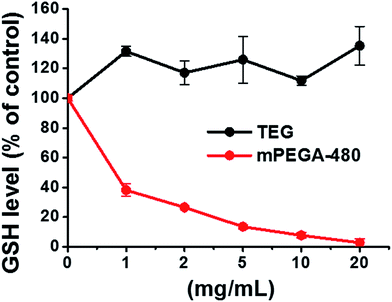
O grupo redutor de tiol em GSH é uma importante fonte anti-oxidante em organismos. Um possível mecanismo para a citotoxicidade do mPEGA-480 é atribuído à reação de adição de Michael entre o grupo tiol e a ligação vinílica, levando ao equilíbrio de redox intracelular quebrado e à apoptose celular. Pesquisas anteriores sugeriram que a adição de Michael entre tiol e acrilato é muito mais rápida do que entre tiol e metacrilato,52 o que pode ser uma causa razoável para a citotoxicidade aguda diferente entre mPEGA-480 e mPEGMA-500.
Conclusões
A citotoxicidade dos oligômeros de PEG e dos monômeros baseados em PEG para células HeLa e células L929 foram avaliadas pela primeira vez. A citotoxicidade dependente da concentração de oligómeros de PEG e monómeros baseados em PEG foi confirmada e apresentada como valores de IC50 às células de HeLa e às células de L929. O PEG-400, PEG-2000 parece quase não citotóxico na pesquisa atual. O PEG-1000, PEG-4000 e mPEGMA-950 mostraram citotoxicidade moderada, especialmente em alta concentração. TEG e mPEGMA-500 mostraram citotoxicidade significativa, e mPEGA-480 mostrou citotoxicidade aguda. Além disso, os tipos celulares também influenciam os resultados do estudo de citotoxicidade, as células HeLa são mais robustas que as células L929 para tolerar os derivados de PEG. Estes resultados sobre a citotoxicidade dos derivados do PEG são preliminares mas fundamentais para a sua futura aplicação biomédica, mais informações sobre a resposta celular e o comportamento a outros derivados do PEG serão investigados mais aprofundadamente.
Acknowledgements
Esta pesquisa foi apoiada pela National Science Foundation of China (21574073, 21534006).
- M. V. Cleveland, D. P. Flavin, R. A. Ruben, R. M. Epstein e G. E. Clark, South. Med. J., 2001, 94, 478-481 CrossRef CAS PubMed.
- J. A. DiPalma, M. V. B. Cleveland, J. McGowan e J. L. Herrera, Am. J. Gastroenterol., 2007, 102, 1436-1441 CrossRef CAS PubMed.
- B. A. Erickson, J. C. Austin, C. S. Cooper e M. A. Boyt, J. Urol., 2003, 170, 1518-1520 CrossRef CAS PubMed.
- J. L. Cleland, S. E. Builder, J. R. Swartz, M. Winkler, J. Y. Chang e D. I. C. Wang, Bio/Technology, 1992, 10, 1013-1019 CrossRef CAS PubMed.
- Z. Liu, J. T. Robinson, X. M. Sun e H. J. Dai, J. Am. Chem. Soc., 2008, 130, 10876-10877 CrossRef CAS PubMed.
- J. M. Harris e R. B. Chess, Nat. Rev. Drug Discovery, 2003, 2, 214-221 CrossRef CAS PubMed.
- F. M. Veronese e G. Pasut, Drug Discovery Today, 2005, 10, 1451-1458 CrossRef CAS PubMed.
- M. J. Roberts, M. D. Bentley e J. M. Harris, Adv. Drug Delivery Rev., 2002, 54, 459-476 CrossRef CAS PubMed.
- F. M. Veronese, Biomaterials, 2001, 22, 405-417 CrossRef CAS PubMed.
- H. Zhang, T. Zhao, P. Duffy, Y. Dong, A. Ni Annaidh, E. O’Cearbhaill e W. Wang, Adv. Healthcare Mater., 2015, 4, 2260-2268 CrossRef CAS PubMed.
- Y. Dong, Y. Qin, M. Dubaa, J. Killion, Y. Gao, T. Zhao, D. Zhou, D. Duscher, L. Geever, G. C. Gurtner e W. Wang, Polym. Chem., 2015, 6, 6182-6192 RSC.
- T. M. Allen, C. Hansen, F. Martin, C. Redemann e A. Yauyoung, Biochim. Biophys. Acta, Biomembr., 1991, 1066, 29-36 CrossRef CAS.
- Y. L. Zhang, L. Tao, S. X. Li e Y. Wei, Biomacromolecules, 2011, 12, 2894-2901 CrossRef CAS PubMed.
- Y. L. Zhang, B. Yang, L. X. Xu, X. Y. Zhang, L. Tao e Y. Wei, Acta Chim. Sin., 2013, 71, 485-492 CrossRef CAS.
- C. C. Luo, Y. H. Zhang, X. W. Zeng, Y. W. Zeng e Y. G. Wang, J. Colloid Interface Sci., 2005, 288, 444-448 CrossRef CAS PubMed.
- S. Dhar, F. X. Gu, R. Langer, O. C. Farokhzad e S. J. Lippard, Proc. Natl. Acad. Sci. U. S. A., 2008, 105, 17356-17361 CrossRef CAS PubMed.
- J. Manson, D. Kumar, B. J. Meenan e D. Dixon, Gold Bull., 2011, 44, 99-105 CrossRef CAS.
- X. Y. Zhang, C. K. Fu, L. Feng, Y. Ji, L. Tao, Q. Huang, S. X. Li e Y. Wei, Polymer, 2012, 53, 3178-3184 CrossRef CAS.
- X. Y. Zhang, J. F. Hui, B. Yang, Yang, Yang, D. D. D. Fan, M. Y. Liu, L. Tao e Y. Wei, Polym. Chem., 2013, 4, 4120-4125 RSC.
- D. Bontempo e H. D. Maynard, J. Am. Chem. Soc., 2005, 127, 6508-6509 CrossRef CAS PubMed.
- K. L. Heredia, Z. P. Tolstyka e H. D. Maynard, Macromolecules, 2007, 40, 4772-4779 CrossRef CAS.
- H. Hussain, K. Y. Mya e C. He, Langmuir, 2008, 24, 13279-13286 CrossRef CAS PubMed.
- J. P. Magnusson, S. Bersani, S. Salmaso, C. Alexander e P. Caliceti, Bioconjugate Chem., 2010, 21, 671-678 CrossRef CAS PubMed.
- F. J. Xu, Y. L. Li, E. T. Kang e K. G. Neoh, Biomacromolecules, 2005, 6, 1759-1768 CrossRef CAS PubMed.
- L. L. Yu, L. Yao e K. Yang, J. Porous Mater., 2016, 23, 1581-1589 CrossRef CAS.
- S. Yuan, D. Wan, B. Liang, S. O. Pehkonen, Y. P. Ting, K. G. Neoh e E. T. Kang, Langmuir, 2011, 27, 2761-2774 CrossRef CAS PubMed.
- S. A, Q. Xu, D. Zhou, Y. Gao, J. M. Vasquez, U. Greiser, W. Wang, W. Liu e W. Wang, Polym. Chem., 2017, 8, 1283-1287 RSC.
- H. F. Smyth, C. P. Carpenter e C. S. Weil, J. Am. Pharm. Assoc., 1950, 39, 349-354 CrossRef CAS.
- H. F. Smyth, C. P. Carpenter e C. S. Weil, J. Am. Pharm. Assoc., 1955, 44, 27-30 CrossRef CAS.
- D. E. Prentice e S. K. Majeed, Toxicol. Lett., 1978, 2, 119-122 CrossRef CAS.
- H. Tominaga, M. Ishiyama, F. Ohseto, K. Sasamoto, T. Hamamoto, K. Suzuki e M. Watanabe, Anal. Commun., 1999, 36, 47-50 RSC.
- Y. Li, Y. Zhang, F. Shi, L. Tao, Y. Wei e X. Wang, Colloids Surf., B, 2016, 149, 168-173 CrossRef PubMed.
- B. Yang, Y. Zhang, X. Zhang, L. Tao, S. Li e Y. Wei, Polym. Chem., 2012, 3, 3235-3238 RSC.
- H. Wang e J. A. Joseph, Free Radical Biol. Med., 1999, 27, 612-616 CrossRef CAS PubMed.
- I. K. Smith, T. L. Vieweller e C. A. Thorne, Anal. Biochem., 1988, 175, 408-413 CrossRef CAS PubMed.
- I. Rahman, A. Kode e S. K. Biswas, Nat. Protoc., 2006, 1, 3159-3165 CrossRef CAS PubMed.
- R. Jevprasesphant, J. Penny, R. Jalal, D. Attwood, N. B. McKeown e A. D’Emanuele, Int. J. Pharm., 2003, 252, 263-266 CrossRef CAS PubMed.
- A. K. Gupta e S. Wells, IEEE Trans. Nanobioscience, 2004, 3, 66-73 CrossRef PubMed.
- D. Luo, K. Haverstick, N. Belcheva, E. Han e W. M. Saltzman, Macromolecules, 2002, 35, 3456-3462 CrossRef CAS.
- C. W. Chang, E. Bays, L. Tao, S. N. S. Alconcel e H. D. Maynard, Chem. Commun., 2009, 3580-3582 RSC.
- B. D. Fairbanks, P. A. Gunatillake e L. Meagher, Adv. Drug Delivery Rev., 2015, 91, 141-152 CrossRef CAS PubMed.
- T. Zhou, Y. Zhu, X. Li, X. Liu, K. W. K. Yeung, S. Wu, X. Wang, Z. Cui, X. Yang e P. K. Chu, Prog. Mater. Sci., 2016, 83, 191-235 CrossRef CAS.
- K. H. Jones e J. A. Senft, J. Histochem. Cytochem., 1985, 33, 77-79 CrossRef CAS PubMed.
- M. Hayyan, M. A. Hashim e I. M. AlNashef, Chem. Rev., 2016, 116, 3029-3085 CrossRef CAS PubMed.
- A. Lankoff, W. J. Sandberg, A. Wegierek-Ciuk, H. Lisowska, M. Refsnes, B. Sartowska, P. E. Schwarze, S. Meczynska-Wielgosz, M. Wojewodzka e M. Kruszewski, Toxicol. Lett., 2012, 208, 197-213 CrossRef CAS PubMed.
- Y. Chang, S.-T. Yang, J.-H. Liu, E. Dong, Y. Wang, A. Cao, Y. Liu e H. Wang, Toxicol. Lett., 2011, 200, 201-210 CrossRef CAS PubMed.
- X. Cai, J. Hao, X. Zhang, B. Yu, J. Ren, C. Luo, Q. Li, Q. Huang, X. Shi, W. Li e J. Liu, Toxicol. Appl. Pharmacol., 2010, 243, 27-34 CrossRef CAS PubMed.
- S. J. Park, Y. C. Park, S. W. Lee, M. S. Jeong, K.-N. Yu, H. Jung, J.-K. Lee, J. S. Kim e M.-H. Cho, Toxicol. Lett., 2011, 207, 197-203 CrossRef CAS PubMed.
- K. Pulskamp, S. Diabate e H. F. Krug, Toxicol. Lett., 2007, 168, 58-74 CrossRef CAS PubMed.
- A. M. Studer, L. K. Limbach, L. Van Duc, F. Krumeich, E. K. Athanassiou, L. C. Gerber, H. Moch e W. J. Stark, Toxicol. Lett., 2010, 197, 169-174 CrossRef CAS PubMed.
- T. Thurnherr, C. Brandenberger, K. Fischer, L. Diener, P. Manser, X. Maeder-Althaus, J.-P. Kaiser, H. F. Krug, B. Rothen-Rutishauser e P. Wick, Toxicol. Lett., 2011, 200, 176-186 CrossRef CAS PubMed.
- G. Li, R. K. Randev, A. H. Soeriyadi, G. Rees, C. Boyer, Z. Tong, T. P. Davis, C. R. Becer e D. M. Haddleton, Polym. Chem., 2010, 1, 1196-1204 RSC.
