A circulação uterina é extremamente sensível à estimulação do estrogênio, respondendo com um grau de vasodilatação sem paralelo por qualquer outro órgão do corpo a qualquer outro estímulo.2 Durante o ciclo ovariano, padrões repetitivos de UBF ocorrem refletindo o efeito da secreção de estrogênio e os efeitos moduladores da progesterona. Estes padrões cíclicos são demonstrados mais dramaticamente em animais com fases curtas do ciclo pré-ovulatório, como a vaca, a porca e a ovelha, e são ilustrados na Figura 1 com níveis periféricos de estrogênio e progesterona.3, 4, 5 Após a concepção nestas espécies, os padrões de UBF são semelhantes aos de animais não prenhes até que a interdigitação dos tecidos materno e fetal ocorra 17 a 28 dias depois; então, há um aumento definitivo e progressivo na UBF que continua até a gestação a termo. Como a erosão do endométrio pelo trofoblasto fetal ocorre muito mais cedo após a concepção no primata, é razoável presumir que a UBF aumenta mais cedo nestas espécies, embora tais respostas nunca tenham sido observadas. Os padrões gerais de UBF total, UBF por unidade de peso do útero e seu conteúdo, fração de UBF que fornece a placenta e peso fetal durante toda a gestação ovina são ilustrados na Figura 2. O período entre 17 e 70 dias de gestação está associado às alterações mais rápidas da FBU e FBP e corresponde ao tempo de placentação definitiva nesta espécie. Por mecanismos mal compreendidos, os vasos sanguíneos que fornecem a placenta dilatam-se progressivamente durante este tempo, provocando simultaneamente um aumento absoluto da FBP total e um desvio deste sangue dos tecidos não placentários para os tecidos placentários.* Com a maturação subsequente da placenta, a fracção de FBP que fornece a placenta e a quantidade absoluta de FBP aumenta, mas a taxas mais semelhantes às do crescimento fetal; assim, durante a última metade da gravidez, a FBP por unidade de peso do útero e o seu conteúdo é essencialmente constante. Durante este mesmo tempo, a quantidade de oxigénio extraído de cada mililitro de sangue é constante e, portanto, a quantidade de oxigénio fornecido por peso dado do útero grávido é também constante.6 Estudos correlativos em mulheres indicam padrões homeostáticos semelhantes das 10 às 40 semanas de gestação e consumo de oxigénio semelhante (aproximadamente 10 ml/kg).7 Uma vez que as mulheres fornecem a mesma quantidade de oxigénio a taxas de FBU inferiores às da ovelha (~150 versus ~270 ml/kg), conclui-se que a placenta humana é mais eficiente a este respeito. Assim, para fetos de peso semelhante, é necessário menos UBF absoluta e a carga de gravidez no coração é diminuída.
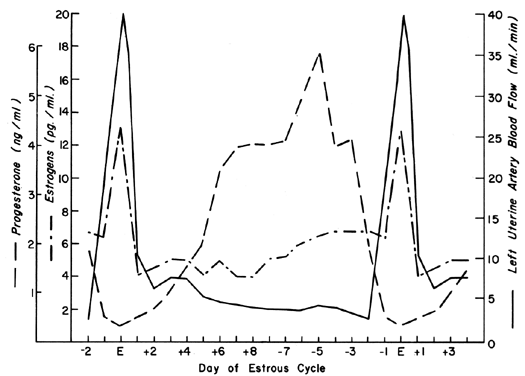 Fig. 1. Padrão unilateral do fluxo sanguíneo uterino durante o ciclo do estrogênio ovino mostrado com níveis séricos relatados de estrogênios e progesterona (Adaptado de Greiss FC, Jr, Anderson SG: Am J Obstet Gynecol 103:629, 1969; Yuthasastrakosol P et al: J Reprod Fertil 43:57, 1975.)
Fig. 1. Padrão unilateral do fluxo sanguíneo uterino durante o ciclo do estrogênio ovino mostrado com níveis séricos relatados de estrogênios e progesterona (Adaptado de Greiss FC, Jr, Anderson SG: Am J Obstet Gynecol 103:629, 1969; Yuthasastrakosol P et al: J Reprod Fertil 43:57, 1975.)
 Fig. 2. Padrões longitudinais do fluxo sanguíneo uterino e sua distribuição durante a gravidez ovina.
Fig. 2. Padrões longitudinais do fluxo sanguíneo uterino e sua distribuição durante a gravidez ovina.
Alterações na PBF são realizadas por uma vasodilatação sempre crescente dos vasos sanguíneos que fornecem a placenta ao longo do curso da gestação. No entanto, a qualquer momento durante o segundo e terceiro trimestres, essencialmente não pode ocorrer mais vasodilatação aguda destes vasos. Portanto, para manter constante o fornecimento de oxigénio durante os episódios de redução da PBF, deve ocorrer uma maior extracção de oxigénio (Fig. 3). Com base nos dados relatados, parece que o limite de aumento da extração é o dobro. Assim, a PBF tem que ser reduzida em mais de 50% antes que o fornecimento de oxigénio seja diminuído. Estas considerações assumem que a taxa de PBF homeostática era ótima antes da redução do fluxo. Sabemos, no entanto, que os níveis homeostáticos podem estar abaixo do ideal, seja subagualmente, como na toxemia, ou cronicamente, como nas nefropatias. Nesses casos, o fator de segurança, ou seja, a porcentagem de PBF que pode ser reduzida antes que o fornecimento de oxigênio seja comprometido, é reduzida. Isso deve ser sempre considerado quando se avalia o efeito de um estímulo agudo no feto.
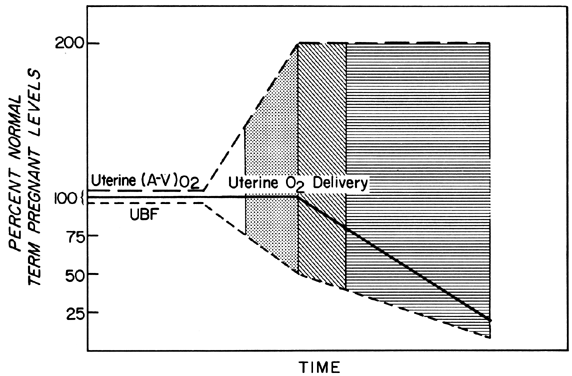 Fig. 3. Alterações na extração de oxigênio arteriovenoso uterino -(A-V)02 – em resposta a reduções no fluxo sanguíneo uterino durante a segunda metade da gestação ovina. Como o (A-V)02 pode ser duplicado, o parto uterino 02 será mantido em níveis homeostáticos até que o fluxo sanguíneo uterino seja reduzido em mais de 50%. As áreas claras, pontilhadas e forradas indicam graus hipotéticos de reserva fetal quando definidas como uma função do fluxo sanguíneo placentário ideal e são usadas para indicar níveis semelhantes de reserva fetal em ilustrações subsequentes. (Adaptado de Huckabee WE, Metcalfe J, Prystowsky H et al: Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
Fig. 3. Alterações na extração de oxigênio arteriovenoso uterino -(A-V)02 – em resposta a reduções no fluxo sanguíneo uterino durante a segunda metade da gestação ovina. Como o (A-V)02 pode ser duplicado, o parto uterino 02 será mantido em níveis homeostáticos até que o fluxo sanguíneo uterino seja reduzido em mais de 50%. As áreas claras, pontilhadas e forradas indicam graus hipotéticos de reserva fetal quando definidas como uma função do fluxo sanguíneo placentário ideal e são usadas para indicar níveis semelhantes de reserva fetal em ilustrações subsequentes. (Adaptado de Huckabee WE, Metcalfe J, Prystowsky H et al: Blood flow and oxygen consumption of the pregnant uterus. Physiol 200:274, 1961.)
*No homem e nos primatas sub-humanos, as arteríolas espirais que irão suprir o espaço intervilar (aproximadamente uma por cotilédone placentário) perdem suas conexões capilares e dilatam cerca de dez vezes como resultado da substituição das paredes dos vasos por trofoblasto. Este processo pode estender-se até ou abaixo da junção mioendometrial, transformando literalmente as arteríolas espirais em artérias espiraladas. O sangue que flui através destes vasos sanguíneos modificados para o espaço intervilar compreende PBF.
Na espécie ovina, múltiplas áreas discretas de endométrio chamadas carúnculos estão presentes no estado não grávido. Durante a gravidez, a interdigitação dos tecidos fetal e materno ocorre nestes carúnculos, que se alargam para se tornarem cotilédones placentários individuais. O sangue que flui para estas áreas compreende a PBF. Embora os vasos sanguíneos arteriais cotilédicos se dilatam significativamente, não contêm elementos trofoblásicos, a transferência materno-fetal é feita por uma interface capilar-capilar, e não há espaço intervilloso presente.
Respostas Dinâmicas da Circulação Uterina
Os vasos sanguíneos do útero não grávido respondem de forma semelhante aos de qualquer outro órgão muscular, com exceção de sua reatividade única à estimulação estrogênica, sua resposta aos agentes anestésicos locais e, possivelmente, sua resposta às prostaglandinas (Tabela 1). Durante a gravidez, os vasos sanguíneos que fornecem a placenta dilatam-se progressivamente, atingindo um estado em que pode ocorrer uma dilatação mínima ou nenhuma outra aguda.24 Portanto, os estímulos que evocam vasodilatação no útero não grávido são ineficazes após a placentação definitiva ter ocorrido. No entanto, os vasos placentários mantêm a sua capacidade de vasoconstrução como no estado não grávido. Como a FBP aproxima-se de 80% a 90% da FBP total na gravidez a termo, as respostas vasculares uterinas totais aparecerão como as dos vasos da placenta. Este ponto é frequentemente mal interpretado, e é preciso lembrar que as respostas dos vasos não placentários são as mesmas quer a gravidez esteja presente ou não.
TÁBULO 1. Respostas da Vasculatura Uterina Não Grávida*
|
Vasoconstrição |
Vasodilatação |
|
α-Estimulação adrenérgica |
β-Adrenérgica |
|
(dopamina, epinefrina, |
(isoproterenol, epinefrina)8,9,16> |
|
norepinefrina)8,9,10 |
Acetilcolina e agentes parassimpaticomiméticos23 |
|
Simpaticomiméticos agentes11 |
Adenosinas17 |
|
(drogas vasopressoras) |
Bradykinin17,18 |
|
Hipoxemia(grave)12 |
Cyanide19 |
|
Agentes anestésicos locais |
Atubstâncias estrogénicas |
|
(administração intra-arterial)13,14 |
(efeito retardado mas prolongado)2 |
|
Nicotina |
Glucosamina |
|
(α-adrenergic mediação)15 |
(? efeito osmótico)21 |
|
Hipoxemia (suave)12 |
|
|
Ischemia19 |
|
|
Nitroglicerina19 |
|
|
Prostaglandinas E1, E2, e I18,22 |
|
|
Polipídeo intestinal vasoativo20 |
* A dilatação marcada dos vasos sanguíneos que fornecem a placenta e a distribuição preponderante do fluxo sanguíneo uterino para as respostas grávidas obliteradas da placenta; Portanto, os efeitos dos estímulos vasodilatadores durante a gravidez são controversos. Quando testadas, as respostas vasculares não placentárias são semelhantes às respostas não grávidas.
A estrutura hemocorial da placenta humana acrescenta um factor único àqueles que normalmente controlam o fluxo sanguíneo em outros leitos vasculares. Ou seja, o sangue atravessa as artérias espiraladas para entrar no espaço intervilar pantanoso, perfuma as vilosidades fetais, e depois retorna à circulação geral por muitas veias coletoras na placa basal. Efectivamente, o sangue deixa os canais vasculares normais para circular num novo espaço extravascular enxertado no útero durante a gravidez. Uma vez que o espaço interviloso se encontra dentro da cavidade uterina e que a placenta é uma estrutura flexível, a pressão gerada pelo miométrio contraído será transmitida igualmente à cavidade amniótica e ao espaço interviloso. Assim, um fator estranho ao controle vascular habitual, a atividade miométrica, pode alterar a pressão do espaço intervilar e influenciar a FBP pelos seus efeitos na pressão de perfusão. Uma representação esquemática do fluxo sanguíneo para os tecidos não placentários e para um único cotilédone é mostrada na Figura 4, juntamente com as fórmulas pertinentes ao controle de cada um. Deve-se notar que estas fórmulas são apenas aplicações da lei de Ohm a estas situações cardiovasculares individuais.
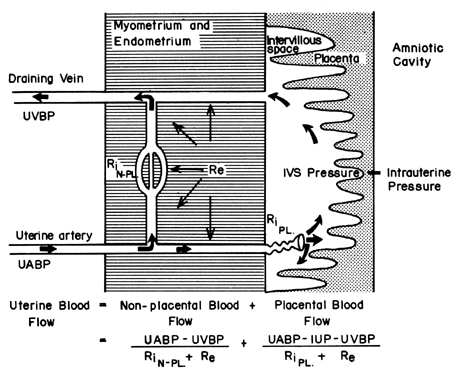 Fig. 4. Circulação nãoplacentária e placentária e os factores que afectam cada um dos primatas uterinos. A relação entre estes factores e o fluxo sanguíneo distributivo é definida na equação que acompanha o estudo. UABP, pressão arterial uterina; UVBP, pressão arterial venosa uterina; Re, resistência vascular extrínseca; RiN-PL e RiPL, resistência vascular intrínseca causada pelas reatividades das arteríolas nãoplacentárias e placentárias, respectivamente.(De Greiss FC, Jr: MCV/Q, 8:52, 1972.)
Fig. 4. Circulação nãoplacentária e placentária e os factores que afectam cada um dos primatas uterinos. A relação entre estes factores e o fluxo sanguíneo distributivo é definida na equação que acompanha o estudo. UABP, pressão arterial uterina; UVBP, pressão arterial venosa uterina; Re, resistência vascular extrínseca; RiN-PL e RiPL, resistência vascular intrínseca causada pelas reatividades das arteríolas nãoplacentárias e placentárias, respectivamente.(De Greiss FC, Jr: MCV/Q, 8:52, 1972.)
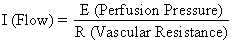
A pressão de perfusão que fornece o sangue aos tecidos não substitutos é a diferença entre a pressão arterial uterina e a venosa. No entanto, a pressão de perfusão que fornece o sangue para o espaço intervilar é a diferença entre a pressão arterial uterina e a pressão do espaço intervilar. Esta última é melhor aproximada pela pressão do líquido amniótico (IUP). Num órgão muscular, os factores de resistência incluem a resistência da reactividade do músculo liso vascular, ou resistência intrínseca (Ri), e o aperto transmitido aos vasos sanguíneos à medida que atravessam o miométrio contraído, ou resistência extrínseca (Re). Deve então ser evidente que as contracções uterinas podem afectar a PBF por dois mecanismos: aumentando o Re e reduzindo a pressão de perfusão placentária.
Na prática clínica, três características principais do controlo vascular da placenta são importantes. Estas incluem a relação entre pressão de perfusão e fluxo, as respostas das artérias espiraladas aos estímulos vasoativos e os efeitos das contrações miometriais. Além disso, os efeitos únicos dos agentes anestésicos locais devem ser apreciados.
Relação pressão-fluxo
Quando se observa mudanças na UBF secundárias a reduções na pressão de perfusão durante a quiescência mio-trial, pode-se desenvolver uma relação linear com uma inclinação de uma (Fig. 5). Isto reflete a natureza amplamente dilatada da vasculatura placentária e indica que a FBP diminuirá quase na mesma proporção que a diminuição da pressão de perfusão. Uma vez que a pressão venosa uterina é bastante constante na maioria das circunstâncias, podem ser usadas alterações na pressão arterial sistémica (MBP) para aproximar as alterações da PBF. Ou seja, uma diminuição de 25% na pressão arterial média seria esperada para causar uma diminuição de 25% na FBP. Tais medidas devem ser feitas na posição de decúbito lateral, entretanto, uma vez que a pressão do útero gravídico somente na aorta mostrou diminuição da pressão arterial na área pélvica abaixo da observada na artéria braquial.
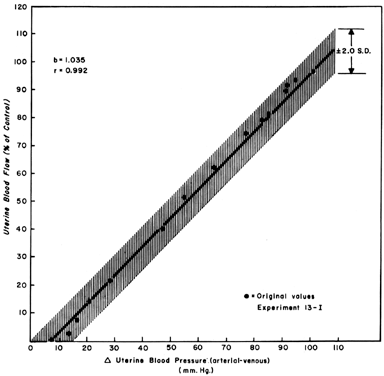 Fig. 5. Linha de regressão de pressão-fluxo determinada a partir de dados proporcionais agrupados em ovelhas grávidas a termo. Como a relação é linear, o fluxo sanguíneo uterino variará com e em proporção a qualquer alteração na pressão de perfusão (De Greiss FC, Jr: Am J Obstet Gynecol 96:41, 1966.)
Fig. 5. Linha de regressão de pressão-fluxo determinada a partir de dados proporcionais agrupados em ovelhas grávidas a termo. Como a relação é linear, o fluxo sanguíneo uterino variará com e em proporção a qualquer alteração na pressão de perfusão (De Greiss FC, Jr: Am J Obstet Gynecol 96:41, 1966.)
Responses to Vasoactive Stimuli
Desde que as artérias espirais se aproximam da dilatação máxima no estado de repouso, os agentes vasodilatadores ou estímulos têm pouco ou nenhum efeito, mesmo que os receptores para tais agentes estejam presentes. No entanto, a musculatura lisa desses vasos é extremamente sensível a agentes vasoconstritores ou estímulos, mais do que a maioria dos outros leitos vasculares periféricos (Fig. 6). Isso significa que, embora a MPB possa aumentar em resposta à estimulação por uma droga vasopressora de ação periférica como a fenilefrina, o aumento proporcional da resistência vascular placentária (Ri) é SO muito maior que o efeito líquido é uma diminuição acentuada na PBF. Tais diferenças na sensibilidade vasoconstritora devem ser consideradas sempre que uma droga vasopressora for indicada. O uso de uma droga de ação mais central como a efedrina, embora causando uma pequena quantidade de vasoconstrição placentária, resultará em uma melhora proporcionalmente maior na PBF com um aumento absoluto na PBF.
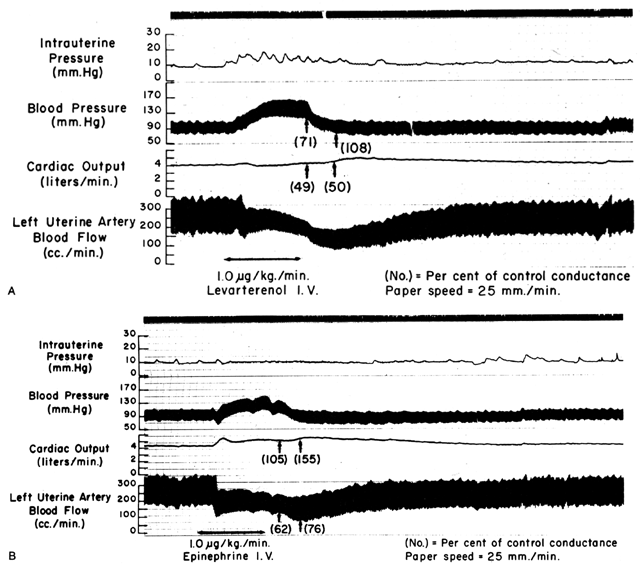 Fig. 6. Registros originais mostrando efeitos do levarterenol intravenoso ( A) (norepinefrina) e ( B) epinefrina sobre a pressão arterial materna, débito cardíaco e fluxo sanguíneo uterino na gravidez ovina a termo. Alterações proporcionais dos níveis de controle da condutância sistêmica e uterina (o recíproco de resistência) foram inseridas entre parênteses. Note que a diminuição da condutância uterina (aumento da resistência) excede a da condutância sistêmica com agentes oth. (De Greiss FC, Jr: Obstet Gynecol 21:295, 1963. Cortesia de Harper & Row, Publishers.)
Fig. 6. Registros originais mostrando efeitos do levarterenol intravenoso ( A) (norepinefrina) e ( B) epinefrina sobre a pressão arterial materna, débito cardíaco e fluxo sanguíneo uterino na gravidez ovina a termo. Alterações proporcionais dos níveis de controle da condutância sistêmica e uterina (o recíproco de resistência) foram inseridas entre parênteses. Note que a diminuição da condutância uterina (aumento da resistência) excede a da condutância sistêmica com agentes oth. (De Greiss FC, Jr: Obstet Gynecol 21:295, 1963. Cortesia de Harper & Row, Publishers.)
Contrações miométricas
Acting by the two mechanisms discussed above, increasing Re and decreasing perfusion pressure, myometrial contractions decrease PBF in direct proportion to the intensity and duration of each contraction. A relação é tão precisa que um traçado da pressão intra-uterina é quase uma imagem inversa exata do PBF (Fig. 7). Aumentar a frequência das contracções diminui a PBF durante uma determinada unidade de tempo, diminuindo a duração da diástole miométrica, tempo esse em que a PBF está a níveis homeostáticos. Além disso, se o tônus de intercontração for elevado, como em uma abrupção placentária, a PBF de intercontração será proporcionalmente reduzida. Estudos radioangiográficos em primatas sub-humanos e mulheres mostram que durante a auge das contrações miométricas de intensidade média, a PBF cessa.25 É evidente então que o parto é inerentemente estressante para o feto, já que a quantidade média de PBF perfurando as vilosidades fetais por determinado período de tempo diminui progressivamente à medida que a frequência e intensidade das contrações uterinas aumentam.
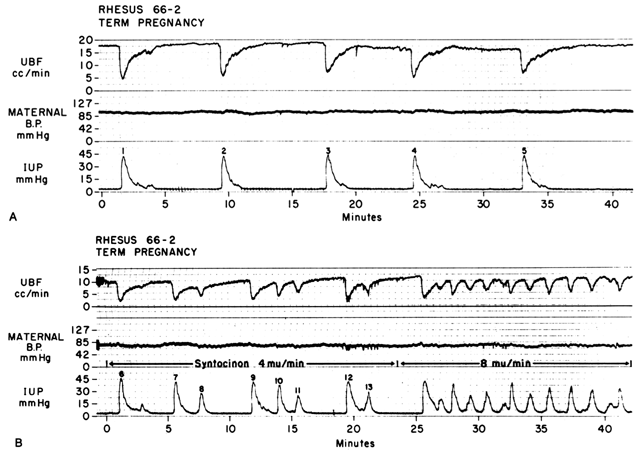 Fig. 7. A. Relação entre o fluxo sanguíneo uterino (FUB) e as contrações uterinas durante o parto espontâneo de um macaco rhesus. Note a relação inversa da imagem, diminuições nítidas na UBF no início das contracções e recuperação mais lenta da UBF dos níveis basais. A UBF recuperou os níveis basais apenas durante o tônus “normal”. B. Efeito do aumento da freqüência das contrações na UBF produzida pela estimulação da oxitocina do trabalho de parto espontâneo mostrado em A. Note que a duração das fases do tônus normal é diminuída. A taxa UBF obtida entre as contrações depende da intensidade da contração anterior e da duração da fase do tônus normal. Após as contrações 7 e 12, a recuperação do fluxo foi incompleta porque a contração seguinte ocorreu sem uma fase de tônus normal (De Greiss FC, Jr, Anderson SG: Clin Obstet Gynecol 11:96, 1968). Cortesia de Harper & Row, Publishers.)
Fig. 7. A. Relação entre o fluxo sanguíneo uterino (FUB) e as contrações uterinas durante o parto espontâneo de um macaco rhesus. Note a relação inversa da imagem, diminuições nítidas na UBF no início das contracções e recuperação mais lenta da UBF dos níveis basais. A UBF recuperou os níveis basais apenas durante o tônus “normal”. B. Efeito do aumento da freqüência das contrações na UBF produzida pela estimulação da oxitocina do trabalho de parto espontâneo mostrado em A. Note que a duração das fases do tônus normal é diminuída. A taxa UBF obtida entre as contrações depende da intensidade da contração anterior e da duração da fase do tônus normal. Após as contrações 7 e 12, a recuperação do fluxo foi incompleta porque a contração seguinte ocorreu sem uma fase de tônus normal (De Greiss FC, Jr, Anderson SG: Clin Obstet Gynecol 11:96, 1968). Cortesia de Harper & Row, Publishers.)
Local Anesthetic Agents
Estas drogas podem exercer efeitos em um leito vascular diretamente, como após a injeção intravascular inadvertida, e indiretamente, como resultado da paralisia de nervos autonômicos que mantêm o tônus vascular normal. Na maioria dos órgãos, as injeções intravasculares não têm efeitos significativos sobre a resistência vascular. No entanto, as vasculaturas uterina e placentária respondem a tais estímulos com vasoconstrição significativa. Além disso, o miométrio é estimulado de forma variável por tais drogas (Fig. 8). Sozinhas ou juntas, estas respostas diminuem a FBP. Após o bloqueio paracervical anestésico administrado durante o parto, pode ocorrer uma bradicardia fetal retardada. A melhor hipótese para explicar a resposta fetal é que agentes anestésicos locais são injetados perto das artérias uterinas e que, devido à sua excelente penetração, atravessam as paredes arteriais para causar seus efeitos uterinos diminuindo a FBP e causando hipóxia fetal.
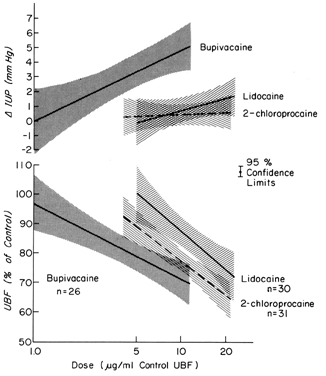 Fig. 8. Relações dose-resposta dos agentes anestésicos locais administrados diretamente na artéria uterina à condutância vascular uterina e à pressão intra-uterina durante a gestação dos ovinos. Os níveis de dose efetiva estão dentro das faixas observadas nos fetos durante bradicardia após bloqueio paracervical anestésico.(From Fishburne JI, Jr et al: Responses of the gravid uterine vasculature to arterial levels of local anesthetic agents. Am J Obstet Gynecol 133:753, 1979. Cortesia de The C. V. Mosby Company.)
Fig. 8. Relações dose-resposta dos agentes anestésicos locais administrados diretamente na artéria uterina à condutância vascular uterina e à pressão intra-uterina durante a gestação dos ovinos. Os níveis de dose efetiva estão dentro das faixas observadas nos fetos durante bradicardia após bloqueio paracervical anestésico.(From Fishburne JI, Jr et al: Responses of the gravid uterine vasculature to arterial levels of local anesthetic agents. Am J Obstet Gynecol 133:753, 1979. Cortesia de The C. V. Mosby Company.)
