Quando um gás em fluxo constante passa por uma constrição, por exemplo, em um orifício ou válvula, normalmente experimenta uma mudança de temperatura. Isto é em parte devido a mudanças na energia cinética, mas há outra parte contribuída pela não idealidade do gás. Se as condutas a montante e a jusante são suficientemente grandes para que a energia cinética seja insignificante nestas estações, as temperaturas a montante e a jusante são medidas longe o suficiente da perturbação criada pela constrição e o sistema é adiabático; o efeito medido é devido apenas à não idealidade. Desde a primeira lei da termodinâmica, tal processo é isentálpico e pode-se definir um coeficiente Joule-Thomson como:
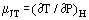
como uma medida da mudança de temperatura que resulta de uma queda de pressão através da constrição.
Para a maioria dos gases reais em torno das condições ambientais, μ é positivo – ou seja, a temperatura cai à medida que passa através da constrição. Para hidrogênio e hélio, é negativo e a temperatura aumenta. Em temperaturas mais elevadas, para a maioria dos gases, μ cai e pode até tornar-se negativo, μ também pode tornar-se negativo através da aplicação de pressão, mesmo à temperatura ambiente, mas pressões superiores a 200 bar são normalmente necessárias para atingir este objectivo.
