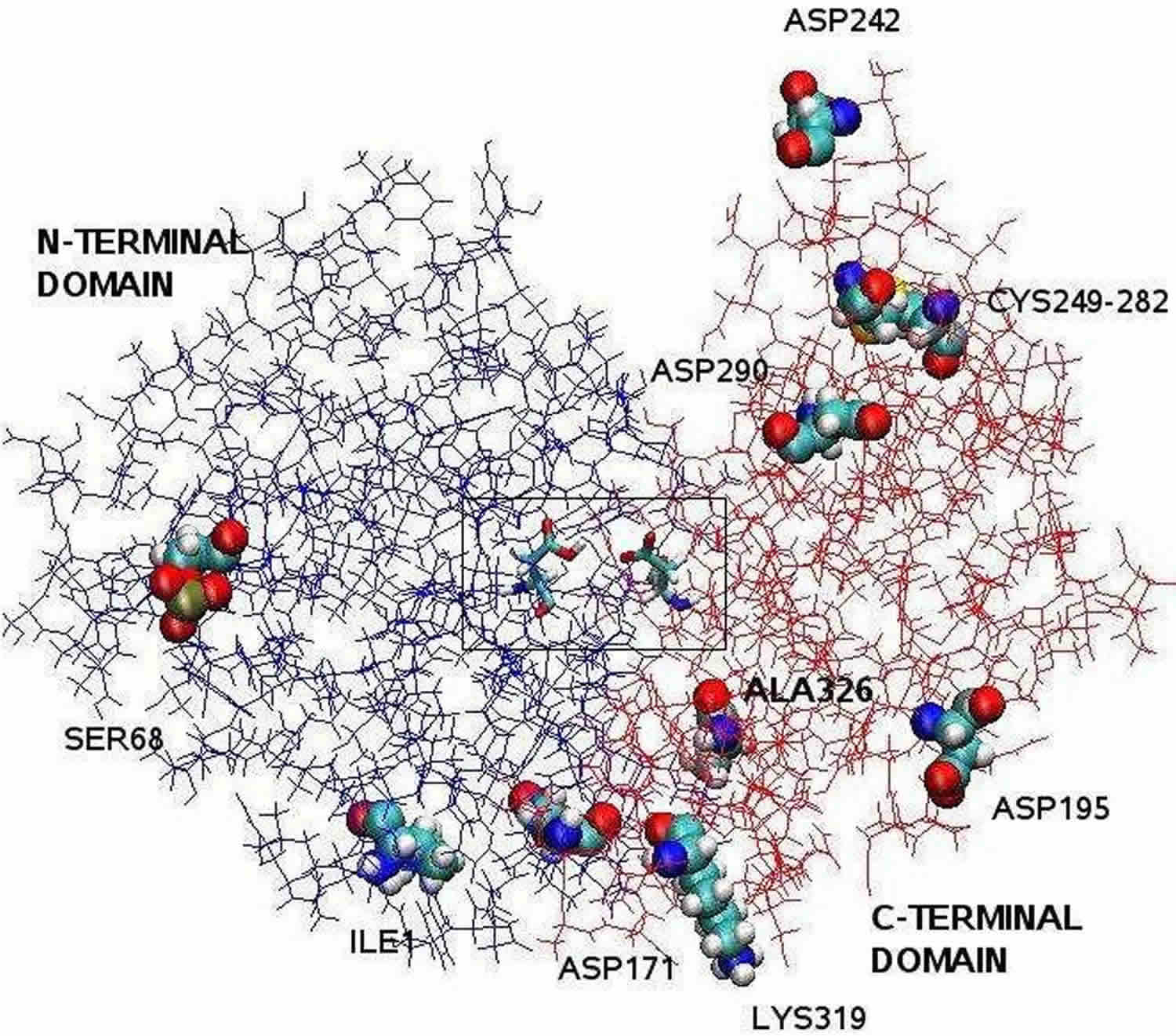
 Pé: A estrutura da pepsina clarificada pela cristalografia de raios X é bilobal com uma grande fenda de sítio ativo entre os dois lóbulos. Os resíduos 1 a 175 formam o domínio N-terminal, enquanto que os resíduos 176 a 326 constituem o domínio C-terminal. Dois aspartatos no centro da fenda, Asp32 e Asp215, funcionam como resíduos catalíticos. O sítio catalítico, composto pela Asp32 e Asp215, está localizado no centro da fenda. Os resíduos de aminoácidos carregados localizados na superfície da proteína são, Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal um), Ala326 (C-terminal um). O Ser68 fosforilado está totalmente exposto ao solvente e a ponte de dissulfeto entre Cys 249 e Cys 282 está localizada na superfície da proteína.
Pé: A estrutura da pepsina clarificada pela cristalografia de raios X é bilobal com uma grande fenda de sítio ativo entre os dois lóbulos. Os resíduos 1 a 175 formam o domínio N-terminal, enquanto que os resíduos 176 a 326 constituem o domínio C-terminal. Dois aspartatos no centro da fenda, Asp32 e Asp215, funcionam como resíduos catalíticos. O sítio catalítico, composto pela Asp32 e Asp215, está localizado no centro da fenda. Os resíduos de aminoácidos carregados localizados na superfície da proteína são, Asp171, Asp195, Asp242, Asp290, Lys319, Ile1 (N-terminal um), Ala326 (C-terminal um). O Ser68 fosforilado está totalmente exposto ao solvente e a ponte de dissulfeto entre Cys 249 e Cys 282 está localizada na superfície da proteína.
Pepsina, como protease aspártica, tem um pH óptimo muito baixo. Kondjoyan, Daudin, e Santé-Lhoutellier 9) estudaram a digestibilidade das proteínas miofibrilares encontradas com a atividade máxima de pepsina em pH em torno de 2. Pletschke, Naudé e Oelofsen 10) estudaram a hidrólise da hemoglobina por suínos e avestruz, e também encontraram um pH ótimo de 2,0 para a atividade da pepsina. Uma vez ativado por pH <4,5, a enzima pepsina é facilmente desnaturada por pH acima de 7,0, constituindo propriedades que determinam as características da pepsina 11).
Em contraste com a influência do pH, o efeito da força iônica sobre a atividade enzimática é menos discutido. Trabalhos anteriores de Dale e White 12) mostraram que o aumento da força iônica diminui claramente a taxa de reação da ribonuclease pancreática imobilizada, enquanto Butré, Wierenga e Gruppen 13) estudaram a hidrólise enzimática da proteína isolada do soro de leite por alcalase e neutrase, e também descobriram que a presença de 0.NaCl 5M diminuiu a taxa de hidrólise.
Dois potentes inibidores naturais da pepsina são conhecidos: pepstatina, um pentapéptido de Streptomyces, e um inibidor proteico único de Ascaris. A pepsina também sofre inibição de feedback; um produto da digestão da proteína retarda a reação inibindo a pepsina 14).
Onde é produzida a pepsina?
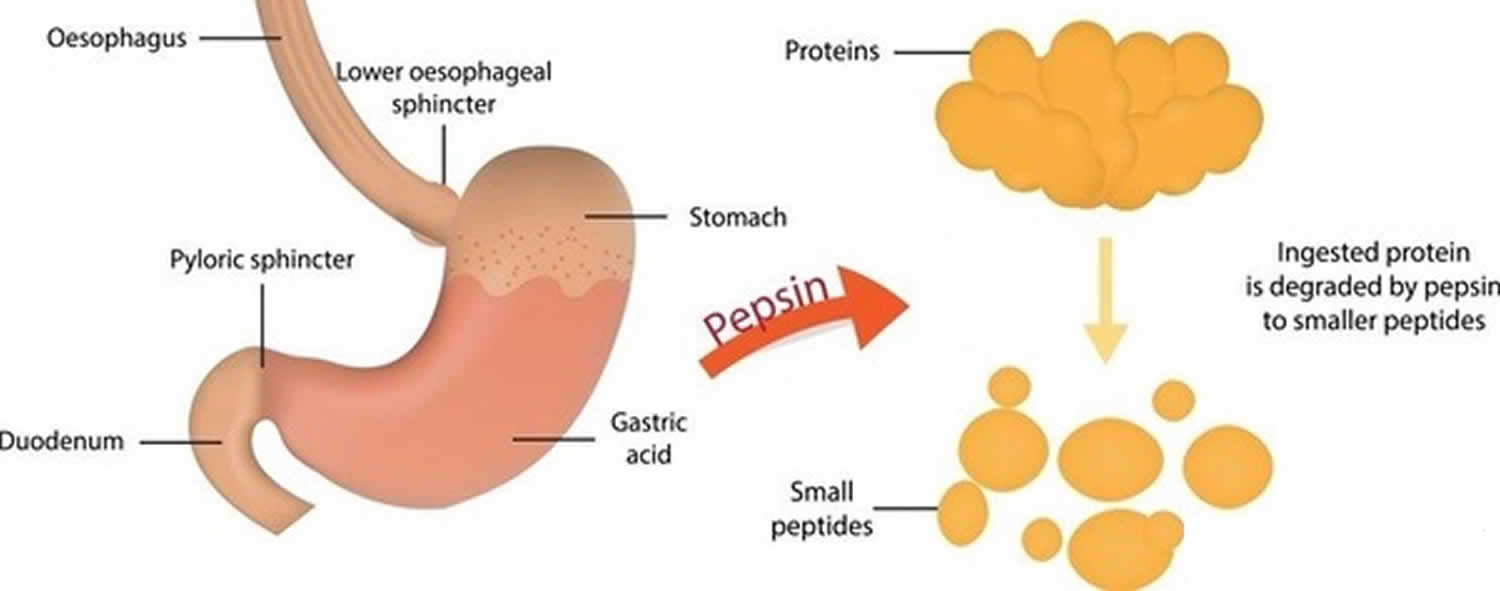
As células principais secretam a pepsina na forma de um precursor enzimático inativo chamado pepsinogênio. Quando o pepsinogênio entra em contato com o ácido clorídrico das células parietais, ele se decompõe rapidamente, formando a pepsina 15). A pepsina inicia a digestão de quase todos os tipos de proteína dietética em polipéptidos. Esta enzima é mais ativa em um ambiente ácido, que é fornecido pelo ácido clorídrico no suco gástrico.
Figure 2. Células do estômago (glândulas gástricas)
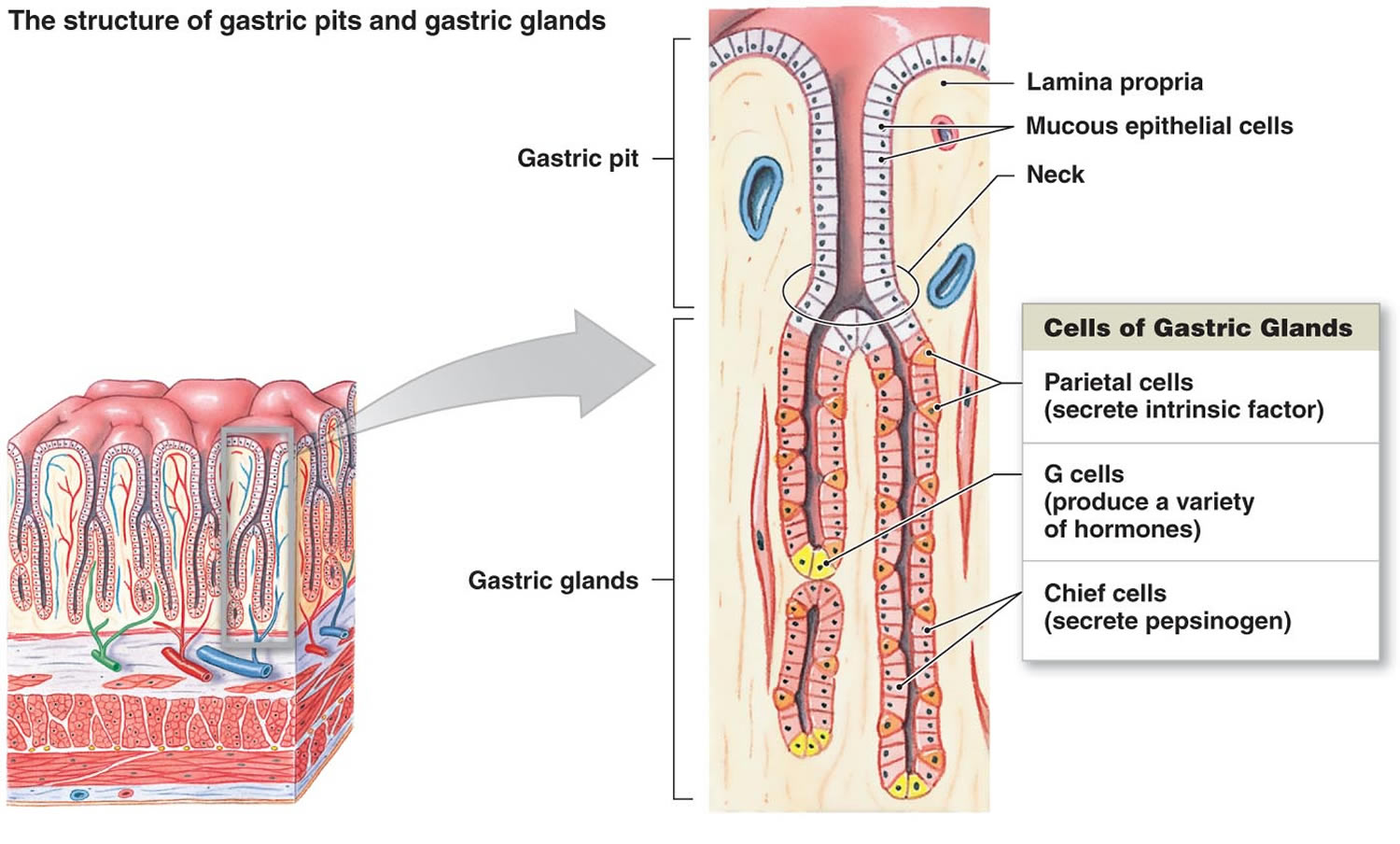 Footnote: Forro do estômago. As glândulas gástricas incluem células mucosas, células parietais e células principais. A mucosa do estômago é cravejada com fossas gástricas que são as aberturas das glândulas gástricas.
Footnote: Forro do estômago. As glândulas gástricas incluem células mucosas, células parietais e células principais. A mucosa do estômago é cravejada com fossas gástricas que são as aberturas das glândulas gástricas.
O que a pepsina faz?
Pepsina formada por pepsinogênio (forma inativa de pepsina) na presença de ácido clorídrico, digere quase todos os tipos de proteína dietética em polipéptidos (compostos proteicos menores). A pepsina digere proteínas em ácido estomacal forte. A pepsina é otimizada para a digestão de alimentos no ambiente ácido do estômago e é a primeira protease que as proteínas alimentares encontram no trato digestivo. A pepsina é mais ativa em ambientes ácidos entre 37 °C e 42 °C 16).
A especificidade da pepsina (ou seja, a probabilidade de clivagem das ligações do peptídeo pela pepsina) é influenciada principalmente pelos resíduos de aminoácidos na posição P1 e P1′, enquanto os resíduos de aminoácidos em outros subsitos também podem desempenhar um papel. Em geral, a pepsina prefere clivar após fenilalanina, leucina e metionina, enquanto que raramente cliva após histidina, lisina, prolina e arginina 17). Resíduos aromáticos tirosina, triptofano, e fenilalanina são favorecidos na posição P1′. A prolina é fortemente desfavorecida na posição P2, P2′ e P3′, enquanto a histidina, lisina e arginina são favorecidas na posição P3. As posições P4 e P4′ têm pouca influência 18).
Figure 3. Função Pepsin