OBJETIVOS ADVERTENTES
- Descrever a energia da ligação covalente e iônica formação e quebra
- Utilizar energias médias de ligação covalentes para estimar entalpias de reação
A força de uma ligação descreve o quão fortemente cada átomo está unido a outro átomo, e, portanto, quanta energia é necessária para quebrar a ligação entre os dois átomos.
É essencial lembrar que a energia deve ser adicionada para quebrar as ligações químicas (um processo endotérmico), enquanto que a formação de ligações químicas libera energia (um processo exotérmico). No caso de ![]() , a ligação covalente é muito forte; uma grande quantidade de energia, 436 kJ, deve ser adicionada para quebrar as ligações em uma molécula de hidrogênio e causar a separação dos átomos:
, a ligação covalente é muito forte; uma grande quantidade de energia, 436 kJ, deve ser adicionada para quebrar as ligações em uma molécula de hidrogênio e causar a separação dos átomos:
![]()
Conversamente, a mesma quantidade de energia é libertada quando uma toupeira de ![]() forma moléculas de dois moles de átomos de H:
forma moléculas de dois moles de átomos de H:
![]()
Força de ligação: Ligações covalentes
Existem moléculas estáveis porque as ligações covalentes mantêm os átomos juntos. Medimos a força de uma ligação covalente pela energia necessária para quebrá-la, ou seja, a energia necessária para separar os átomos ligados. A separação de qualquer par de átomos unidos requer energia. Quanto mais forte uma ligação, maior a energia necessária para a quebrar.
A energia necessária para quebrar uma ligação covalente específica numa molécula gasosa é chamada energia de ligação ou energia de dissociação da ligação. A energia de ligação para uma molécula diatômica, ![]() , é definido como a mudança de entalpia padrão para a reação endotérmica:
, é definido como a mudança de entalpia padrão para a reação endotérmica:
![]()
Por exemplo, a energia de ligação da ligação H-H pura covalente, ![]() , é 436 kJ por mole de ligações H-H quebradas:
, é 436 kJ por mole de ligações H-H quebradas:
![]()
Moléculas com três ou mais átomos têm duas ou mais ligações. A soma de todas as energias de ligação em tal molécula é igual à mudança de entalpia padrão para a reação endotérmica que quebra todas as ligações na molécula. Por exemplo, a soma das quatro energias de ligação C-H em ![]() , 1660 kJ, é igual à mudança de entalpia padrão da reação:
, 1660 kJ, é igual à mudança de entalpia padrão da reação:

A energia média de ligação C-H, ![]() , é 1660/4 = 415 kJ/mol porque existem quatro toupeiras de ligações C-H quebradas por toupeira da reacção. Embora as quatro ligações C-H sejam equivalentes na molécula original, cada uma delas não requer a mesma energia para quebrar; uma vez que a primeira ligação é quebrada (que requer 439 kJ/mol), as ligações restantes são mais fáceis de quebrar. O valor de 415 kJ/mol é a média, não o valor exacto necessário para quebrar qualquer ligação.
, é 1660/4 = 415 kJ/mol porque existem quatro toupeiras de ligações C-H quebradas por toupeira da reacção. Embora as quatro ligações C-H sejam equivalentes na molécula original, cada uma delas não requer a mesma energia para quebrar; uma vez que a primeira ligação é quebrada (que requer 439 kJ/mol), as ligações restantes são mais fáceis de quebrar. O valor de 415 kJ/mol é a média, não o valor exacto necessário para quebrar qualquer ligação.
A força de uma ligação entre dois átomos aumenta à medida que o número de pares de electrões na ligação aumenta. Geralmente, à medida que a resistência da ligação aumenta, o comprimento da ligação diminui. Assim, descobrimos que as ligações triplas são mais fortes e mais curtas que as ligações duplas entre os mesmos dois átomos; do mesmo modo, as ligações duplas são mais fortes e mais curtas que as ligações simples entre os mesmos dois átomos. As energias médias das ligações para algumas ligações comuns aparecem na tabela abaixo, e uma comparação dos comprimentos e da força das ligações para algumas ligações comuns aparece na tabela seguinte. Quando um átomo se liga a vários átomos de um grupo, a força da ligação normalmente diminui à medida que nos movemos para baixo no grupo. Por exemplo, ![]() é 439 kJ/mol,
é 439 kJ/mol, ![]() é 330 kJ/mol, e
é 330 kJ/mol, e ![]() é 275 kJ/mol.
é 275 kJ/mol.
| Bond Energies (kJ/mol) | |||||||
|---|---|---|---|---|---|---|---|
| Bond | Bond Energy | Bond | Bond Energy | Bond | Bond Energy | ||
|
|
436 | |
260 | 255 | |||
| 415 | 330 |
|
235 | ||||
| 390 | 275 | 230 | |||||
| |
464 | 240 |
|
215 | |||
| 569 | 160 | 225 | |||||
| > |
395 | 418 | 359 | ||||
| |
320 | 946 | 290 | ||||
| |
340 | 200 | 215 | ||||
| |
432 | 270 | 215 | ||||
| |
370 | 210 | 230 | ||||
| |
295 | 200 |
|
330 | |||
| |
345 | 245 | 270 | ||||
| 611 | 140 | 215 | |||||
| |
837 | 498 | 215 | ||||
| |
290 |
|
160 |
|
250 | ||
| 615 | 370 | 215 | |||||
| |
891 | 350 | 243 | ||||
| |
350 | 205 | 220 | ||||
| |
741 | 200 | 210 | ||||
| |
1080 | 160 | 190 | ||||
| |
439 | 540 | 180 | ||||
| |
360 | 489 | 150 | ||||
| 265 | 285 | ||||||
| Comprimento médio da ligação e energias da ligação para alguns Ligações Comuns | ||
|---|---|---|
| Bond | Bond Length (Å) | Bond Energy (kJ/mol) |
|
|
1.54 | 345 |
| 1.34 | 611 | |
| 1.20 | 837 | |
| 1.43 | 290 | |
| 1.38 | 615 | |
| 1.16 | 891 | |
| 1.43 | 350 | |
| 1.23 | 741 | |
| 1.13 | 1080 | |
A energia de ligação é a diferença entre a energia mínima (que ocorre à distância da ligação) e a energia dos dois átomos separados. Esta é a quantidade de energia liberada quando a ligação é formada. Por outro lado, a mesma quantidade de energia é necessária para quebrar a ligação. Para a ligação ![]() molécula mostrada na tabela acima, na distância de ligação de 74 pm o sistema é 7,24 × 10-19 J mais baixo em energia do que os dois átomos de hidrogênio separados. Isto pode parecer um número pequeno. No entanto, como aprenderemos com mais detalhes mais tarde, as energias de ligação são frequentemente discutidas numa base de por-molécula. Por exemplo, é necessário 7,24 × 10-19 J para quebrar uma ligação H-H, mas é necessário 4,36 × 105 J para quebrar 1 mole de ligações H-H. Uma comparação de alguns comprimentos e energias das ligações é mostrada nas tabelas acima. Podemos encontrar muitas dessas ligações em uma variedade de moléculas, e esta tabela fornece valores médios. Por exemplo, quebrar a primeira ligação C-H em
molécula mostrada na tabela acima, na distância de ligação de 74 pm o sistema é 7,24 × 10-19 J mais baixo em energia do que os dois átomos de hidrogênio separados. Isto pode parecer um número pequeno. No entanto, como aprenderemos com mais detalhes mais tarde, as energias de ligação são frequentemente discutidas numa base de por-molécula. Por exemplo, é necessário 7,24 × 10-19 J para quebrar uma ligação H-H, mas é necessário 4,36 × 105 J para quebrar 1 mole de ligações H-H. Uma comparação de alguns comprimentos e energias das ligações é mostrada nas tabelas acima. Podemos encontrar muitas dessas ligações em uma variedade de moléculas, e esta tabela fornece valores médios. Por exemplo, quebrar a primeira ligação C-H em ![]() requer 439,3 kJ/mol, enquanto que quebrar a primeira ligação C-H em
requer 439,3 kJ/mol, enquanto que quebrar a primeira ligação C-H em ![]() (um diluente comum) requer 375.5 kJ/mol.
(um diluente comum) requer 375.5 kJ/mol.
Como se vê nas tabelas acima, uma ligação média de carbono carbono simples é de 347 kJ/mol, enquanto que numa ligação dupla de carbono carbono, a ligação ![]() aumenta a resistência da ligação em 267 kJ/mol. A adição de um adicional
aumenta a resistência da ligação em 267 kJ/mol. A adição de um adicional ![]() bond causa um aumento adicional de 225 kJ/mol. Podemos ver um padrão semelhante quando comparamos outros
bond causa um aumento adicional de 225 kJ/mol. Podemos ver um padrão semelhante quando comparamos outros ![]() e
e ![]() bond. Assim, cada indivíduo
bond. Assim, cada indivíduo ![]() bond é geralmente mais fraco que um correspondente
bond é geralmente mais fraco que um correspondente ![]() bond entre os mesmos dois átomos. Num
bond entre os mesmos dois átomos. Num ![]() bond, existe um maior grau de sobreposição orbital do que num
bond, existe um maior grau de sobreposição orbital do que num ![]() bond.
bond.
Podemos usar energias de bond para calcular alterações aproximadas de entalpia para reacções onde as entalpias de formação não estão disponíveis. Cálculos deste tipo também nos dirão se uma reação é exotérmica ou endotérmica. Uma reação exotérmica (ΔH negativo, calor produzido) resulta quando as ligações nos produtos são mais fortes do que as ligações nos reagentes. Uma reação endotérmica (ΔH positivo, calor absorvido) resulta quando as ligações nos produtos são mais fracas que as ligações nos reatantes.
A mudança de entalpia, ΔH, para uma reação química é aproximadamente igual à soma da energia necessária para quebrar todas as ligações nos reatantes (energia “in”, sinal positivo) mais a energia liberada quando todas as ligações são formadas nos produtos (energia “out”, sinal negativo). Isto pode ser expresso matematicamente da seguinte forma:
![]()
Nesta expressão, o símbolo ![]() significa “a soma de” e D representa a energia de ligação em kilojoules por toupeira, que é sempre um número positivo. A energia da ligação é obtida a partir de uma tabela e dependerá se a ligação em particular é uma ligação simples, dupla ou tripla. Assim, ao calcular as entalpias desta forma, é importante que consideremos a ligação em todos os reagentes e produtos. Porque os valores D são tipicamente médias para um tipo de ligação em muitas moléculas diferentes, este cálculo fornece uma estimativa aproximada, não um valor exato, para a entalpia da reação.
significa “a soma de” e D representa a energia de ligação em kilojoules por toupeira, que é sempre um número positivo. A energia da ligação é obtida a partir de uma tabela e dependerá se a ligação em particular é uma ligação simples, dupla ou tripla. Assim, ao calcular as entalpias desta forma, é importante que consideremos a ligação em todos os reagentes e produtos. Porque os valores D são tipicamente médias para um tipo de ligação em muitas moléculas diferentes, este cálculo fornece uma estimativa aproximada, não um valor exato, para a entalpia da reação.
Considere a seguinte reação:
![]()
ou
![]()
Para formar duas toupeiras de ![]() , uma toupeira de ligações H-H e uma toupeira de ligações Cl-Cl devem ser quebradas. A energia necessária para quebrar estas ligações é a soma da energia da ligação H-H (436 kJ/mol) e da ligação Cl-Cl (243 kJ/mol). Durante a reação, dois moles de ligações H-Cl são formados (energia da ligação = 432 kJ/mol), liberando 2 × 432 kJ; ou 864 kJ. Como as ligações nos produtos são mais fortes do que as dos reagentes, a reacção liberta mais energia do que consome:
, uma toupeira de ligações H-H e uma toupeira de ligações Cl-Cl devem ser quebradas. A energia necessária para quebrar estas ligações é a soma da energia da ligação H-H (436 kJ/mol) e da ligação Cl-Cl (243 kJ/mol). Durante a reação, dois moles de ligações H-Cl são formados (energia da ligação = 432 kJ/mol), liberando 2 × 432 kJ; ou 864 kJ. Como as ligações nos produtos são mais fortes do que as dos reagentes, a reacção liberta mais energia do que consome:
| |
||
Este excesso de energia é libertado como calor, por isso a reacção é exotérmica. O Apêndice G dá um valor para a entalpia molar padrão de formação de ![]() ,
, ![]() , de -92.307 kJ/mol. Duas vezes esse valor é de -184,6 kJ, o que concorda bem com a resposta obtida anteriormente para a formação de dois moles de HCl.
, de -92.307 kJ/mol. Duas vezes esse valor é de -184,6 kJ, o que concorda bem com a resposta obtida anteriormente para a formação de dois moles de HCl.
>
EXAMPLE
Using Bond Energies to Calculate Approximate Enthalpy Changes
Methanol, ![]() , pode ser um excelente combustível alternativo. A reacção a alta temperatura do vapor e do carbono produz uma mistura dos gases monóxido de carbono,
, pode ser um excelente combustível alternativo. A reacção a alta temperatura do vapor e do carbono produz uma mistura dos gases monóxido de carbono, ![]() , e hidrogênio,
, e hidrogênio, ![]() , a partir do qual o metanol pode ser produzido. Usando as energias de ligação das tabelas acima, calcule a mudança de entalpia aproximada, ΔH, para a reação aqui:
, a partir do qual o metanol pode ser produzido. Usando as energias de ligação das tabelas acima, calcule a mudança de entalpia aproximada, ΔH, para a reação aqui:
![]()
Solução
Primeiro, precisamos escrever as estruturas de Lewis dos reagentes e os produtos:

Desta reação, vemos que ΔH para esta reação envolve a energia necessária para quebrar uma ligação C-O tripla e duas ligações H-H simples, assim como a energia produzida pela formação de três ligações C-H simples, uma ligação C-O simples, e uma ligação O-H simples. Podemos expressar isto da seguinte forma:
| >Delta H = ” height=”14″ width=”59″ style=”vertical-align: 0px”> |
Usando os valores da energia de ligação na tabela, nós obtemos:
Podemos comparar este valor com o valor calculado com base em ![]() dados do Apêndice G:
dados do Apêndice G:
| |
Notem que existe uma lacuna bastante significativa entre os valores calculados usando os dois métodos diferentes. Isto ocorre porque os valores D são a média das diferentes forças de ligação; portanto, muitas vezes eles dão apenas uma concordância aproximada com outros dados.
Check Your Learning
Ethyl alcohol, ![]() , foi um dos primeiros químicos orgânicos deliberadamente sintetizados pelos humanos. Tem muitos usos na indústria, e é o álcool contido nas bebidas alcoólicas. Pode ser obtido pela fermentação do açúcar ou sintetizado pela hidratação do etileno na seguinte reação:
, foi um dos primeiros químicos orgânicos deliberadamente sintetizados pelos humanos. Tem muitos usos na indústria, e é o álcool contido nas bebidas alcoólicas. Pode ser obtido pela fermentação do açúcar ou sintetizado pela hidratação do etileno na seguinte reação:

Usando as energias de ligação na tabela, calcule uma mudança de entalpia aproximada, ΔH, para esta reação.
-35 kJ
Força de Ligação Iônica e Energia da Malha
Um composto iônico é estável devido à atração eletrostática entre seus íons positivos e negativos. A energia da malha de um composto é uma medida da força dessa atração. A energia da malha (ΔHlattice) de um composto iônico é definida como a energia necessária para separar uma molécula do sólido em seus íons gasosos componentes. Para o sólido iônico MX, a energia da malha é a mudança de entalpia do processo:
![]()
Nota que estamos usando a convenção onde o sólido iônico é separado em íons, então nossas energias da malha serão endotérmicas (valores positivos). Alguns textos utilizam a convenção equivalente mas oposta, definindo a energia da malha como a energia libertada quando iões separados se combinam para formar uma malha e dando valores negativos (exotérmicos). Assim, se você estiver procurando energias da malha em outra referência, esteja certo de verificar qual definição está sendo usada. Em ambos os casos, uma maior magnitude para a energia da grelha indica um composto iônico mais estável. Para cloreto de sódio, ![]() . Assim, é necessário 769 kJ para separar uma toupeira de sólido
. Assim, é necessário 769 kJ para separar uma toupeira de sólido ![]() em gasoso
em gasoso ![]() e
e ![]() iões. Quando uma toupeira em cada um dos gases
iões. Quando uma toupeira em cada um dos gases ![]() e
e ![]() iões formam sólidos
iões formam sólidos ![]() , 769 kJ de calor é libertado.
, 769 kJ de calor é libertado.
A energia da malha ![]() de um cristal iônico pode ser expresso pela seguinte equação (derivada da lei de Coulomb, que rege as forças entre as cargas elétricas):
de um cristal iônico pode ser expresso pela seguinte equação (derivada da lei de Coulomb, que rege as forças entre as cargas elétricas):
![]()
em que C é uma constante que depende do tipo de estrutura do cristal; Z+ e Z- são as cargas sobre os iões; e Ro é a distância interiónica (a soma dos raios dos iões positivos e negativos). Assim, a energia da malha de um cristal iônico aumenta rapidamente à medida que as cargas dos íons aumentam e os tamanhos dos íons diminuem. Quando todos os outros parâmetros são mantidos constantes, a duplicação da carga do catião e do anião quadruplica a energia da grelha. Por exemplo, a energia da treliça de ![]() (Z+ e Z- = 1) é 1023 kJ/mol, enquanto que o de
(Z+ e Z- = 1) é 1023 kJ/mol, enquanto que o de ![]() (Z+ e Z- = 2) é de 3900 kJ/mol (Ro é quase o mesmo – cerca de 200 pm para ambos os compostos).
(Z+ e Z- = 2) é de 3900 kJ/mol (Ro é quase o mesmo – cerca de 200 pm para ambos os compostos).
Diferentes distâncias interatómicas produzem diferentes energias de grelha. Por exemplo, podemos comparar a energia da malha de ![]() (2957 kJ/mol) com a de
(2957 kJ/mol) com a de ![]() (2327 kJ/mol) para observar o efeito na energia da malha do menor tamanho iônico de F- em comparação com I-.
(2327 kJ/mol) para observar o efeito na energia da malha do menor tamanho iônico de F- em comparação com I-.
EXEMPLO
Comparações da energia da malha
A preciosa gema rubi é óxido de alumínio, ![]() , contendo vestígios de
, contendo vestígios de ![]() . O composto
. O composto ![]() é usado na fabricação de alguns dispositivos semicondutores. Que tem a maior energia da malha,
é usado na fabricação de alguns dispositivos semicondutores. Que tem a maior energia da malha, ![]() ou
ou ![]() ?
?
Solução
Nestes dois compostos iônicos, as cargas Z+ e Z- são as mesmas, portanto a diferença na energia da malha dependerá de Ro. O ![]() ion é menor que o
ion é menor que o ![]() ião. Assim,
ião. Assim, ![]() teria uma distância interiónica mais curta que
teria uma distância interiónica mais curta que ![]() , e
, e ![]() teria a maior energia da malha.
teria a maior energia da malha.
Check Your Learning
Zinc oxide, ![]() , é um protector solar muito eficaz. Como seria a energia da malha de
, é um protector solar muito eficaz. Como seria a energia da malha de ![]() comparar com o de
comparar com o de ![]() ?
?
KEY TAKEAWAYS
A força de uma ligação covalente é medida pela sua energia de dissociação da ligação, ou seja, a quantidade de energia necessária para quebrar essa ligação particular numa molécula. Ligações múltiplas são mais fortes que ligações simples entre os mesmos átomos. A entalpia de uma reação pode ser estimada com base na energia necessária para quebrar ligações e na energia liberada quando novas ligações são formadas. Para as ligações iónicas, a energia da malha é a energia necessária para separar uma molécula de um composto nos seus iões da fase gasosa. A energia da malha aumenta para íons com cargas mais altas e distâncias mais curtas entre íons.
- Energia da malha para uma molécula diatômica:
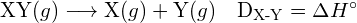
- Mudança de letalidade:

- Energia de um MX sólido:
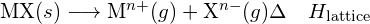
- Energia de um cristal iónico:
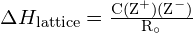
PONTO DO CAPÍTULO EXERCÍCIOS
- Que ligação em cada um dos seguintes pares de ligações é a mais forte? (a)
 ou
ou 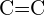 (b)
(b) 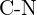 ou
ou 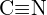 (c)
(c) 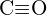 ou
ou 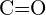 (d)
(d) 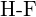 ou
ou 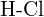 (e)
(e) 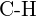 ou
ou 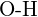 (f)
(f) 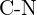 ou
ou 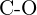
- Usando as energias de ligação na tabela, determinar a mudança de entalpia aproximada para cada uma das seguintes reacções: (a)
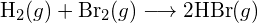 (b)
(b) 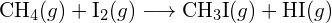 (c)
(c) 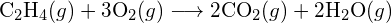 (a) -114 kJ; (b) 30 kJ; (c) -1055 kJ
(a) -114 kJ; (b) 30 kJ; (c) -1055 kJ - Usando as energias de ligação na tabela, determinar a mudança de entalpia aproximada para cada uma das seguintes reacções: (a)
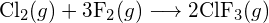 (b)
(b) 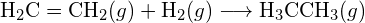 (c)
(c) 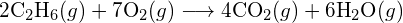
- Desenhar uma curva que descreve a energia de um sistema com átomos H e Cl a distâncias variáveis. Depois, encontre a energia mínima desta curva de duas maneiras.(a) Use a energia de ligação encontrada nas tabelas para calcular a energia para um único
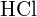 bond (Dica: Quantas ligações estão numa toupeira?)(b) Use a entalpia da reação e as energias de ligação para H2 e Cl2 para resolver para a energia de uma toupeira de
bond (Dica: Quantas ligações estão numa toupeira?)(b) Use a entalpia da reação e as energias de ligação para H2 e Cl2 para resolver para a energia de uma toupeira de 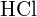 obrigações.
obrigações.
Explique porque é que as ligações ocorrem a distâncias médias específicas da ligação em vez dos átomos se aproximarem uns dos outros infinitamente próximos.
A distância média específica da ligação é a distância com a energia mais baixa. Em distâncias inferiores à distância da ligação, as cargas positivas nos dois núcleos se repelem, e a energia total aumenta. - Quando uma molécula pode formar duas estruturas diferentes, a estrutura com as ligações mais fortes é geralmente a forma mais estável. Use energias de ligação para prever a estrutura correta da molécula de hidroxilamina:
 A maior energia de ligação está na figura à esquerda. É a forma mais estável.
A maior energia de ligação está na figura à esquerda. É a forma mais estável. - Como é que a energia de ligação de
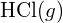 diferem da entalpia padrão de formação de
diferem da entalpia padrão de formação de 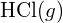 ?
? - Usando a entalpia padrão dos dados de formação no Apêndice G, mostrar como a entalpia padrão de formação de
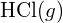 pode ser usado para determinar a energia de ligação.
pode ser usado para determinar a energia de ligação.
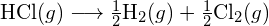
\Delta H_1^{\circ} = -Delta H_{\i1}{\i}{\i1}texto {\i}{\i1}- 5338> 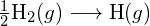
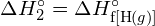
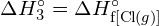
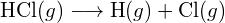
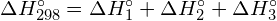
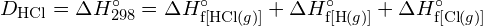
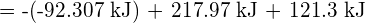
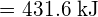
- Usando a entalpia padrão dos dados de formação no Apêndice G, calcular a energia de ligação da ligação dupla de carbono e enxofre em
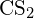 .
. - Usando a entalpia padrão dos dados de formação no Apêndice G, determine qual ligação é mais forte: a ligação S-F em
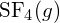 ou em
ou em 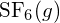 ?
A ligação S-F em
?
A ligação S-F em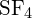 é mais forte.
é mais forte. - Usando a entalpia padrão dos dados de formação no Apêndice G, determine qual ligação é mais forte: a ligação P-Cl em
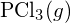 ou em
ou em 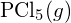 ?
? - Completar a seguinte estrutura Lewis adicionando ligações (não átomos), e depois indicar a ligação mais longa:

 As ligações simples C-C são as mais longas.
As ligações simples C-C são as mais longas. - Utiliza a energia da ligação para calcular um valor aproximado de ΔH para a seguinte reacção. Que é a forma mais estável de
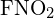 ?
?
- Utilizar princípios de estrutura atômica para responder a cada um dos seguintes:1 (a) O raio do átomo Ca é 197 pm; o raio do átomo
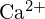 íon é 99 pm. Conta para a diferença. (b) A energia da malha de
íon é 99 pm. Conta para a diferença. (b) A energia da malha de 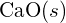 é de -3460 kJ/mol; a energia da malha de
é de -3460 kJ/mol; a energia da malha de 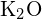 é -2240 kJ/mol. Conta para a diferença. (c) Dados estes valores de ionização, explicar a diferença entre Ca e K em relação à sua primeira e segunda energia de ionização.
é -2240 kJ/mol. Conta para a diferença. (c) Dados estes valores de ionização, explicar a diferença entre Ca e K em relação à sua primeira e segunda energia de ionização.
Element Primeira Energia de ionização (kJ/mol) Segunda Energia de ionização (kJ/mol) K 419 3050 Ca 590 1140 (d) A primeira energia de ionização de Mg é de 738 kJ/mol e a de Al é de 578 kJ/mol. Considere esta diferença.
(a) Quando dois elétrons são removidos da casca da valência, o raio Ca perde o nível de energia mais externo e reverte para o menor n = 3 nível, que é muito menor no raio.(b) A carga +2 sobre o cálcio puxa o oxigênio muito mais próximo em relação a K, aumentando assim a energia da malha em relação a um íon menos carregado.
(c) A remoção do electrão 4s em Ca requer mais energia do que a remoção do electrão 4s em K devido à maior atracção do núcleo e à energia extra necessária para quebrar o emparelhamento dos electrões. A segunda energia de ionização para K requer que um elétron seja removido de um nível de energia mais baixo, onde a atração é muito mais forte do núcleo para o elétron. Além disso, é necessária energia para desacoplar dois elétrons em uma órbita completa. Para Ca, o segundo potencial de ionização requer a remoção apenas de um electrão isolado no nível de energia exterior exposto.
(d) Em Al, o electrão removido está relativamente desprotegido e não emparelhado num orbital p. A maior energia para Mg reflete principalmente o desparelhamento do elétron 2s.
- Para qual das seguintes substâncias é a menor energia necessária para converter uma molécula do sólido em íons separados? (a)
 (b)
(b) 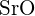 (c)
(c) 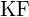 (d)
(d) 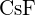 (e)
(e) 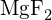 (d)
(d) - A reacção de um metal,
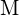 , com um halógeno,
, com um halógeno, 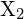 , procede por uma reação exotérmica como indicado por esta equação:
, procede por uma reação exotérmica como indicado por esta equação: 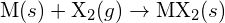 . Para cada uma das opções a seguir, indique qual a opção que tornará a reação mais exotérmica. Explique suas respostas. (a) um raio grande vs. um raio pequeno para
. Para cada uma das opções a seguir, indique qual a opção que tornará a reação mais exotérmica. Explique suas respostas. (a) um raio grande vs. um raio pequeno para 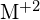 (b) uma energia de ionização alta vs. uma energia de ionização baixa para
(b) uma energia de ionização alta vs. uma energia de ionização baixa para 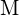 (c) uma energia de ligação crescente para o halogéneo (d) uma afinidade electrónica decrescente para o halogéneo (e) um tamanho crescente do ânion formado pelo halogéneo
(c) uma energia de ligação crescente para o halogéneo (d) uma afinidade electrónica decrescente para o halogéneo (e) um tamanho crescente do ânion formado pelo halogéneo - A energia da malha de
 é 1023 kJ/mol, e a distância Li-F é 201 pm.
é 1023 kJ/mol, e a distância Li-F é 201 pm.  cristaliza na mesma estrutura que
cristaliza na mesma estrutura que  mas com uma distância Mg-O de 205 pm. Qual dos seguintes valores se aproxima mais da energia da malha de
mas com uma distância Mg-O de 205 pm. Qual dos seguintes valores se aproxima mais da energia da malha de  : 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol, ou 4008 kJ/mol? Explique a sua escolha.
4008 kJ/mol; ambos os iões em
: 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol, ou 4008 kJ/mol? Explique a sua escolha.
4008 kJ/mol; ambos os iões em têm o dobro da carga dos iões em
têm o dobro da carga dos iões em  ; o comprimento da ligação é muito semelhante e ambos têm a mesma estrutura; espera-se um quadruplo da energia com base na equação para a energia da malha
; o comprimento da ligação é muito semelhante e ambos têm a mesma estrutura; espera-se um quadruplo da energia com base na equação para a energia da malha - Que composto em cada um dos pares seguintes tem a maior energia da malha? Nota:
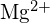 e
e 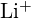 têm raios semelhantes;
têm raios semelhantes; 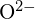 e
e 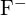 têm raios semelhantes. Explique as suas escolhas. (a)
têm raios semelhantes. Explique as suas escolhas. (a)  ou
ou 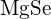 (b)
(b)  ou
ou  (c)
(c) 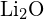 ou
ou 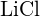 (d)
(d) 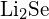 ou
ou 
- Que composto em cada um dos pares seguintes tem a maior energia da malha? Nota:
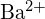 e
e 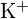 têm raios semelhantes;
têm raios semelhantes; 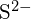 e
e 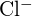 têm raios semelhantes. Explique as suas escolhas. (a)
têm raios semelhantes. Explique as suas escolhas. (a) 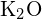 ou
ou 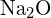 (b)
(b) 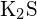 ou
ou  (c)
(c) 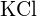 ou
ou  (d)
(d)  ou
ou 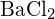 (a)
(a)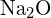 ;
; 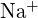 tem um raio menor que
tem um raio menor que 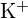 ; (b)
; (b)  ;
; 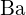 tem uma carga maior que
tem uma carga maior que 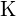 ; (c)
; (c)  ;
; 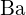 e
e 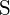 têm encargos maiores; (d)
têm encargos maiores; (d)  ;
; 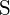 tem uma carga maior
tem uma carga maior - Qual dos seguintes compostos requer mais energia para converter uma toupeira do sólido em iões separados? (a)
 (b)
(b) 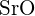 (c)
(c) 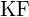 (d)
(d) 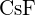 (e)
(e) 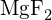
- Qual dos seguintes compostos requer mais energia para converter uma toupeira do sólido em iões separados? (a)
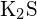 (b)
(b) 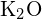 (c)
(c) 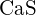 (d)
(d) 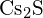 (e)
(e) 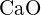 (e)
(e)
Pés
- 1 Esta pergunta é retirada do Exame de Colocação Avançada de Química e é usada com a permissão do Serviço de Testes Educativos.
Glossary
energia de ligação (também, energia de dissociação da ligação) energia necessária para romper uma ligação covalente em uma rede de substâncias gasosas (ΔHlattice) energia necessária para separar uma molécula de um sólido iônico em seu componente iões gasosos
energia necessária para separar uma toupeira de um sólido iónico no seu componente iões gasosos
>
>
I
>
>
>
